7.2: Теплові зміни під час хімічних реакцій
- Визначте енергію дисоціації зв'язків.
- Визначте, чи є хімічний процес екзотермічним або ендотермічним.
Загальне твердження, засноване на незліченних спостереженнях протягом століть дослідження, полягає в тому, що всі об'єкти, як правило, спонтанно рухаються в положення мінімальної енергії, якщо не діють на якусь іншу силу чи об'єкт.
Енергія дисоціації облігацій
Атоми зв'язуються між собою, утворюючи сполуки, оскільки при цьому вони досягають менших енергій, ніж вони мають як окремі атоми. Кількість енергії, рівне різниці енергій зв'язаних атомів і енергій відокремлених атомів, виділяється, як правило, у вигляді тепла. Тобто зв'язані атоми мають меншу енергію, ніж окремі атоми. Коли атоми об'єднуються, утворюючи з'єднання, енергія завжди виділяється, а сполука має нижчу загальну енергію. Створюючи сполуки, атоми діють як баскетбол на гірці ігрового майданчика; вони рухаються у напрямку зменшення енергії.
Ми можемо змінити процес шляхом введення енергії в молекулу, що змушує її зв'язки розриватися, розділяючи молекулу на окремі атоми. Зв'язки між певними специфічними елементами зазвичай мають характерну енергію, звану енергією дисоціації зв'язку, яка потрібна для розриву зв'язку. Така ж кількість енергії було звільнено, коли атоми зробили хімічний зв'язок в першу чергу. Термін енергія дисоціації зв'язків зазвичай використовується для опису сили взаємодій між атомами, що утворюють ковалентні зв'язки. Зв'язок C—C має приблизну енергію зв'язку 80 ккал/моль, тоді як C = C має енергію зв'язку близько 145 ккал/моль. Зв'язок C = C міцніший за C-C (як обговорюється стосовно довжини зв'язку в розділі 4.4). Для атомів в іонних сполуках, притягнутих протилежними зарядами, використовується термін енергія решітки. Поки ми розберемося з ковалентними зв'язками в молекулах.
Хоча кожна молекула має свою характерну енергію дисоціації зв'язків, можливі деякі узагальнення. Наприклад, хоча точне значення енергії зв'язку C—H залежить від конкретної молекули, всі зв'язки C - H мають енергію зв'язку приблизно однакового значення, оскільки всі вони є зв'язками C - H. Потрібно приблизно 100 ккал енергії, щоб розірвати 1 моль зв'язків C - H, тому ми говоримо про енергію дисоціації зв'язку C—H як близько 100 ккал/моль. У таблиці7.2.1 наведено приблизні енергії дисоціації зв'язків різних ковалентних зв'язків.
| Бонд | Енергія дисоціації облігацій (ккал/моль) |
|---|---|
| С—Ч | 100 |
| С—О | 86 |
| С=О | 190 |
| С—Н | 70 |
| C—C | 85 |
| С = С | 145 |
| C≡ C | 200 |
| Н—Ч | 93 |
| Ч—Ч | 105 |
| Br-Br | 46 |
| Cl—Cl | 58 |
| О—Ч | 110 |
| О = О | 119 |
| Н—Бр | 87 |
| H — Cl | 103 |
Коли відбувається хімічна реакція, атоми в реагентах переставляють свої хімічні зв'язки для отримання продуктів. Нове розташування зв'язків не має такої ж загальної енергії, як зв'язки в реагентах. Тому при виникненні хімічних реакцій завжди буде відбуватися супутня зміна енергії. Зміна енергії, для даної реакції, може бути розрахована за допомогою енергетичних значень дисоціації зв'язку з табл7.2.1.
Зміна ентальпії або теплота реакції, Δ H
Під час хімічної реакції розриваються зв'язки і утворюються нові зв'язки. Розрив хімічних зв'язків є ендотермічним, процесом, який вимагає введення енергії або поглинання тепла. Зворотний процес розриву зв'язків - це утворення зв'язку, яке є екзотермічним, тобто він виділяє енергію або віддає тепло. Значення енергії дисоціації зв'язків, перераховані в наведеній вище таблиці, дають кількість енергії, необхідної для розриву конкретного зв'язку. Коли той самий зв'язок реформується, виділяється однакова кількість енергії. Чисельне значення енергії однакове для розриву і формування зв'язку, але знак, або напрямок процесу різний. Загальна зміна енергії розриву та реформування конкретного зв'язку була б нульовою, іншими словами, енергія не створюється і не руйнується, дотримуючись закону збереження енергії.
У хімічній реакції розриви зв'язків часто відрізняються від реформування зв'язків, іноді відбувається більше поглинається тепла (розривається більше зв'язків), а іноді виділяється більше тепла (утворюється більше зв'язків). Виміряна різниця між загальним теплом, що поглинається, і загальним теплом, що виділяється під час хімічної реакції (виконуваної при постійному тиску), називається теплотою реакції або зміною ентальпії, і представлена символом Δ H (де Δ розшифровується як зміна, а H представляє ентальпію).
enthalpy change≈Σ (bond dissociation energiesreactants)−Σ (bond dissociation energiesproducts)
Знак ≈ використовується тому, що ми складаємо разом середні енергії дисоціації зв'язку; отже, такий підхід не дає точних значень для зміни ентальпії, Δ H.
Розглянемо реакцію 2 моль газоподібного водню (Н 2) з 1 моль газу кисню (О 2) для отримання 2 моль води:
2H2(g)+O2(g)→2H2O(g)

Н—Н = 105 ккал/моль О = 119 ккал/моль О-Н = 110 ккал/моль
У цій реакції розриваються зв'язки 2 H—H та зв'язки 1 O = O зі сторони реагенту, тоді як 4 O—H зв'язки (по дві для кожного H 2 O) утворюються на стороні продукту. Енергетичні зміни можна скласти в таблицю і обчислити наступним чином:
| Енергія дисоціації облігацій реагентів (ккал/моль) | Енергія дисоціації облігацій продукту (ккал/моль) | ||
| 2 ГОД-ГОД | 2 моль х 105 ккал/моль = 210 ккал | 4 О—ГОД | 4 моль х 110 ккал/моль = 440 ккал |
| 1 О=О | 1 моль х 119 ккал/моль = 119 ккал | ||
| Всього = 329 ккал | Всього = 440 ккал | ||
ΔH≈Σ (bond dissociation energiesreactants)−Σ (bond dissociation energiesproducts)
ΔH≈329kcal−440kcal
ΔH≈−111kcal
Зміна ентальпії (ΔH) реакції становить приблизно −111 ккал/моль. Це означає, що зв'язки в продуктах (440 ккал) міцніше зв'язків в реагентах (329 ккал) приблизно на 111 ккал/моль. Оскільки зв'язки в продуктах міцніші, ніж у реагентах, реакція виділяє більше енергії, ніж поглинає. Ця надлишкова енергія виділяється у вигляді тепла, тому реакція екзотермічна. Значить, ми можемо переписати реакцію з виділеним теплом (111 ккал) на стороні продукту рівняння наступним чином:
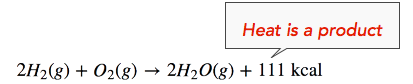
Ми також можемо переписати рівняння реакції з інформацією ΔH (див. Нижче). Відзначимо, що екзотермічна реакція має негативне значення ΔH.
2H2(g)+O2(g)→2H2O(g) ΔH=−111kcal
Що таке зміна ентальпії для цієї реакції? Реакція екзотермічна або ендотермічна?
H2(g)+Br2(g)→2HBr(g)
Рішення
Крок 1- Спочатку подивіться на рівняння та визначте, які зв'язки існують у реагентах (зв'язки розірвані).
- один H-H зв'язок і
- одна облігація Br-Br
Крок 2- Зробіть те ж саме для продуктів (утворених облігацій)
- дві облігації H-Br
Крок 3- Визначте енергії дисоціації зв'язків цих зв'язків з таблиці7.2.1:
- H-H облігації: 105 ккал/моль
- Облігації Br-Br: 46 ккал/моль
Крок 4- Налаштуйте таблицю (див. Нижче) та застосуйте формулу для зміни ентальпії.
| Енергія дисоціації облігацій реагентів (ккал/моль) | Енергія дисоціації облігацій продукту (ккал/моль) | ||
| 1 ГОД-ГОД | 1 моль х 105 ккал/моль = 105 ккал | 2 Н— Бар | 2 моль х 87 ккал/моль = 174 ккал |
| 1 Бр — Бр | 1 моль х 46 ккал/моль = 46 ккал | ||
| Всього = 151 ккал | Всього = 174 ккал | ||
|
ΔH≈151kcal−174kcal ΔH≈−23kcal |
|||
Крок 5- Оскільки Δ H негативний (−23 ккал), реакція екзотермічна.
Вправа7.2.1
Використовуючи енергії дисоціації зв'язків, наведені на графіку вище, знайдіть зміну ентальпії для термічного розкладання води:
H2(g)+Cl2(g)→2HCl(g)
Реакція написана вище екзотермічна або ендотермічна? Поясніть.
- Відповідь
-
Δ Н = −43 ккал
Оскільки Δ H негативний (−43 ккал), реакція екзотермічна.