6.3: Відносини кротів та хімічні рівняння
- Використовувати збалансовану хімічну реакцію для визначення молярних взаємозв'язків між речовинами.
Раніше ви навчилися збалансувати хімічні рівняння, порівнюючи числа кожного типу атома в реагентах і продуктах. Коефіцієнти перед хімічними формулами представляють числа молекул або формульних одиниць (в залежності від типу речовини). Тут ми розширимо значення коефіцієнтів в хімічному рівнянні.
Розглянемо просте хімічне рівняння
2H2+O2→2H2O
Угода для написання збалансованих хімічних рівнянь полягає у використанні найнижчого співвідношення цілих чисел для коефіцієнтів. Однак рівняння збалансоване до тих пір, поки коефіцієнти знаходяться в співвідношенні 2:1: 2. Наприклад, це рівняння також збалансовано, якщо ми запишемо його як
4H2+2O2→4H2O
Співвідношення коефіцієнтів дорівнює 4:2:4, яке зменшується до 2:1:2. Рівняння також збалансоване, якщо ми повинні були записати його як
22H2+11O2→22H2O
тому що 22:11:22 також зменшується до 2:1: 2.
Припустимо, ми хочемо використовувати більші числа. Розглянемо наступні коефіцієнти:
12.044×1023H2+6.022×1023O2→12.044×1023H2O
Ці коефіцієнти також мають співвідношення 2:1: 2 (перевірте його і дивіться), тому це рівняння збалансовано. Але 6.022 × 10 23 - 1 моль, тоді як 12.044 × 10 23 - 2 моль (і число написано таким чином, щоб зробити це більш очевидним), тому ми можемо спростити цю версію рівняння, написавши його як
2molH2+1molO2→2molH2O
Ми можемо залишити слово моль і не писати коефіцієнт 1 (як це наша звичка), тому остаточна форма рівняння, все ще збалансована, є
2H2+O2→2H2O
Тепер ми інтерпретуємо коефіцієнти як посилання на молярні суми, а не окремі молекули. Урок? Збалансовані хімічні рівняння збалансовані не тільки на молекулярному рівні, а й за молярними кількостями реагентів і продуктів. Таким чином, ми можемо прочитати цю реакцію як «два молі водню реагують з одним молем кисню, утворюючи два молі води».
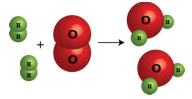
2 молекули Н 2 1 молекула O 2 2 молекули H 2 O
2 родимки Н 2 1 моль О 2 2 молі Н 2 О
2 х 2,02 г = 4,04 г Н 2 32,0 г О 2 х 18,02 г = 36,04 г Н 2 О
Малюнок6.3.1: Це подання виробництва води з кисню і водню показує кілька способів інтерпретації кількісної інформації про хімічну реакцію.
Таким же чином, співвідношення, які ми побудували для опису реакції молекул, також можуть бути побудовані з точки зору молів, а не молекул. Для реакції, в якій водень і кисень об'єднуються, щоб зробити воду, наприклад, ми можемо побудувати наступні співвідношення:
2molH21molO2or1molO22molH2
2molH2O1molO2or1molO22molH2O
2molH22molH2Oor2molH2O2molH2
Ми можемо використовувати ці співвідношення, щоб визначити, яка кількість речовини, в молі, буде реагувати з або виробляти задану кількість молів іншої речовини. Вивчення числових взаємозв'язків між реагентами і продуктами в збалансованих хімічних реакціях називається стехіометрією. Співвідношення коефіцієнтів в збалансованому хімічному рівнянні, що використовується при розрахунках, що стосуються кількості реагентів і продуктів, називається стехіометричним коефіцієнтом.
Скільки молів кисню реагують з воднем з отриманням 27,6 моль Н 2 О? Збалансоване рівняння виглядає наступним чином:
2H2+O2⟶2H2O
Рішення
Оскільки ми маємо справу з кількостями H 2 O та O 2, ми будемо використовувати стехіометричне співвідношення, яке пов'язує ці дві речовини. Оскільки нам дано кількість Н 2 О і хочемо визначити кількість O 2, ми будемо використовувати співвідношення, яке має H 2 O в знаменнику (так воно скасовує) і O 2 в чисельнику (так воно вводиться у відповідь). Таким чином,
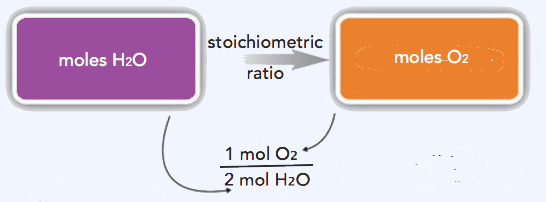
27.6molH2O×1molO22molH2O=13.8molO2
На отримання 27,6 моль Н 2 О реагують 13,8 моль О 2.
Використовуючи 2H 2 + O 2 → 2H 2 O, скільки молів водню реагують з 3,07 моль кисню для отримання Н 2 О?
- Відповідь
-
3.07molO2×2molH21molO2=6.14molH2
Ключ на винос
- Збалансована хімічна реакція може бути використана для визначення молярних взаємозв'язків між речовинами.