4.9: Полярні ковалентні зв'язки та електронегативність
- Page ID
- 21473
Цілі навчання
- Опишіть електронегативність і полярність.
- Використовуйте значення електронегативності для прогнозування полярності зв'язку.
Наші обговорення зв'язків до цих пір зосереджувалися на двох типах, іонних і ковалентних. В іонних зв'язках\(NaCl\), як, переносяться електрони; 3s електрон позбавлений від атома Na і включений в електронну структуру атома Cl, а з'єднання найбільш точно описується як складається з окремих\(Na^+\) і\(Cl^-\) іонів. У ковалентному зв'язку непарні електрони від окремих атомів діляться для того, щоб заповнити валентну оболонку кожного атома. Коли між однотипними атомами утворюється ковалентний зв'язок, наприклад\(Cl_2\), електрони поділяються порівну між ними. Однак, коли між різними типами атомів утворюється ковалентний зв'язок, електрони не обов'язково діляться однаково. У цих сполуках їх зв'язок характер падає між двома крайнощами: перенесеними і розділеними порівну.
Полярність облігацій
Як показано нижче, полярність зв'язку є корисною концепцією для опису спільного використання електронів між атомами в межах ковалентного зв'язку:
- Неполярний ковалентний зв'язок (рис.\(\PageIndex{1a}\)) - це та, в якій електрони поділяються порівну між двома атомами.
- Полярний ковалентний зв'язок (рис.\(\PageIndex{1b}\)) - це та, в якій один атом має більшу привабливість для електронів, ніж інший атом.
- Якщо відносне тяжіння атома для електронів досить велике, то зв'язок - це іонний зв'язок (рис.\(\PageIndex{1c}\)).
Електронна щільність в полярному зв'язку розподілена нерівномірно і більша навколо атома, який притягує електрони більше, ніж інший. Наприклад, електрони в зв'язку H—Cl молекули хлористого водню проводять більше часу поблизу атома хлору, ніж біля атома водню. Зверніть увагу, що затінена область навколо Cl на малюнку\(\PageIndex{1b}\) набагато більша, ніж навколо H. Цей дисбаланс електронної густини призводить до накопичення часткового негативного заряду (позначеного як Δ−) на одній стороні зв'язку (Cl) та часткового позитивного заряду (позначеного Δ+) з іншого сторона зв'язку (Н).
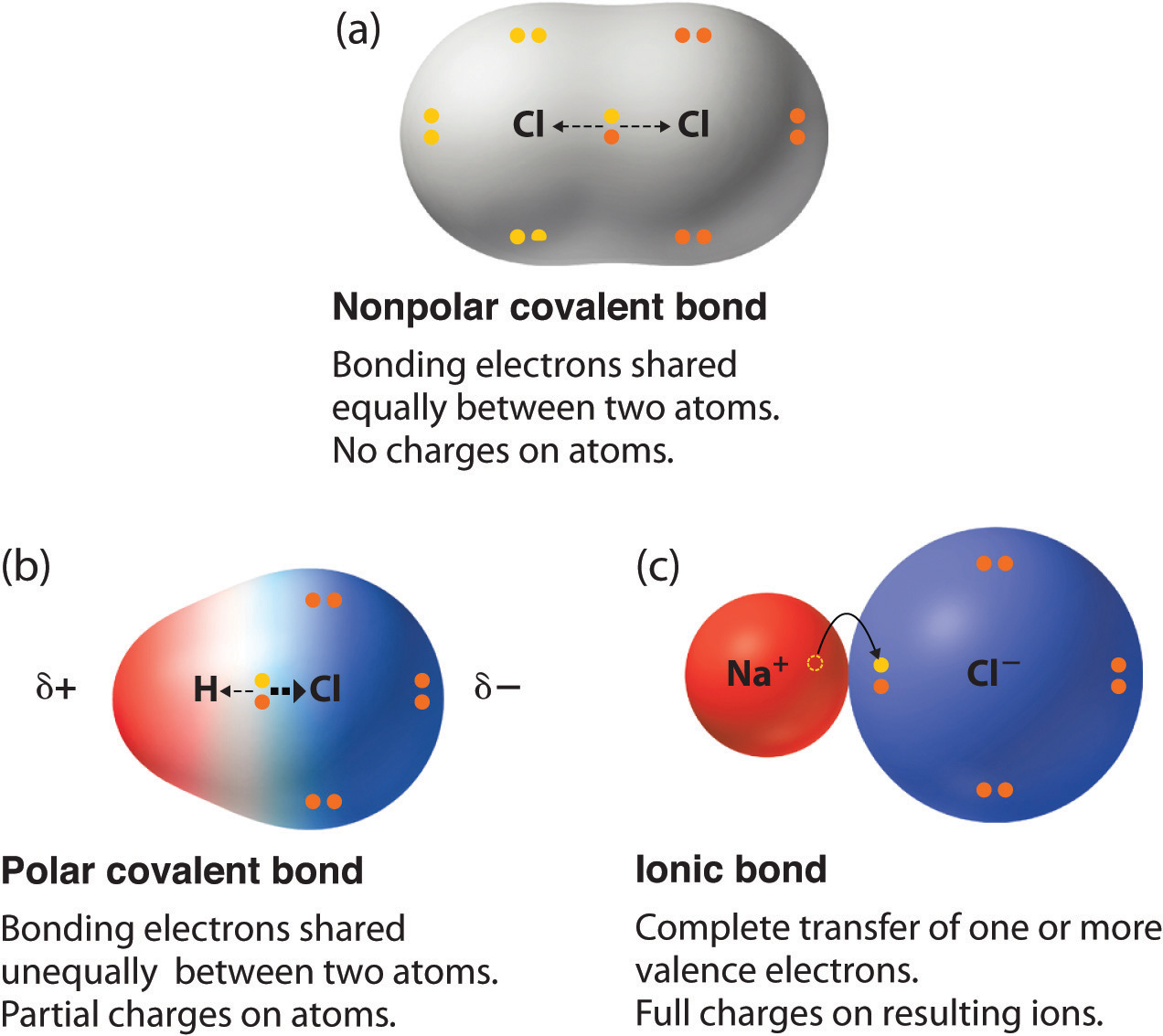
Рисунок\(\PageIndex{1}\): Розподіл електронів у неполярному ковалентному зв'язку, полярному ковалентному зв'язку та іонному зв'язку з використанням електронних структур Льюїса. У чисто ковалентному зв'язку (а) зв'язкові електрони поділяються порівну між атомами. У чисто іонному зв'язку (c) електрон був повністю перенесений від одного атома до іншого. Полярний ковалентний зв'язок (b) є проміжним між двома крайностями: зв'язкові електрони діляться неоднаково між двома атомами, а розподіл електронів асиметричний з тим, що електронна щільність більша навколо більш електронегативного атома. Багаті електронами (негативно заряджені) області показані синім кольором; електронно-бідні (позитивно заряджені) області показані червоним кольором.
Будь-яка ковалентна зв'язок між атомами різних елементів є полярним зв'язком, але ступінь полярності коливається в широких межах. Деякі зв'язки між різними елементами лише мінімально полярні, а інші сильно полярні. Іонні зв'язки можна вважати кінцевою за полярністю, причому електрони передаються, а не діляться. Щоб судити про відносну полярність ковалентного зв'язку, хіміки використовують електронегативність, яка є відносною мірою того, наскільки сильно атом притягує електрони при утворенні ковалентного зв'язку.
Електронегативність
Оскільки тенденція елемента до отримання або втрати електронів настільки важлива при визначенні його хімії, для кількісного опису цієї тенденції були розроблені різні методи. Найважливіший метод використовує вимірювання, зване електронегативністю, яке визначається як відносна здатність атома притягувати електрони до себе в хімічній сполуці. Елементи з високою електронегативністю мають тенденцію набувати електрони в хімічних реакціях і знаходяться в правому верхньому куті таблиці Менделєєва. Елементи з низькою електронегативністю мають тенденцію втрачати електрони в хімічних реакціях і знаходяться в лівому нижньому кутку таблиці Менделєєва.
На відміну від енергії іонізації або спорідненості електронів, електронегативність атома не є простим, фіксованим властивістю, яке можна безпосередньо виміряти в одному експерименті. Насправді електронегативність атома повинна певною мірою залежати від його хімічного середовища, оскільки на властивості атома впливають його сусіди в хімічній сполуці. Проте, коли порівнюються різні методи вимірювання електронегативності атома, всі вони мають тенденцію привласнювати аналогічні відносні значення даному елементу. Наприклад, всі шкали пророкують, що фтор має найвищу електронегативність, а цезій - найнижчим зі стійких елементів, що говорить про те, що всі методи вимірюють одне і те ж фундаментальне властивість.
Електронегативність - це функція:
- енергія іонізації атома (наскільки сильно атом тримається за власні електрони) і
- спорідненість атома до електронів (наскільки сильно атом притягує інші електрони).
Обидва ці властивості ізольованого атома. Елемент буде дуже електронегативним, якщо він має велику (негативну) спорідненість до електронів і високу енергію іонізації (завжди позитивну для нейтральних атомів). Таким чином, він буде притягувати електрони від інших атомів і протистояти тому, щоб власні електрони притягувалися.
Електронегативність визначається як здатність атома в конкретній молекулі притягувати електрони до себе. Чим більше значення, тим більша привабливість для електронів.
Шкала електронегативності Паулінга
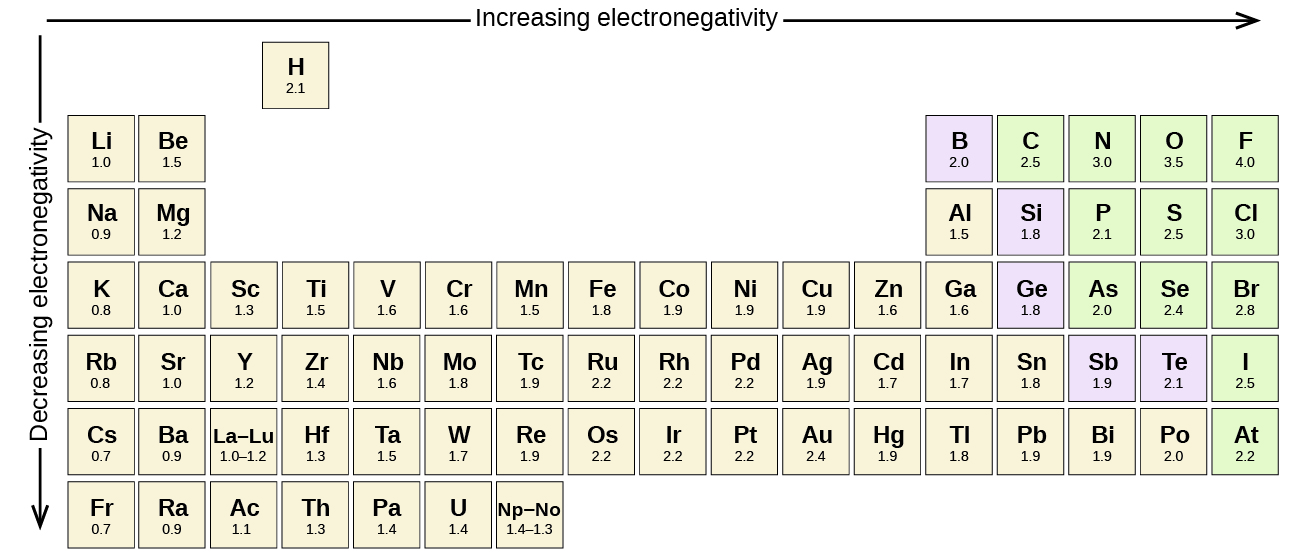
Оригінальна шкала електронегативності, розроблена в 1930-х роках Лінусом Полінгом (1901— 1994), була заснована на вимірах міцності ковалентних зв'язків між різними елементами. Паулінг довільно встановив електронегативність фтору на рівні 4,0 (хоча сьогодні вона була доопрацьована до 3,98), тим самим створивши шкалу, в якій всі елементи мають значення від 0 до 4,0.
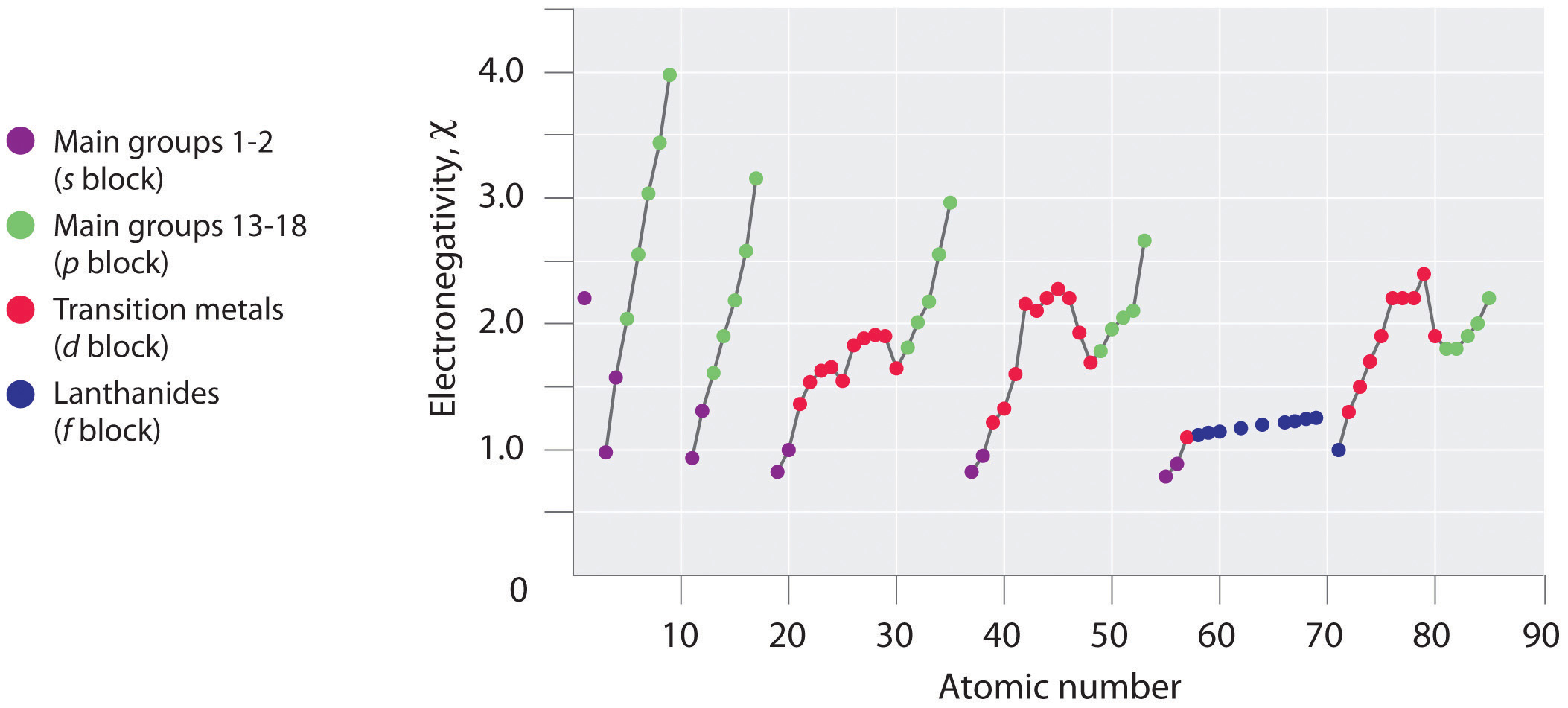
Періодичні варіації (тенденції) значень електронегативності Паулінга проілюстровані на рисунках\(\PageIndex{2}\) і\(\PageIndex{3}\). Якщо ігнорувати інертні гази та елементи, для яких не відомі стабільні ізотопи, ми бачимо, що фтор є найбільш електронегативним елементом, а цезій - найменш електронегативним нерадіоактивним елементом. Оскільки електронегативність, як правило, збільшується по діагоналі від нижнього лівого до верхнього правого кута періодичної таблиці, елементи, що лежать на діагональних лініях, що проходять від верхнього лівого до нижнього правого, мають порівнянні значення (наприклад, O і Cl, і N, S і Br).
Про полярність ковалентного зв'язку можна судити, визначаючи різницю в електронегативності двох атомів, що складають зв'язок. Чим більша різниця в електронегативності, тим більше дисбаланс обміну електронами в зв'язку. Хоча жорстких і швидких правил немає, загальне правило, (див. Рис.\(\PageIndex{5}\)), Якщо різниця в електронегативності менше приблизно 0,4, зв'язок вважається неполярною; якщо різниця більше 0,4, зв'язок вважається полярною. Якщо різниця в електронегативності досить велика (як правило, більше приблизно 1,8), отримане з'єднання вважається іонним, а не ковалентним. Різниця електронегативності в нуль, звичайно, вказує на неполярний ковалентний зв'язок.

Приклад\(\PageIndex{1}\)
Опишіть різницю електронегативності між кожною парою атомів і отриману полярність (або тип зв'язку).
- С і Н
- Н і Н
- Na і Cl
- О і Н
Рішення
- Вуглець має електронегативність 2,5, тоді як значення для водню дорівнює 2,1. Різниця становить 0,4, що досить мало. Тому зв'язок C—H вважається неполярною.
- Обидва атоми водню мають однакове значення електронегативності - 2,1. Різниця дорівнює нулю, тому зв'язок неполярний.
- Електронегативність натрію становить 0,9, тоді як хлору - 3,0. Різниця становить 2,1, що досить велике, і тому натрій і хлор утворюють іонну сполуку.
- При 2,1 для водню і 3,5 для кисню різниця електронегативності становить 1,4. Ми очікували б дуже полярного зв'язку. Поділ електронів між O і H нерівномірно з електронами, сильніше намальованими до О.
Вправа\(\PageIndex{1}\)
Опишіть різницю електронегативності (EN) між кожною парою атомів і отриману полярність (або тип зв'язку).
- С і О
- К і Бр
- N і N
- Cs і F
- Відповідь a:
-
Різниця EN становить 1,0, отже, полярний. Поділ електронів між C і O нерівномірний з електронами, сильніше намальованими до О.
- Відповідь б:
-
Різниця EN більше 1,8, отже, іонна.
- Відповідь c:
-
Ідентичні атоми мають нульову різницю EN, отже, неполярні.
- Відповідь d:
-
Різниця EN більше 1,8, отже, іонна.
Придивившись ближче: Лінус Полінг
Мабуть, найвпливовіший хімік 20 століття, Лінус Полінг (1901—94) - єдина людина, яка виграла дві індивідуальні (тобто неспільні) Нобелівські премії. У 1930-х роках Паулінг використовував нові математичні теорії, щоб проголосити деякі основні принципи хімічного зв'язку. Його книга 1939 року «Природа хімічного зв'язку» є однією з найбільш значущих книг, коли-небудь опублікованих в хімії.
До 1935 року інтерес Паулінга перейшов до біологічних молекул, і він був удостоєний Нобелівської премії з хімії 1954 року за роботу над білковою структурою. (Він був дуже близький до відкриття структури подвійної спіралі ДНК, коли Джеймс Уотсон і Джеймс Крик оголосили про власне відкриття її структури в 1953 році.) Пізніше він був удостоєний Нобелівської премії миру 1962 року за зусилля щодо заборони випробувань ядерної зброї.

Лінус Полінг був одним з найвпливовіших хіміків 20 століття.
У свої більш пізні роки Полінг переконався, що великі дози вітаміну С дозволять запобігти захворюванню, в тому числі і застуду. Більшість клінічних досліджень не змогли показати зв'язок, але Полінг продовжував приймати великі дози щодня. Він помер у 1994 році, провівши все життя, встановивши наукову спадщину, яку мало хто коли-небудь зрівняється.