4.10: Полярні молекули
- Page ID
- 21519
Цілі навчання
- Розпізнайте характеристики зв'язку ковалентних сполук: довжину зв'язку та полярність зв'язку.
- Використовуйте значення електронегативності для прогнозування полярності зв'язку.
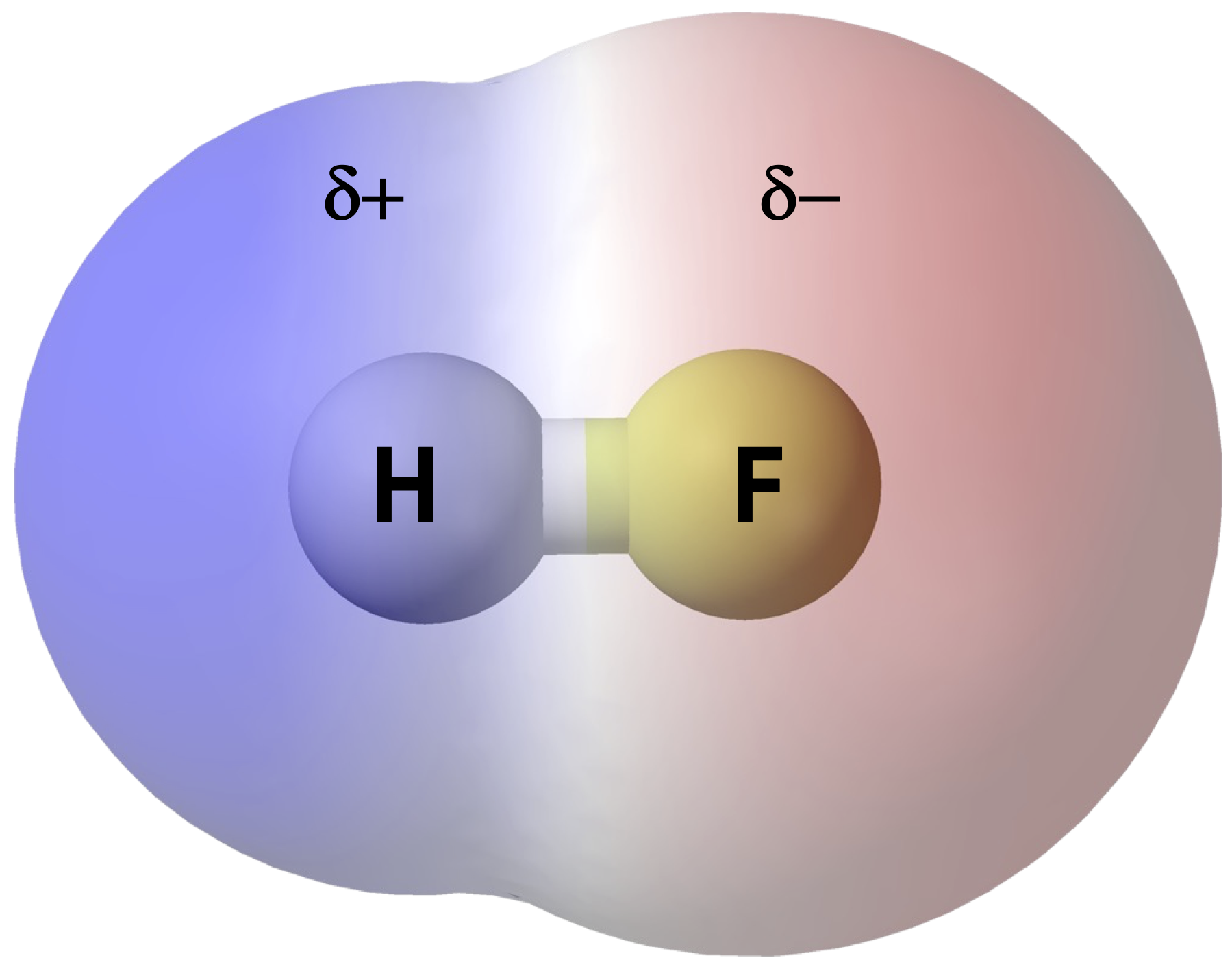
Якщо в молекулі є тільки один зв'язок, полярність зв'язку визначає молекулярну полярність. Будь-яка двоатомна молекула, в якій два атоми є одним елементом, повинна бути неполярною молекулою. Двоатомна молекула, яка складається з полярного ковалентного зв'язку, такого як HF, - це полярна молекула, де один кінець молекули трохи позитивний, а інший - трохи негативний. Дві електрично заряджені області на обох кінцях молекули називаються полюсами, подібними до магніту, що має північний і південний полюси. Значить, молекула з двома полюсами має дипольний момент.
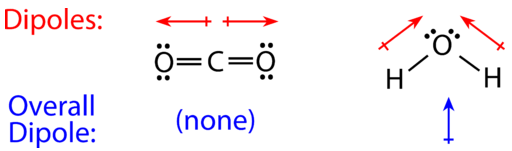
Для молекул, що мають більше двох атомів, молекулярна геометрія також повинна враховуватися при визначенні, чи є молекула полярною або неполярною. На малюнку нижче показано порівняння між вуглекислим газом і водою.
Вуглекислий газ\(\left( \ce{CO_2} \right)\) - це лінійна молекула з вуглецем в центрі і двома киснями на кінцевих кінцях. Атоми кисню більш електронегативні, ніж атом вуглецю, тому є два окремих диполя, що спрямовані назовні від\(\ce{C}\) атома до кожного\(\ce{O}\) атома. Однак, оскільки диполі однакової сили і спрямовані в протилежні сторони, вони скасовують, а загальна молекулярна полярність\(\ce{CO_2}\) дорівнює нулю (немає чистого диполя), тому\(\ce{CO_2}\) є неполярною молекулою.
Вода має зігнуту молекулярну структуру, оскільки вона має чотири електронні групи, дві зв'язані групи та дві одинокі електронні групи на центральному атомі кисню. Окремі диполі зв'язку O—H вказують від трохи позитивних\(\ce{H}\) атомів до більш електронегативного\(\ce{O}\) атома. Через зігнуту форму диполі, які рівні за силою, обидва вказують на атом кисню і не скасовують один одного, отже, молекула води полярна. На малюнку нижче ви можете побачити, що кисневий кінець молекули трохи негативний, а воднева сторона трохи позитивна, відбувається поділ заряду по всій молекулі, чистий диполь (показаний синім кольором), який вказує вгору.
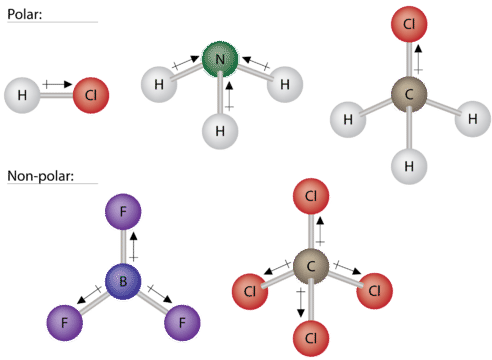
Деякі інші молекули показані на малюнку нижче. Зверніть увагу, що чотиригранна молекула,\(\ce{CH_4}\) така як неполярна. Однак якщо один з периферійних\(\ce{H}\) атомів замінити іншим атомом, який має різну електронегативність, молекула стає полярною. Тригональна планарна молекула\(\left( \ce{BF_3} \right)\) може бути неполярною, якщо всі три периферичних атома однакові, але тригональна пірамідна молекула\(\left( \ce{NH_3} \right)\) полярна.
Підсумовуючи, щоб бути полярною, молекула повинна:
- Містять щонайменше одну полярну ковалентну зв'язок.
- Мають молекулярну структуру таку, що сума векторів кожного дипольного моменту зв'язку не скасовується.
- Намалюйте структуру Льюїса.
- З'ясуйте геометрію (використовуючи теорію VSEPR).
- Візуалізуйте або намалюйте геометрію.
- Знайдіть чистий дипольний момент (вам не потрібно насправді робити розрахунки, якщо ви можете його візуалізувати).
- Якщо чистий дипольний момент дорівнює нулю, він неполярний. В іншому випадку вона полярна.
Властивості полярних молекул
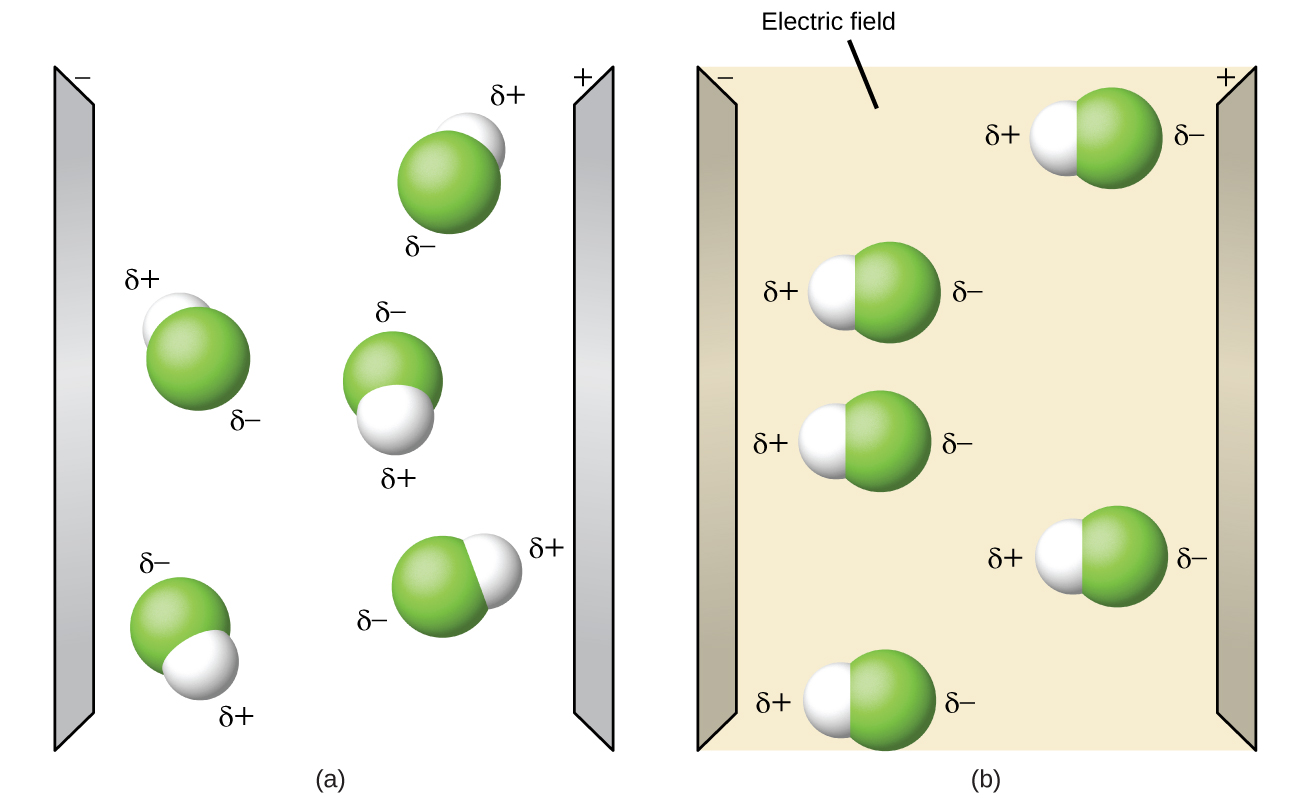
Полярні молекули мають тенденцію вирівнюватися при розміщенні в електричному полі з позитивним кінцем молекули, орієнтованим на негативну пластину, і негативним кінцем до позитивної пластини (рис.\(\PageIndex{4}\)). Ми можемо використовувати електрично заряджений об'єкт для залучення полярних молекул, але неполярні молекули не притягуються. Також полярні розчинники краще розчиняють полярні речовини, а неполярні розчинники краще розчиняють неполярні речовини.
Хоча молекули можна охарактеризувати як «полярний ковалентний» або «іонний», слід зазначити, що це часто відносний термін, причому одна молекула просто є більш полярною або менш полярною, ніж інша. Однак для таких молекул характерні такі властивості. Полярні молекули мають тенденцію до:
- мають більш високі температури плавлення, ніж неполярні молекули
- мають більш високі температури кипіння, ніж неполярні молекули
- бути більш розчинними у воді (краще розчиняються), ніж неполярні молекули
- мають менший тиск пари, ніж неполярні молекули
Наступне моделювання дуже корисно для вивчення більше про зв'язок та молекулярну полярність. Досліджуйте самостійно або скористайтеся вправою та прикладами нижче.
Відкрийте моделювання полярності молекул (вище) і виберіть вкладку «Три атоми» вгорі. Це повинно відображати молекулу ABC з трьома регуляторами електронегативності. Ви можете відобразити або приховати моменти зв'язку, молекулярні диполі та часткові заряди праворуч. Увімкнення електричного поля покаже, чи рухається молекула під впливом поля.
Використовуйте елементи управління електронегативністю, щоб визначити, як молекулярний диполь буде шукати вихідну зігнуту молекулу, якщо:
- А і С дуже електронегативні, а B знаходиться в середині діапазону.
- А дуже електронегативний, а В і С - ні.
Рішення
- Молекулярний дипольний момент вказує відразу між А і С.
- Молекулярний дипольний момент вказує уздовж зв'язку A—B, до А.
Визначте часткові заряди, які дадуть максимально великі диполя зв'язку.
- Відповідь
-
Найбільші моменти облігацій будуть відбуватися з найбільшими частковими зарядами. Два вищевказані рішення представляють, наскільки нерівномірно розподіляються електрони в зв'язку. Моменти зв'язку будуть максимізовані, коли різниця електронегативності найбільша. Елементи управління для A і C повинні бути встановлені на одну крайність, а B - протилежну крайність. Хоча величина моменту зв'язку не зміниться залежно від того, чи є B найбільш електронегативним чи найменшим, напрямок моменту зв'язку буде.