4.8: Форми молекул
Цілі навчання
- Прогнозувати структури малих молекул за допомогою теорії відштовхування електронної пари валентної оболонки (VSEPR).
Електронно-парний підхід Льюїса може бути використаний для прогнозування кількості та типів зв'язків між атомами в речовині, і він вказує, які атоми мають самотні пари електронів. Цей підхід не дає жодної інформації про фактичне розташування атомів у просторі, однак. Продовжуємо обговорення структури та зв'язку шляхом введення моделі відштовхування електронної пари валентної оболонки (VSEPR) (вимовляється «веспер»), яка може бути використана для прогнозування форм багатьох молекул і багатоатомних іонів. Майте на увазі, однак, що модель VSEPR, як і будь-яка модель, є обмеженим відображенням реальності; модель не надає інформації про довжину зв'язків або наявність декількох зв'язків.
Модель ВСПР
Модель VSEPR може передбачити структуру майже будь-якої молекули або багатоатомного іона, в якій центральний атом є неметалом, а також структури багатьох молекул і багатоатомних іонів з центральним атомом металу. Передумова теорії VSEPR полягає в тому, що електронні пари, розташовані в зв'язках і одиноких парах, відштовхуються один від одного і тому приймуть геометрію, яка розміщує електронні пари якомога далі один від одного. Ця теорія дуже спрощена і не враховує тонкощів орбітальних взаємодій, що впливають на молекулярні форми; однак проста процедура підрахунку VSEPR точно прогнозує тривимірні структури великої кількості сполук, які неможливо передбачити за допомогою електрон-пари Льюїса підхід.
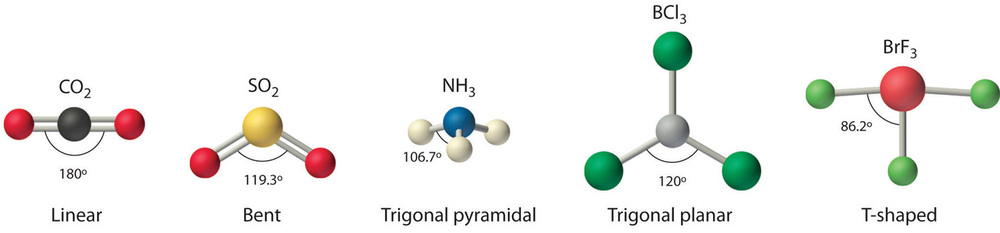
Ми можемо використовувати модель VSEPR для прогнозування геометрії більшості багатоатомних молекул та іонів, фокусуючись лише на кількості електронних пар навколо центрального атома, ігноруючи всі інші валентні електрони. Згідно з цією моделлю валентні електрони в структурі Льюїса утворюють електронні групи (області електронної щільності), які можуть складатися з одиночного зв'язку, подвійного зв'язку, потрійної зв'язку, одиночної пари електронів або навіть одного непарного електрона, який в моделі VSEPR зараховується як одиночна пара. Оскільки електрони відштовхуються один від одного електростатично, найбільш стійке розташування електронних груп (тобто тієї, що має найменшу енергію) - це те, що мінімізує відбиття. Групи розташовуються навколо центрального атома таким чином, що виробляє молекулярну структуру з найменшою енергією, як показано на малюнку4.8.1.
Важливо зазначити, що геометрія електронної групи навколо центрального атома - це не те саме, що його молекулярна структура. Геометрії електронної групи описують усі області, де розташовані електрони, зв'язки, а також одинокі пари. Молекулярна структура описує розташування атомів поодинці, не включаючи одиничні пари електронів.
Ми розмежовуємо ці дві ситуації, називаючи геометрію, яка включає всі електронні пари геометрію електронної групи. Структура, яка включає в себе лише розміщення атомів в молекулі, називається молекулярною структурою (або молекулярною формою). Геометрія електронної групи буде такою ж, як і молекулярні структури, коли навколо центрального атома немає одиноких електронних пар, але вони будуть різними, коли на центральному атомі присутні самотні пари.
Наступна процедура використовує теорію VSEPR для визначення геометрії електронної групи та молекулярних структур (молекулярної форми):
- Намалюйте структуру Льюїса молекули або багатоатомного іона.
- Підрахуйте кількість електронних груп або областей електронної щільності (одиноких пар і зв'язків) навколо центрального атома. Одинарна, подвійна або потрійна зв'язок вважається однією групою електронів.
- Визначте геометрію електронної групи, розмістивши групи якомога далі один від одного.
- Визначте молекулярну структуру (дивлячись тільки на зв'язані групи).
Таблиця4.8.1 узагальнює форми молекул на основі кількості електронних груп і оточуючих атомів.
| Кількість електронних груп на центральному атомі | Кількість груп склеювання | Кількість самотніх пар | Геометрія електронної групи | Молекулярна структура |
|---|---|---|---|---|
| 2 | 2 | 0 | лінійний | лінійний |
| 3 | 3 | 0 | тригональний площинний | тригональний площинний |
| 3 | 2 | 1 | тригональний площинний | зігнутий 120° |
| 4 | 4 | 0 | чотиригранний | чотиригранний |
| 4 | 3 | 1 | чотиригранний | трикутна пірамідальна |
| 4 | 2 | 2 | чотиригранний | зігнутий 109° |
Дві групи електронів
Будь-яка молекула, що має лише два атоми, є лінійною. Молекула, центральний атом якої містить лише дві електронні групи, орієнтує ці дві групи якомога далі один від одного, що знаходиться на відстані 180° один від одного. Коли дві електронні групи знаходяться на відстані 180° один від одного, атоми, прикріплені до цих електронних груп, також знаходяться на відстані 180° один від одного, тому загальна молекулярна структура є лінійною. Приклади включають BeH 2 і CO 2:

Три групи електронів
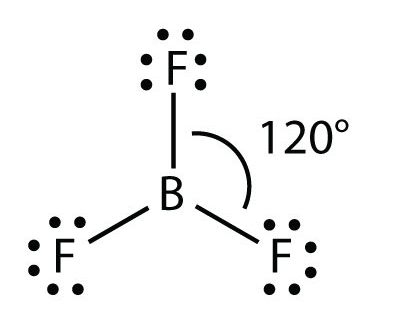
Молекула з трьома електронними групами орієнтує три групи якомога далі один від одного. Вони приймають положення рівностороннього трикутника, 120° один від одного і в площині. Форма таких молекул тригональна плоска. Прикладом може служити БФ 3:
Деякі речовини мають тригональний планарний розподіл електронної групи, але мають атоми, пов'язані лише з двома з трьох електронних груп. Прикладом може служити ФГОС 2:
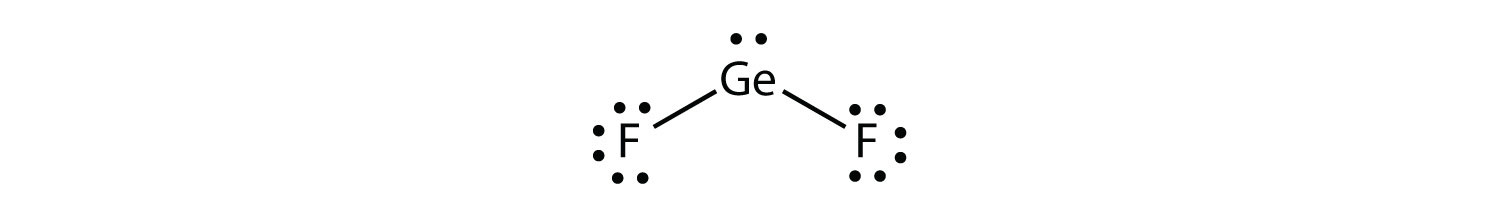
З точки зору геометрії електронної групи GeF 2 має тригональну плоску форму, але її реальна форма продиктована положеннями атомів. Ця молекулярна структура називається зігнутою 120° або кутовою.
Чотири групи електронів
Молекула з чотирма електронними групами навколо центрального атома орієнтує чотири групи у напрямку тетраедра з кутами зв'язку приблизно 109,5°. Якщо до цих електронним групам приєднані чотири атоми, то молекулярна структура теж тетраедрична. Метан (СН 4) - приклад.
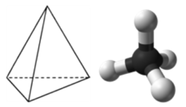
Ця діаграма СН 4 ілюструє стандартну умовність відображення тривимірної молекули на двовимірній поверхні. Прямі лінії знаходяться в площині сторінки, суцільна клинова лінія виходить з площини до читача, а пунктирна клинова лінія виходить з площини далеко від читача.
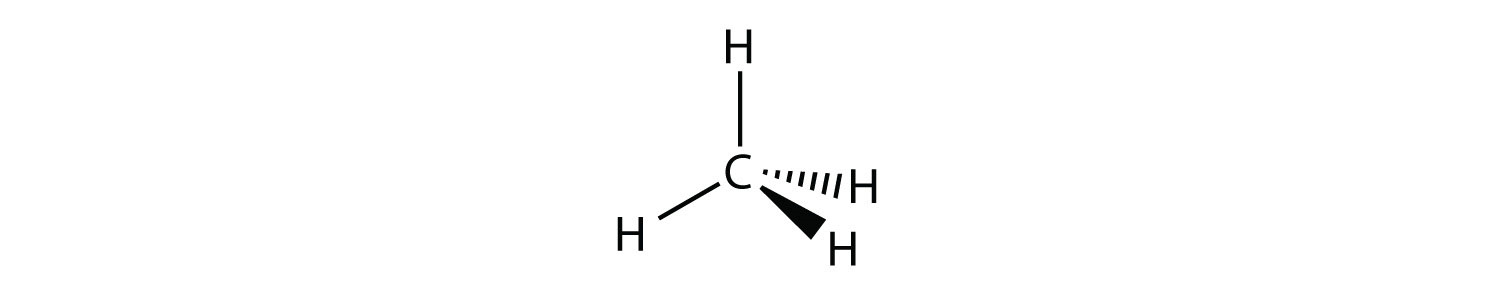
NH 3 є прикладом молекули, центральний атом якої має чотири електронні групи, але тільки три з них пов'язані з оточуючими атомами.
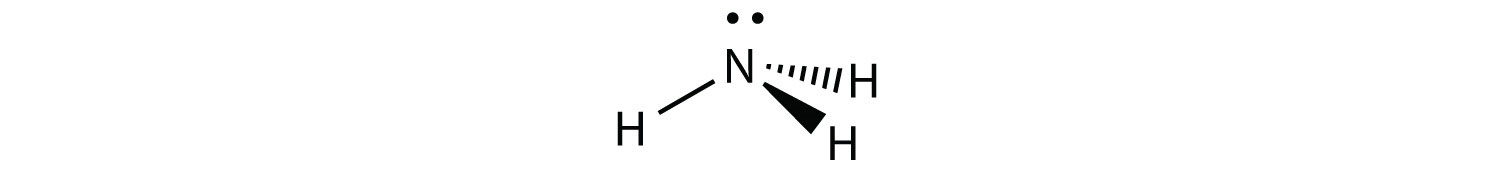
Хоча електронні групи орієнтовані у формі тетраедра, з точки зору молекулярної геометрії форма NH 3 тригональна пірамідальна.
Н 2 О є прикладом молекули, центральний атом якої має чотири групи електронів, але тільки дві з них пов'язані з оточуючими атомами.
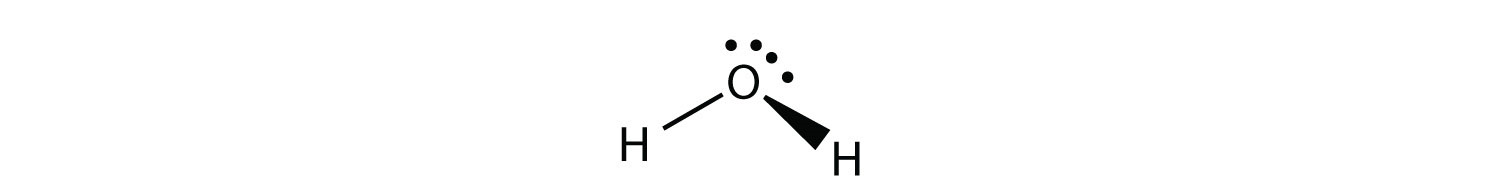
Хоча електронні групи орієнтовані у формі тетраедра, форма молекули вигнута 109° або кутова. Молекула з чотирма електронними групами про центральний атом, але лише одна електронна група, пов'язана з іншим атомом, є лінійною, оскільки в молекулі всього два атоми.
Форми молекул з подвійними або потрійними зв'язками
Подвійні або потрійні зв'язки зараховують як єдину електронну групу. Електронна точкова діаграма Льюїса формальдегіду (CH 2 O) показана на малюнку4.8.9.
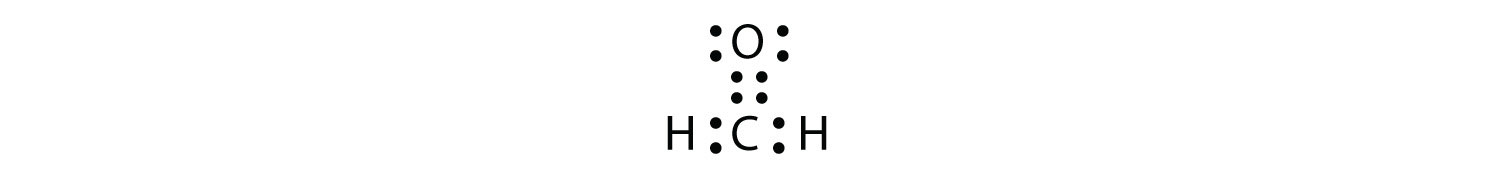
Центральний атом С має три електронні групи навколо нього, оскільки подвійний зв'язок вважається однією групою електронів. Три електронні групи відштовхуються один від одного, щоб прийняти тригональну плоску форму.
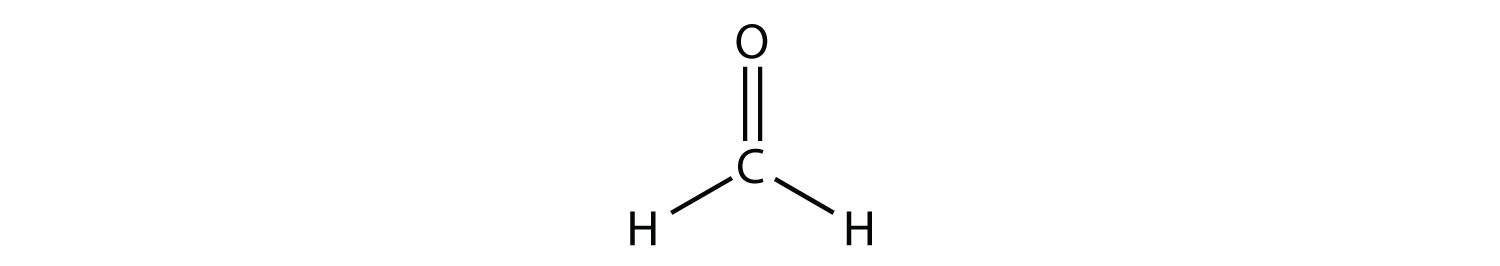
(Одинокі електронні пари на атомі O опущені для наочності.) Молекула не буде ідеальним рівностороннім трикутником, оскільки подвійний зв'язок С—О відрізняється від двох зв'язків С—Н, але як плоска, так і трикутна описують відповідну приблизну форму цієї молекули.
Яка приблизна форма кожної молекули?
- пКл 3
- НЕ
Рішення
Насамперед потрібно намалювати структуру молекули Льюїса.
ДляPCl3, електронна точкова діаграма виглядає наступним чином:
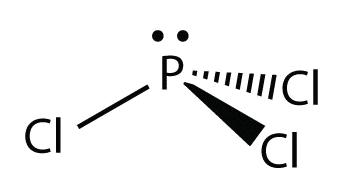
Самотні електронні пари на атомах Cl опущені для наочності. Атом Р має чотири електронні групи, три з яких пов'язані з оточуючими атомами, тому молекулярна форма тригональна пірамідна.
Електронна точковаNOF діаграма для виглядає наступним чином:
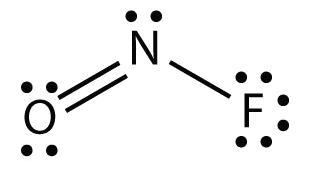
Атом N має на ньому три електронні групи, дві з яких пов'язані з іншими атомами. Молекулярна форма вигнута.
Що таке приблизна молекулярна формаCH2Cl2?
- Відповідь
-
Тетраедричний
Етилен (C2H4) має два центральних атома. Визначте геометрію навколо кожного центрального атома і форму загальної молекули. (Підказка: водень є кінцевим атомом.)
- Відповідь
-
Тригональний площинний близько обох центральних атомів С.
Молекули з декількома центральними атомами
Модель VSEPR може бути використана для прогнозування структури дещо складніших молекул з більш ніж одним центральним атомом за допомогою VSEPR, як описано вище для кожного центрального атома окремо. Ми продемонструємо метилізоціанат (CH 3 —N = C = O), летючою і високотоксичною молекулою, яка використовується для виробництва пестициду Севін.
Почніть з погляду на електронні групи навколо першого атома вуглецю зліва, який з'єднаний з трьома атомами H і одним атомом N одиночними зв'язками. Навколо вуглецю є чотири групи або електрони або чотири зв'язки. Тому ми можемо передбачити, що CH 3-N частина молекули буде приблизно чотиригранною, подібною до метану:
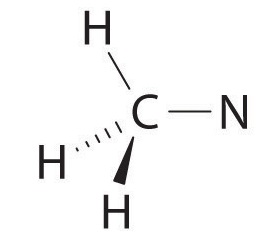
Атом азоту з'єднаний з одним вуглецем єдиним зв'язком, а з іншим вуглецем подвійним зв'язком, утворюючи в цілому три зв'язки, C - N = C. щоб азот мав октет електронів, він також повинен мати одиничну пару:
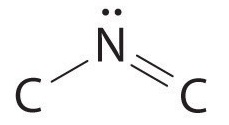
Оскільки множинні зв'язки не показані в моделі VSEPR, азот ефективно оточений трьома електронними групами. Таким чином, згідно з моделлю VSEPR, фрагмент C—N=C повинен бути зігнутий під кутом ~120°.
Вуглець у фрагменті —N = C = O подвійно пов'язаний як з азотом, так і з киснем, що в моделі VSEPR дає вуглецю загалом дві електронні пари. Отже, кут N = C = O повинен бути 180° або лінійним. Три фрагменти об'єднуються, щоб надати наступну структуру:
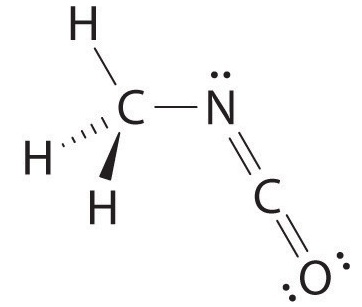
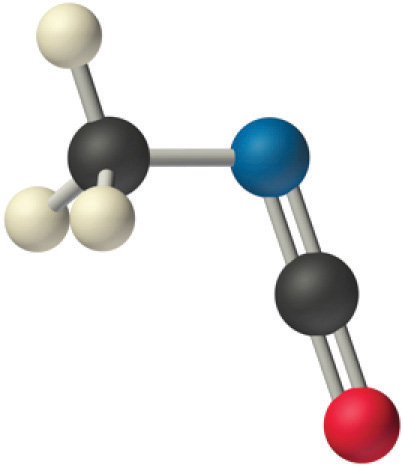
Певні закономірності проглядаються в структурах помірно складних молекул. Наприклад, атоми вуглецю з чотирма зв'язками (наприклад, вуглець зліва в метилізоціанаті), як правило, тетраедричні. Аналогічно, атом вуглецю праворуч має дві подвійні зв'язки, подібні до тих, що знаходяться в СО 2, тому його геометрія, як у CO 2, є лінійною. Розпізнавання подібності з більш простими молекулами допоможе вам передбачити молекулярну геометрію більш складних молекул.
Використовуйте модель VSEPR для прогнозування молекулярної геометрії пропіну (H 3 C—CCH), газу з деякими анестезуючими властивостями.
Дано: хімічна сполука
Запитано: молекулярна геометрія
Стратегія:
Підрахуйте кількість електронних груп навколо кожного вуглецю, визнаючи, що в моделі VSEPR множинний зв'язок вважається єдиною групою. Використовуйте рисунок,4.8.3 щоб визначити молекулярну геометрію навколо кожного атома вуглецю, а потім вивести структуру молекули в цілому.
Рішення:
Оскільки атом вуглецю зліва пов'язаний з чотирма іншими атомами, ми знаємо, що він приблизно чотиригранний. Наступні два атоми вуглецю поділяють потрійний зв'язок, і кожен має додаткову одиночну зв'язок. Оскільки множинний зв'язок вважається єдиним зв'язком у моделі VSEPR, кожен атом вуглецю поводиться так, ніби він має дві електронні групи. Це означає, що обидва ці вуглеці є лінійними, з кутами C—CC та CC—H 180°.
Прогнозуйте геометрію аллену (H 2 C = C = CH 2), сполуки з наркотичними властивостями, яка використовується для створення більш складних органічних молекул.
- Відповідь
-
Кінцеві атоми вуглецю є тригональними площинними, центральний вуглець лінійний, а кут C-C-C - 180°.