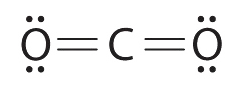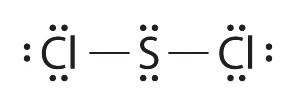4.7: Малювання структур Льюїса
- Page ID
- 21456
Цілі навчання
- Намалюйте структури Льюїса для молекул.
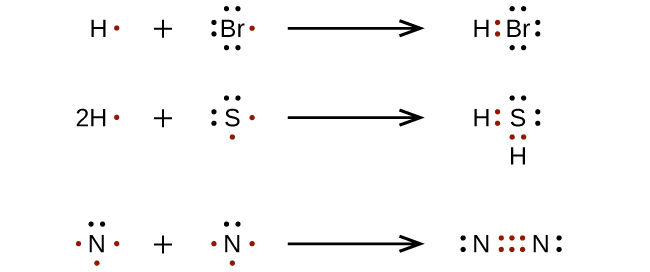
Для дуже простих молекул і молекулярних іонів ми можемо записати структури Льюїса, просто з'єднавши непарні електрони на складових атомах. Дивіться ці приклади:
Для більш складних молекул корисно дотримуватися покрокової процедури, викладеної тут:
- Впорядкуйте атоми, щоб показати конкретні зв'язки. Коли є центральний атом, він зазвичай є найменш електронегативним елементом у з'єднанні. Хіміки зазвичай перераховують цей центральний атом першим у хімічній формулі (як у cCl 4 та CO 3 2 -, які обидва мають C як центральний атом), що є ще одним ключем до структури сполуки. Водень і галогени майже завжди пов'язані лише з одним іншим атомом, тому вони, як правило, термінальні, а не центральні.
- Визначте загальну кількість валентних електронів в молекулі або іоні. Складіть разом валентні електрони від кожного атома. (Нагадаємо, що кількість валентних електронів позначається положенням елемента в таблиці Менделєєва.) Якщо вид є багатоатомним іоном, не забудьте додати або відняти кількість електронів, необхідних для отримання загального заряду на іон. Наприклад, для CO 3 2 − ми додаємо два електрони до загальної кількості через заряд −2.
- Помістіть зв'язкову пару електронів між кожною парою сусідніх атомів, щоб дати єдиний зв'язок. У Н 2 О, наприклад, є сполучна пара електронів між киснем і кожним воднем.
- Починаючи з кінцевих атомів, додайте достатньо електронів до кожного атома, щоб дати кожному атому октет (два для водню). Ці електрони зазвичай будуть одинокими парами.
- Якщо якісь електрони залишилися, помістіть їх на центральний атом. Пізніше ми пояснимо, що деякі атоми здатні вмістити більше восьми електронів.
- Якщо центральний атом має менше електронів, ніж октет, використовуйте одинокі пари з кінцевих атомів, щоб сформувати множинні (подвійні або потрійні) зв'язки з центральним атомом для досягнення октету. Це не змінить кількість електронів на кінцевих атомах.
Тепер застосуємо цю процедуру до деяких конкретних складів.
Центральний атом, як правило, є найменш електронегативним елементом в молекулі або іоні; водень і галогени, як правило, кінцеві.
\(H_2O\)Молекула
- Оскільки атоми H майже завжди кінцеві, розташування всередині молекули повинно бути HOH.
- Кожен атом Н (група 1) має 1 валентний електрон, а атом O (група 16) має 6 валентних електронів, всього 8 валентних електронів.
- Розміщення однієї сполучної пари електронів між атомом O і кожним атомом H дає H: O: H, при цьому залишилося 4 електронів.
- Кожен атом Н має повну валентну оболонку з 2 електронів.
- Додавання решти 4 електронів до кисню (у вигляді двох одиноких пар) дає наступну структуру:

Оскільки ця структура дає кисень октет, а кожному водню два електрони, нам не потрібно використовувати крок 6.
\(OCl^−\)Іон
- Маючи лише два атоми в молекулі, центрального атома немає.
- Кисень (група 16) має 6 валентних електронів, а хлор (група 17) має 7 валентних електронів; треба додати ще один для негативного заряду на іон, даючи в цілому 14 валентних електронів.
- Розміщення сполучної пари електронів між O і Cl дає O:Cl, з 12 електронами, що залишилися.
- Якщо розмістити шість електронів (у вигляді трьох одиноких пар) на кожному атомі, то отримаємо наступну структуру:
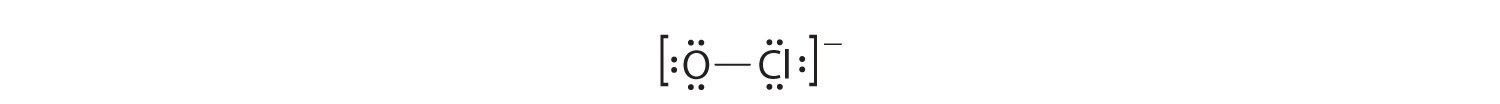
Кожен атом тепер має октет електронів, тому кроки 5 і 6 не потрібні. Електронна структура Льюїса намальована в дужках, як це прийнято для молекулярного іона, із загальним зарядом, вказаним поза дужками, а сполучна пара електронів позначається суцільною лінією. OCl - це іон гіпохлориту, активний інгредієнт хлорного відбілювача для білизни та дезінфікуючого засобу для басейну.
\(CH_2O\)Молекула
1. Оскільки вуглець менш електронегативний, ніж кисень, а водень, як правило, термінальний, С повинен бути центральним атомом. Одне з можливих розташування полягає в наступному:

2. Кожен атом водню (група 1) має один валентний електрон, вуглець (група 14) має 4 валентних електронів, а кисень (група 16) має 6 валентних електронів, для всього [(2) (1) + 4 + 6] = 12 валентних електронів.
3. Розміщення зв'язкової пари електронів між кожною парою зв'язаних атомів дає наступне:

Використовується шість електронів, а 6 залишаються.
4. Додавання всіх 6 електронів, що залишилися до кисню (як три одинокі пари) дає наступне:

Хоча кисень зараз має октет і кожен водень має 2 електрони, вуглець має лише 6 електронів.
5. На центральному атомі не залишилося електронів.
6. Щоб дати вуглецю октет електронів, ми використовуємо одну з одиноких пар електронів на кисні, щоб утворити подвійний зв'язок вуглець-кисень:

І кисень, і вуглець тепер мають октет електронів, тому це прийнятна електронна структура Льюїса. O має дві пари склеювання і дві одинокі пари, а C має чотири пари склеювання. Це структура формальдегіду, який використовується в бальзамуючої рідини.
Напишіть електронну структуру Льюїса для кожного виду.
- нКл 3
- С 2 × 2 −
- NoCl
Дано: хімічні види
Запитано: Електронні структури Льюїса
Стратегія:
Використовуйте шестиступінчасту процедуру, щоб написати електронну структуру Льюїса для кожного виду.
Рішення:
- Азот менш електронегативний, ніж хлор, а атоми галогену, як правило, термінальні, тому азот є центральним атомом. Атом азоту (група 15) має 5 валентних електронів, а кожен атом хлору (група 17) має 7 валентних електронів, загалом 26 валентних електронів. Використання 2 електронів для кожного зв'язку N—Cl і додавання трьох одиноких пар до кожного рахунку Cl для (3 × 2) + (3 × 2 × 3) = 24 електронів. Правило 5 призводить нас до розміщення решти 2 електронів на центральному N:
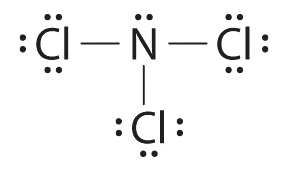
Трихлорид азоту - це нестабільна масляниста рідина, яка колись використовувалася для відбілювання борошна; це використання зараз заборонено у Сполучених Штатах.
- У двоатомній молекулі або іоні нам не потрібно турбуватися про центральний атом. Кожен атом сірки (група 16) містить 6 валентних електронів, і нам потрібно додати 2 електрона для заряду −2, даючи в цілому 14 валентних електронів. Використовуючи 2 електрони для зв'язку S—S, ми організуємо решту 12 електронів у вигляді трьох одиноких пар на кожній сірці, даючи кожному атому S октет електронів:

- Оскільки азот менш електронегативний, ніж кисень або хлор, він є центральним атомом. Атом N (група 15) має 5 валентних електронів, атом O (група 16) має 6 валентних електронів, а атом Cl (група 17) має 7 валентних електронів, що дають в цілому 18 валентних електронів. Розміщення однієї сполучної пари електронів між кожною парою зв'язаних атомів використовує 4 електрони і дає наступне:
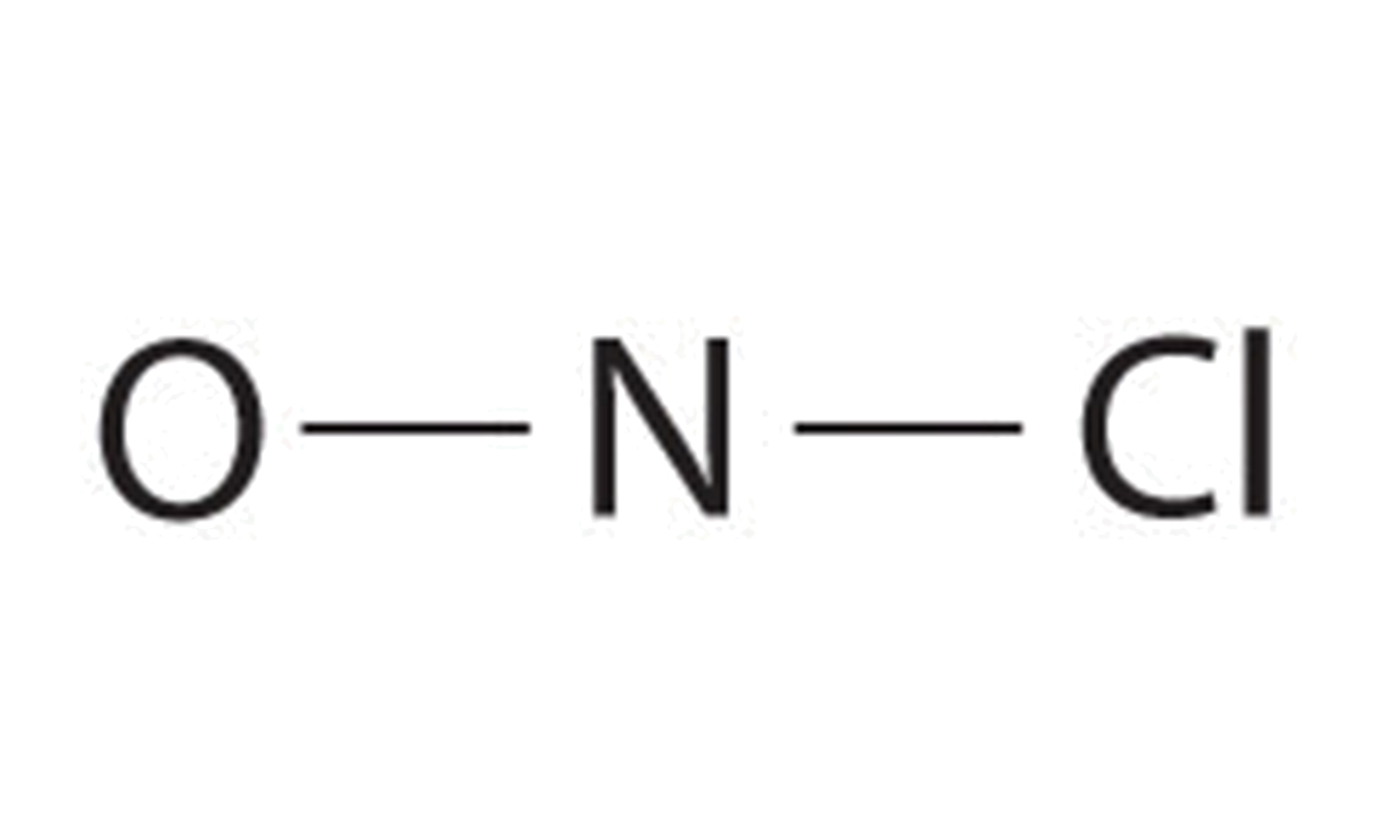
Додавання трьох одиноких пар до кисню і хлору використовує ще 12 електронів, залишаючи 2 електрони, щоб розмістити як одиноку пару на азоті:
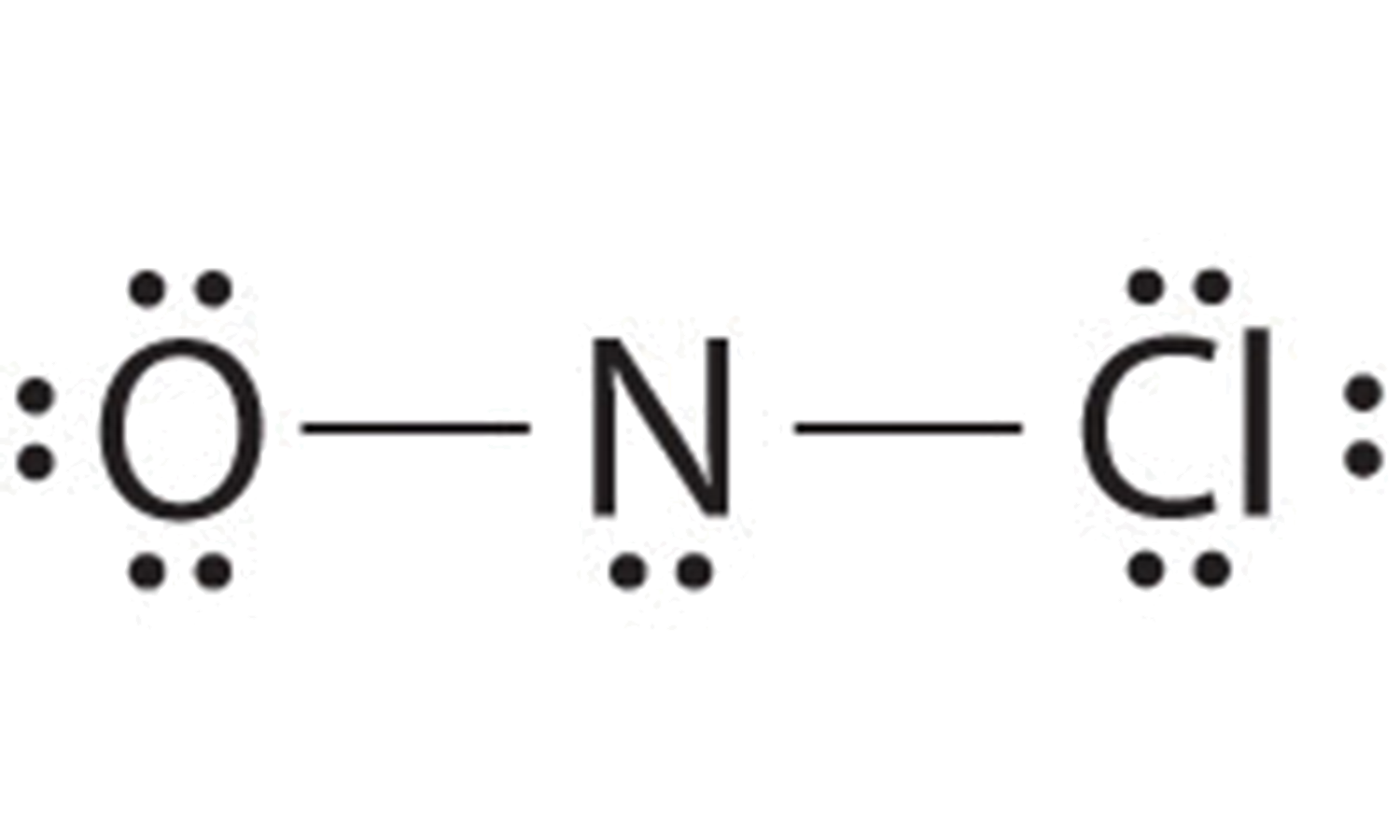
Оскільки ця структура Льюїса має лише 6 електронів навколо центрального азоту, одинока пара електронів на кінцевому атомі повинна бути використана для формування сполучної пари. Ми могли б використовувати самотню пару на O або Cl. Оскільки ми бачили багато структур, в яких O утворює подвійний зв'язок, але жодна з подвійним зв'язком з Cl, розумно вибрати самотню пару з O, щоб дати наступне:
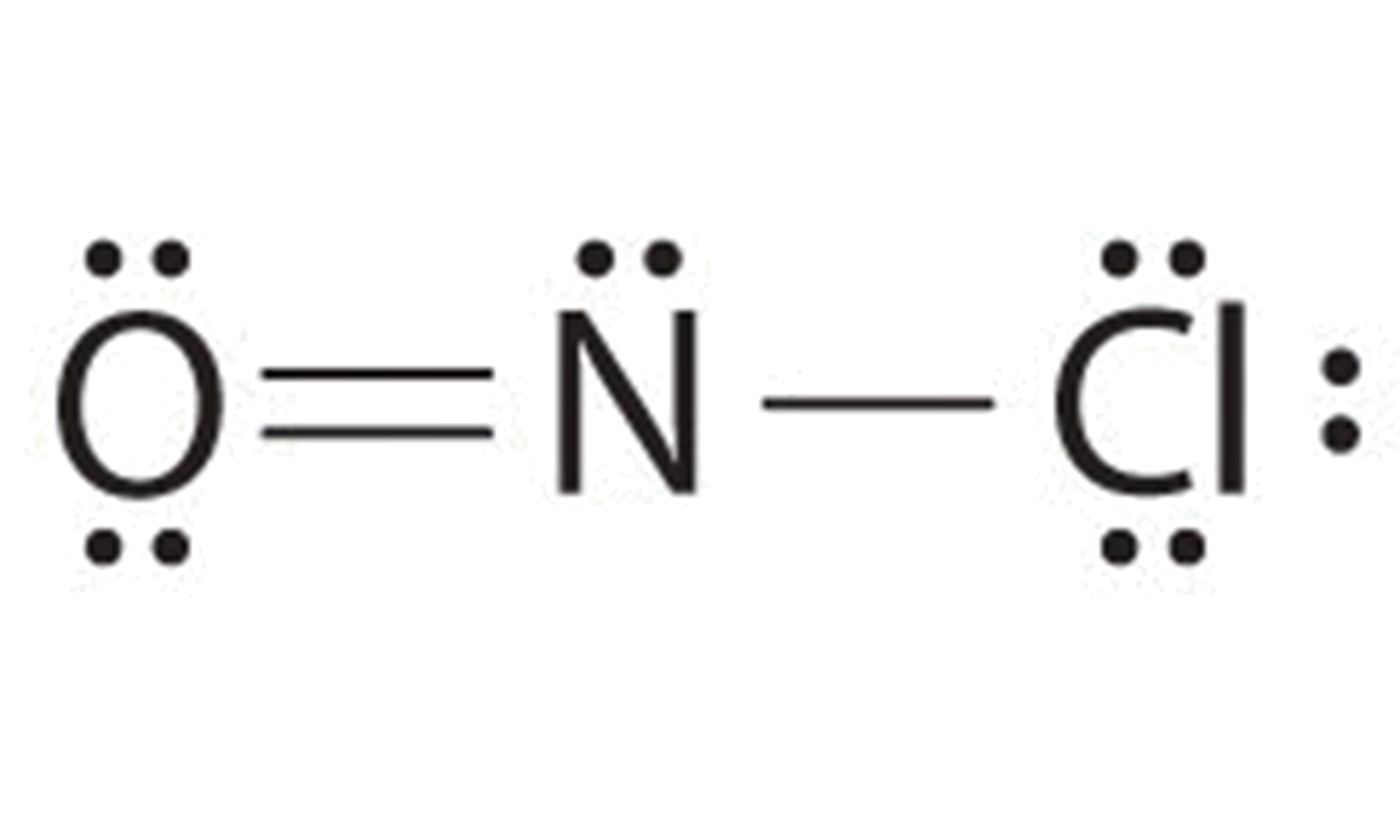
Всі атоми тепер мають октетні конфігурації. Це електронна структура Льюїса нітрозилхлориду, сильно корозійного, червонувато-оранжевого газу.
Напишіть електронні структури Льюїса для CO 2 і ScL 2, пахне ворсом, нестійкої червоної рідини, яка використовується при виготовленні гуми.
Відповідь