2.8: Конфігурації електронів та Періодична таблиця
- Page ID
- 21982
Цілі навчання
- Пов'язати електронні конфігурації елементів з формою періодичної таблиці.
- Визначте очікувану електронну конфігурацію елемента за його місцем у таблиці Менделєєва.
Пам'ятайте, що таблиця Менделєєва як інструмент для організації відомих хімічних елементів (рис.\(\PageIndex{1}\)). Елементи перераховуються за атомним номером (кількістю протонів в ядрі), а елементи з подібними хімічними властивостями згруповані між собою в стовпчики. Чому таблиця Менделєєва має ту структуру, яку вона робить? Відповідь досить проста, якщо розібратися в електронних конфігураціях: форма таблиці Менделєєва імітує заповнення підоболонок електронами.
Форма таблиці Менделєєва імітує заповнення підоболонок електронами.
Почнемо з Н і Він. Їх електронні конфігурації - 1 s 1 і 1 s 2 відповідно; при He заповнюється оболонка n = 1. Ці два елементи складають перший рядок таблиці Менделєєва (рис.\(\PageIndex{1}\))
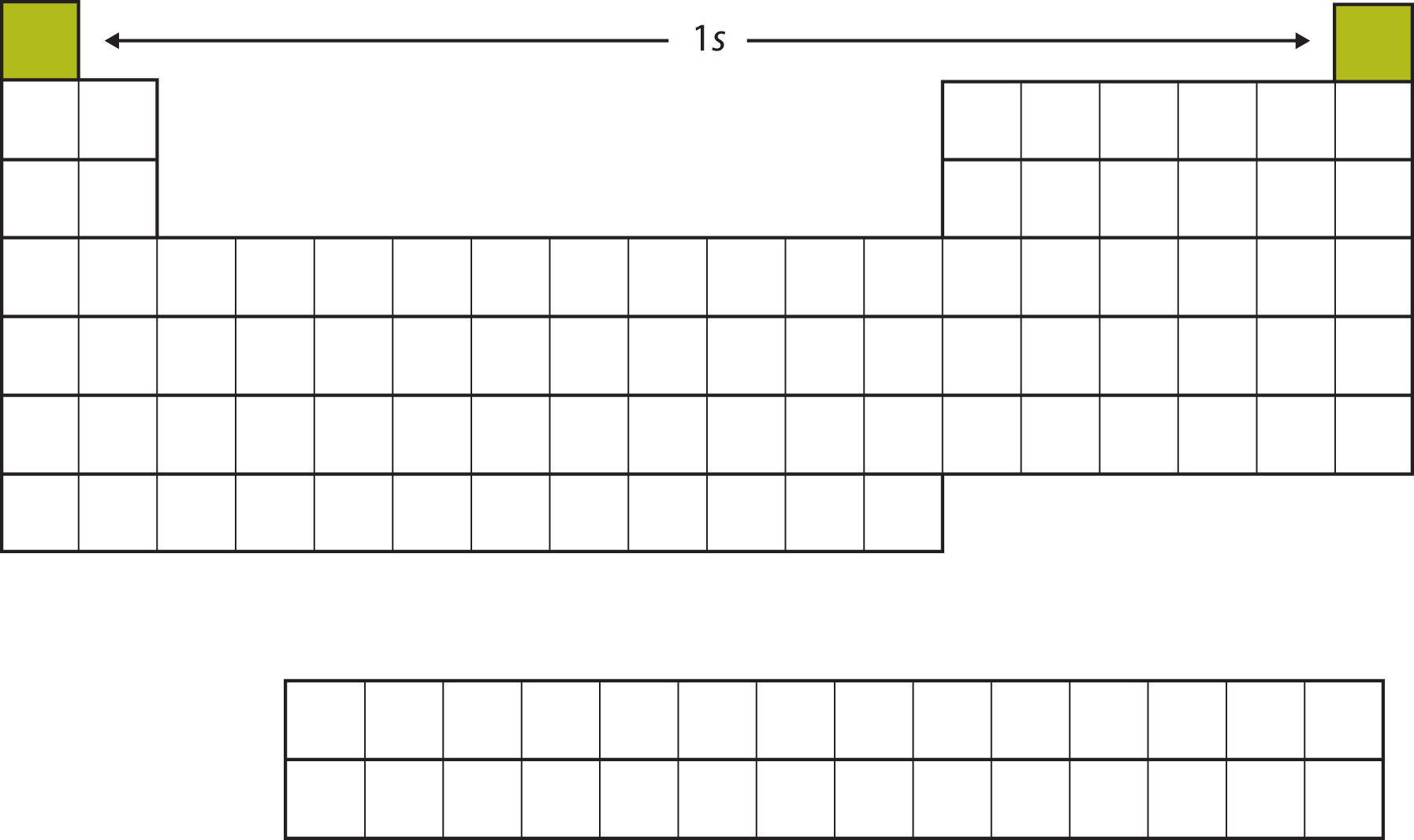
Наступні два електрони, для Li та Be, увійдуть у підоболонку 2 s. \(\PageIndex{2}\)На малюнку видно, що ці два елементи суміжні по таблиці Менделєєва.
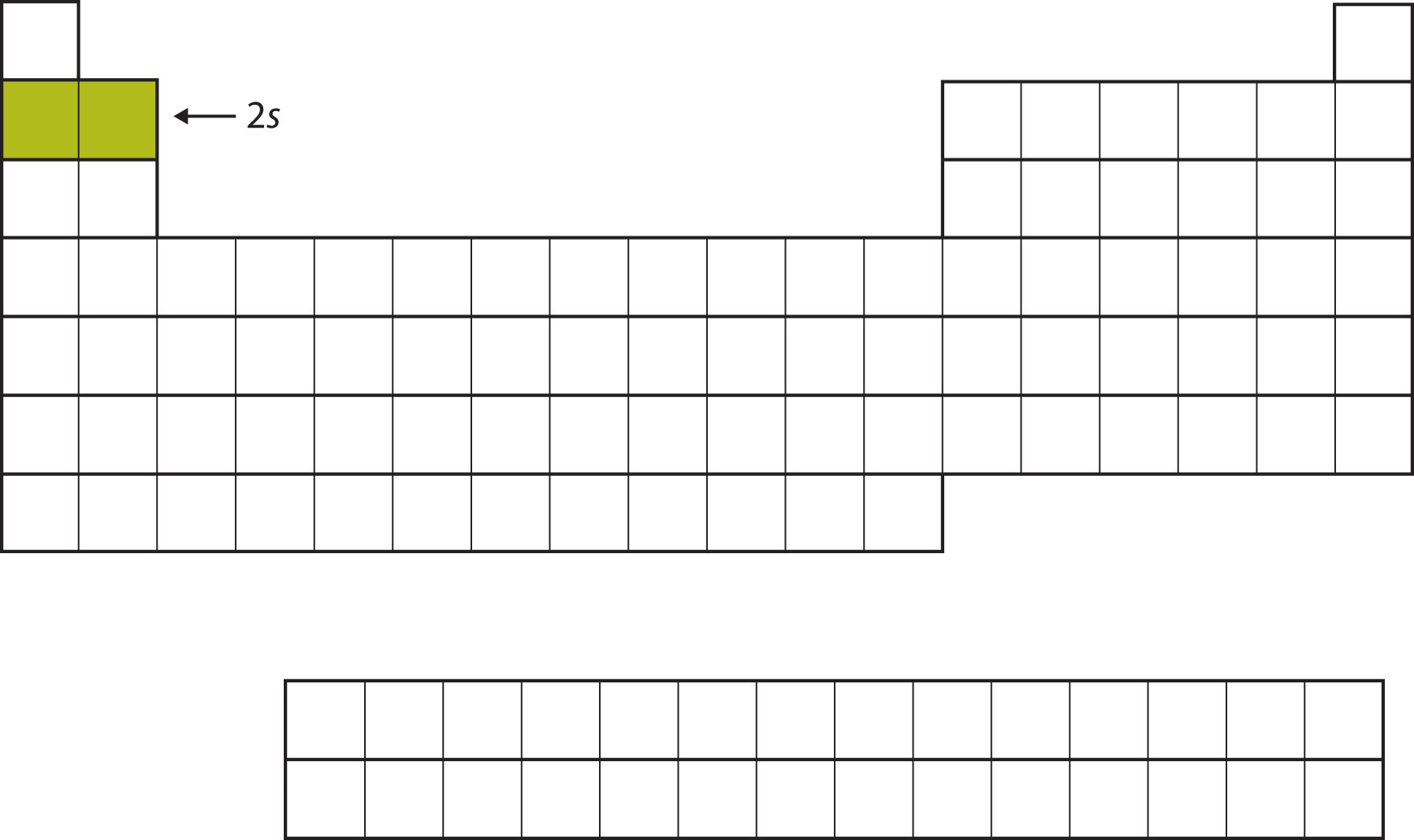
Для наступних шести елементів підоболонка 2 р зайнята електронами. У правій частині таблиці Менделєєва ці шість елементів (B - Ne) згруповані разом (рис.\(\PageIndex{3}\)).
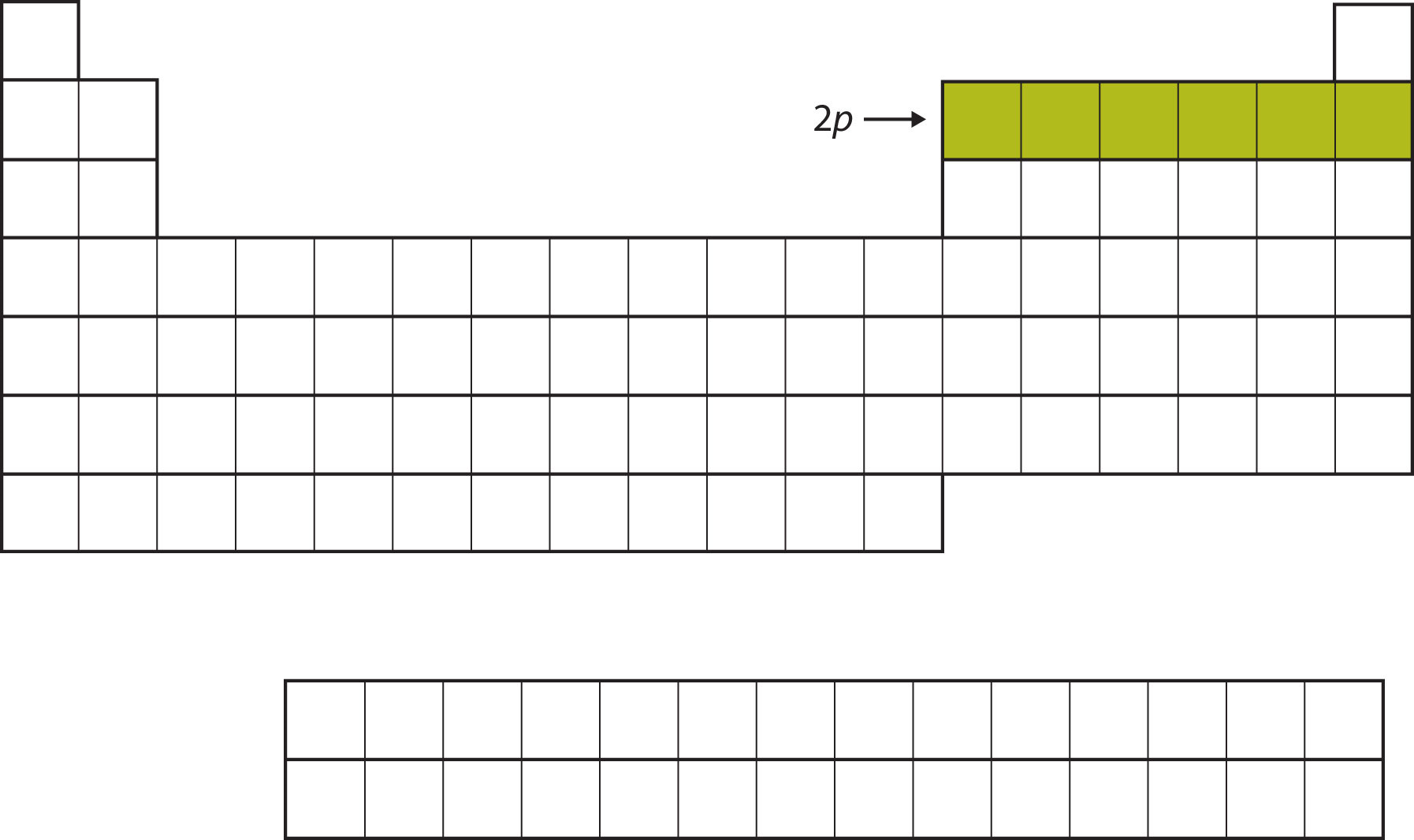
Наступною підоболонкою, яку потрібно заповнити, є підоболонка 3 s. Елементи, коли ця підоболонка заповнюється, Na і Mg, повертаються в лівій частині таблиці Менделєєва (рис.\(\PageIndex{4}\)).
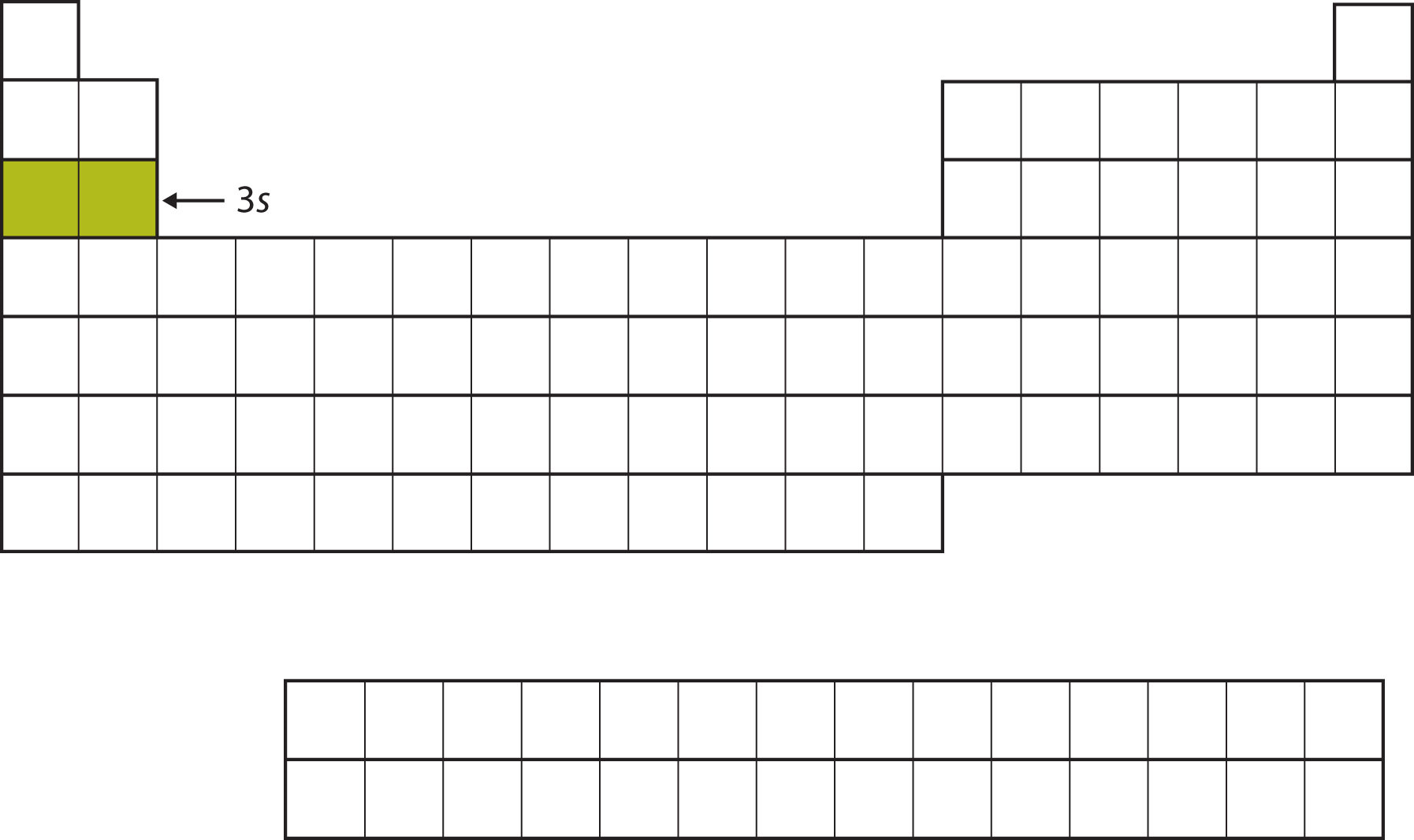
Далі 3 п підоболонки заповнюється наступними шістьма елементами (рис.\(\PageIndex{5}\)).
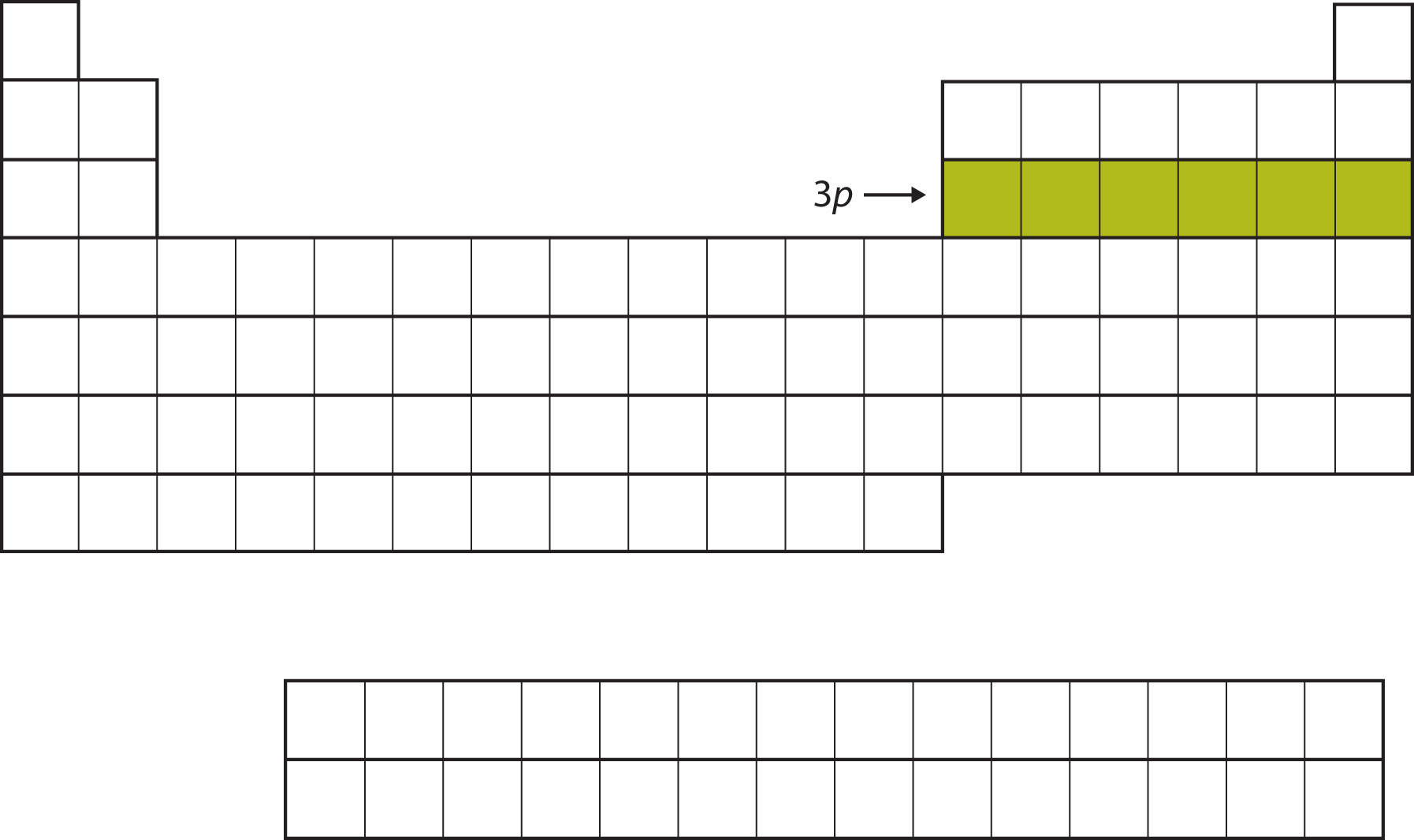
Замість заповнення 3 d підоболонки далі, електрони йдуть в підоболонку 4 s (рис.\(\PageIndex{6}\)).
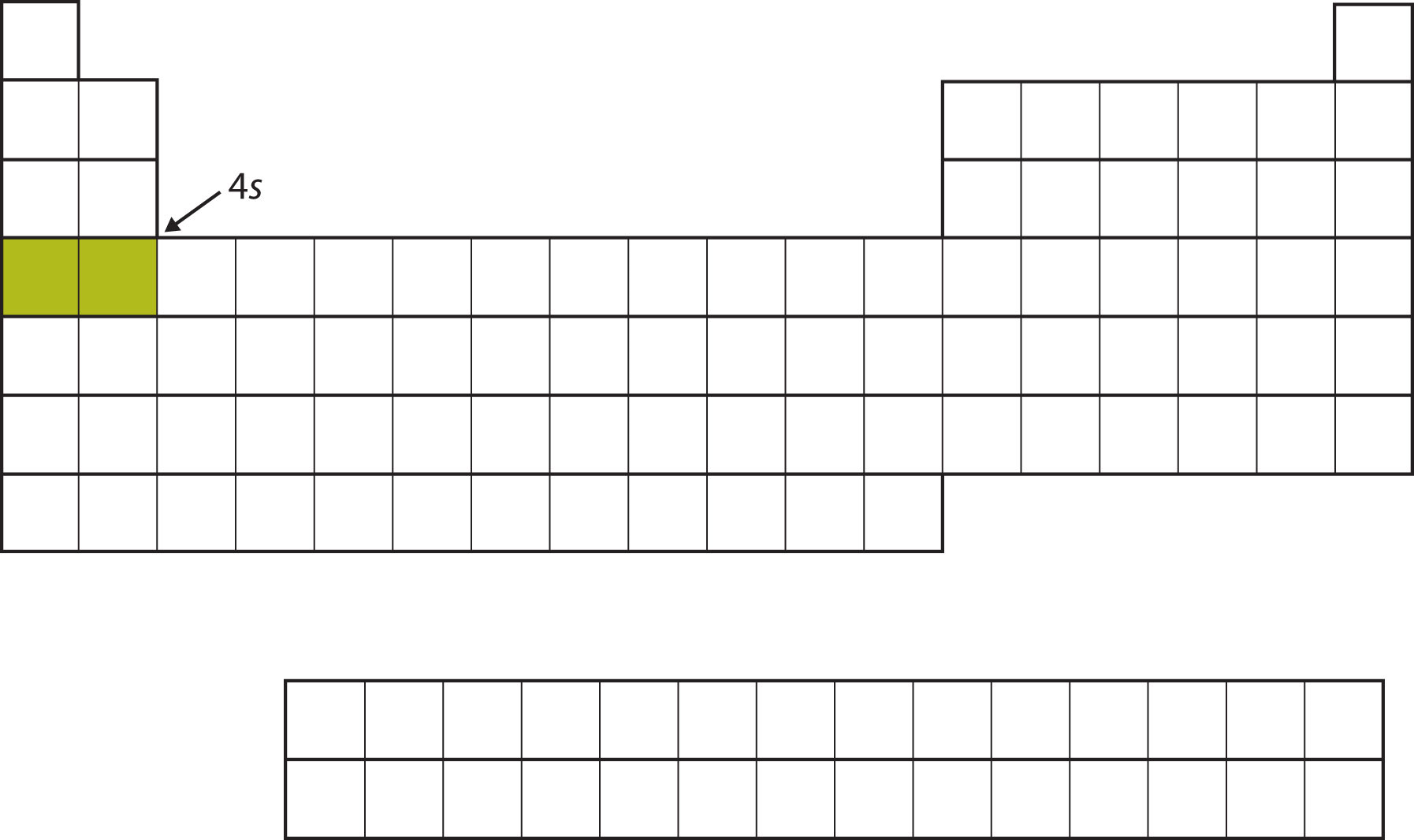
Після заповнення підоболонки 4 s підоболонка 3 d заповнюється до 10 електронів. Цим пояснюється розділ з 10 елементів в середині таблиці Менделєєва (рис.\(\PageIndex{7}\)).
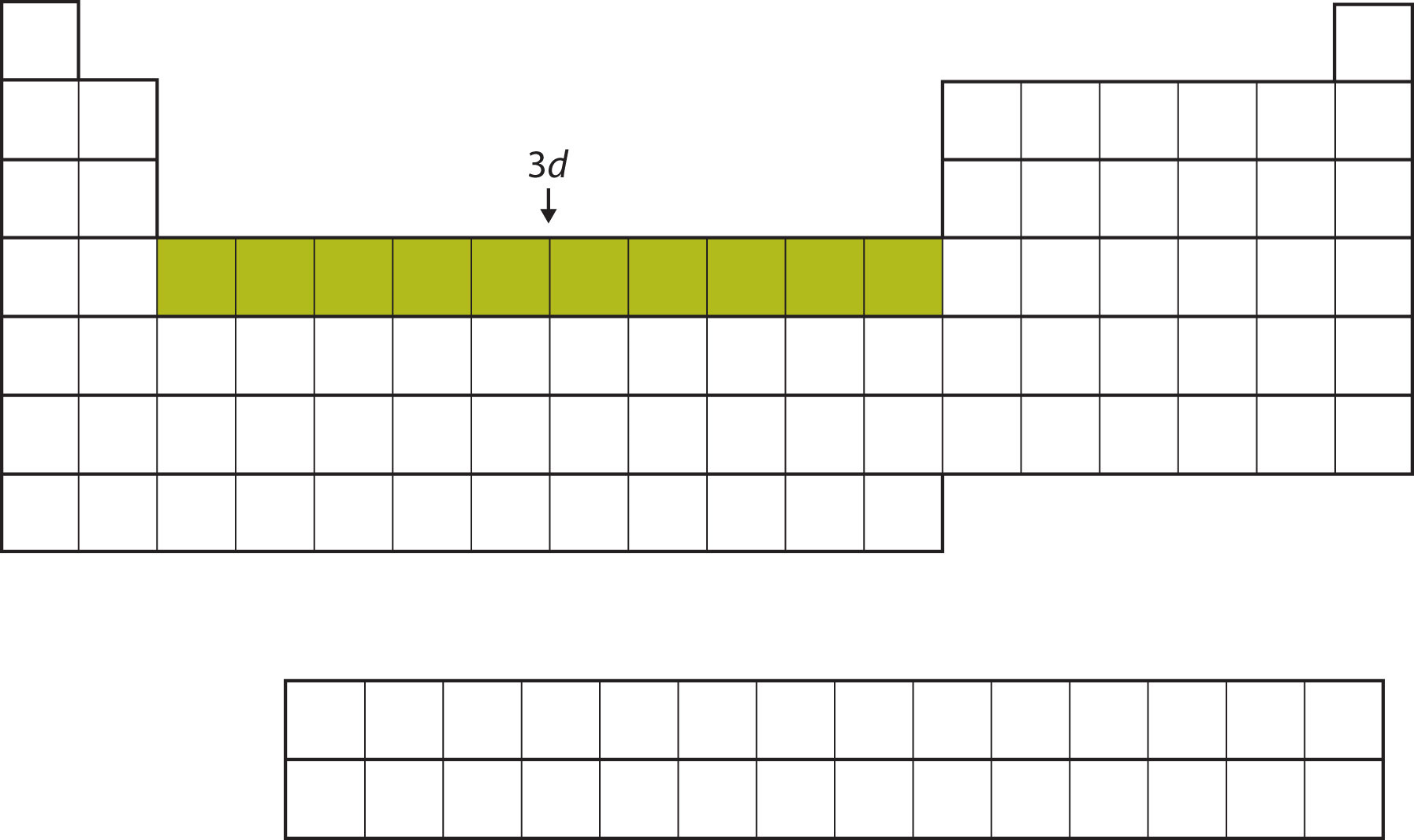
І так далі. Коли ми йдемо по стовпцях періодичної таблиці, загальна форма таблиці окреслює, як електрони займають оболонки та підоболонки.
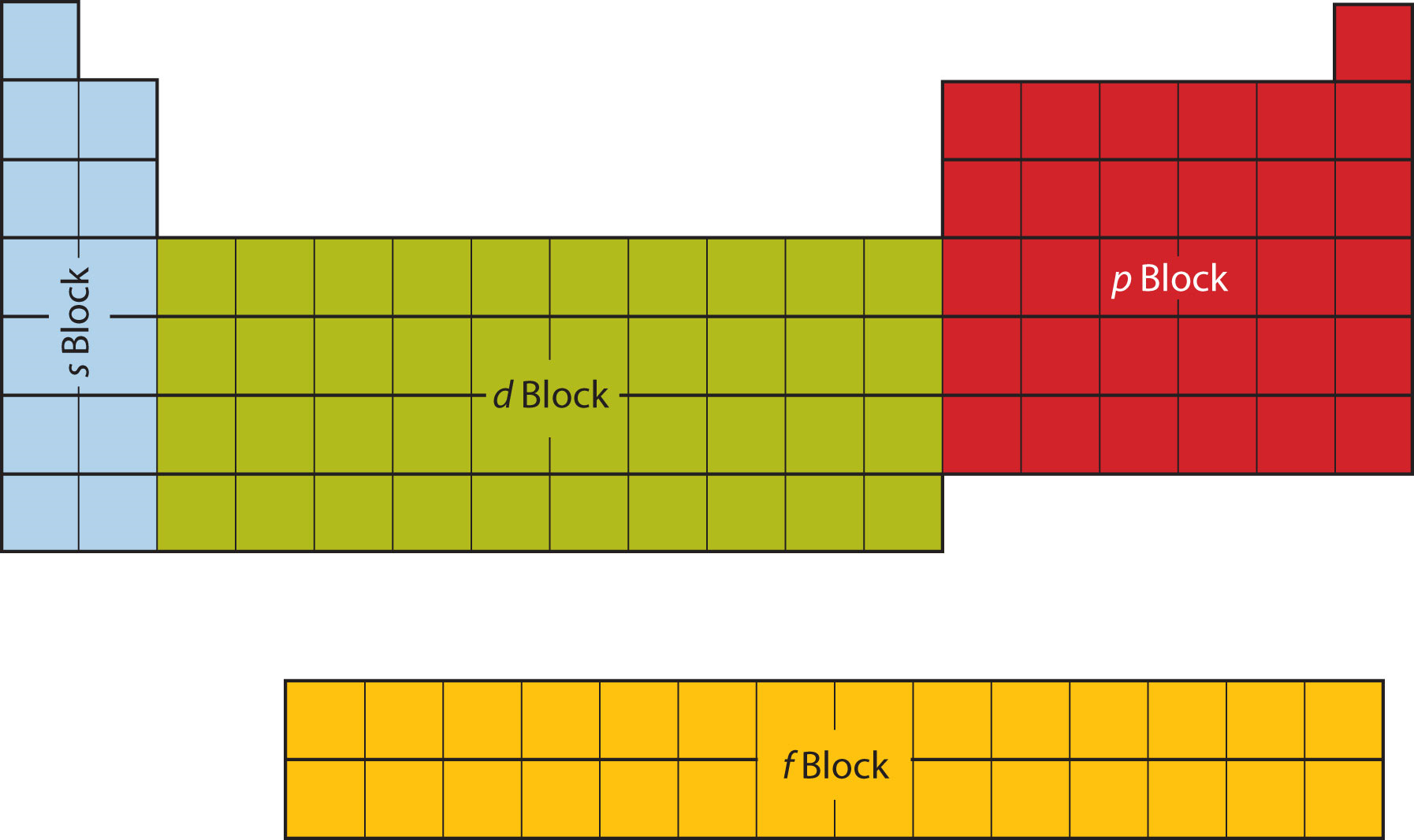
Перші два стовпці в лівій частині таблиці Менделєєва знаходяться там, де зайняті s підоболонки. Через це перші два рядки таблиці Менделєєва позначаються блоком s. Аналогічно блок p - це крайні праві шість стовпців таблиці Менделєєва, блок d - середні 10 стовпців таблиці Менделєєва, тоді як блок f - розділ з 14 стовпців, який зазвичай зображується як відокремлений від основного тіла таблиці Менделєєва. Вона могла б бути частиною основного корпусу, але тоді таблиця Менделєєва була б досить довгою і громіздкою. \(\PageIndex{8}\)На малюнку показані блоки таблиці Менделєєва.
Електрони в оболонці з найвищою нумерацією, плюс будь-які електрони в останній незаповненій підоболонці, називаються валентними електронами; оболонка з найвищою нумерацією називається валентної оболонкою. (Внутрішні електрони називаються електронами ядра.) Валентні електрони значною мірою контролюють хімію атома. Якщо ми подивимось на електронну конфігурацію валентної оболонки, то виявимо, що в кожному стовпці електронна конфігурація валентної оболонки однакова. Для прикладу візьмемо елементи в першому стовпці періодичної таблиці: H, Li, Na, K, Rb і Cs. Їх електронні конфігурації (скорочено для більших атомів) такі, при цьому електронна конфігурація валентної оболонки виділена:
| Ч: | 1 с 1 |
|---|---|
| Лі: | 1 с 2 2 с 1 |
| Na: | [Не] 3s 1 |
| К: | [Ар] 4 с 1 |
| Рб: | [Кр] 5 с 1 |
| Cs: | [Xe] 6s 1 |
Всі вони мають схожу електронну конфігурацію в своїх валентних оболонках: єдиний електрон. Оскільки значна частина хімії елемента знаходиться під впливом валентних електронів, ми очікуємо, що ці елементи матимуть подібну хімію- і вони роблять. Організація електронів в атомах пояснює не тільки форму таблиці Менделєєва, але і той факт, що елементи в одному стовпці таблиці Менделєєва мають схожу хімію.
Це ж поняття стосується і інших стовпців таблиці Менделєєва. Елементи в кожному стовпці мають однакову валентну оболонку електронної конфігурації, а елементи мають деякі схожі хімічні властивості. Це суворо вірно для всіх елементів в блоках s і p. У блоках d і f, оскільки є винятки з порядку заповнення підоболонок електронами, подібні валентні оболонки в цих блоках не є абсолютними. Однак багато подібності дійсно існує в цих блоках, тому очікується схожість за хімічними властивостями.
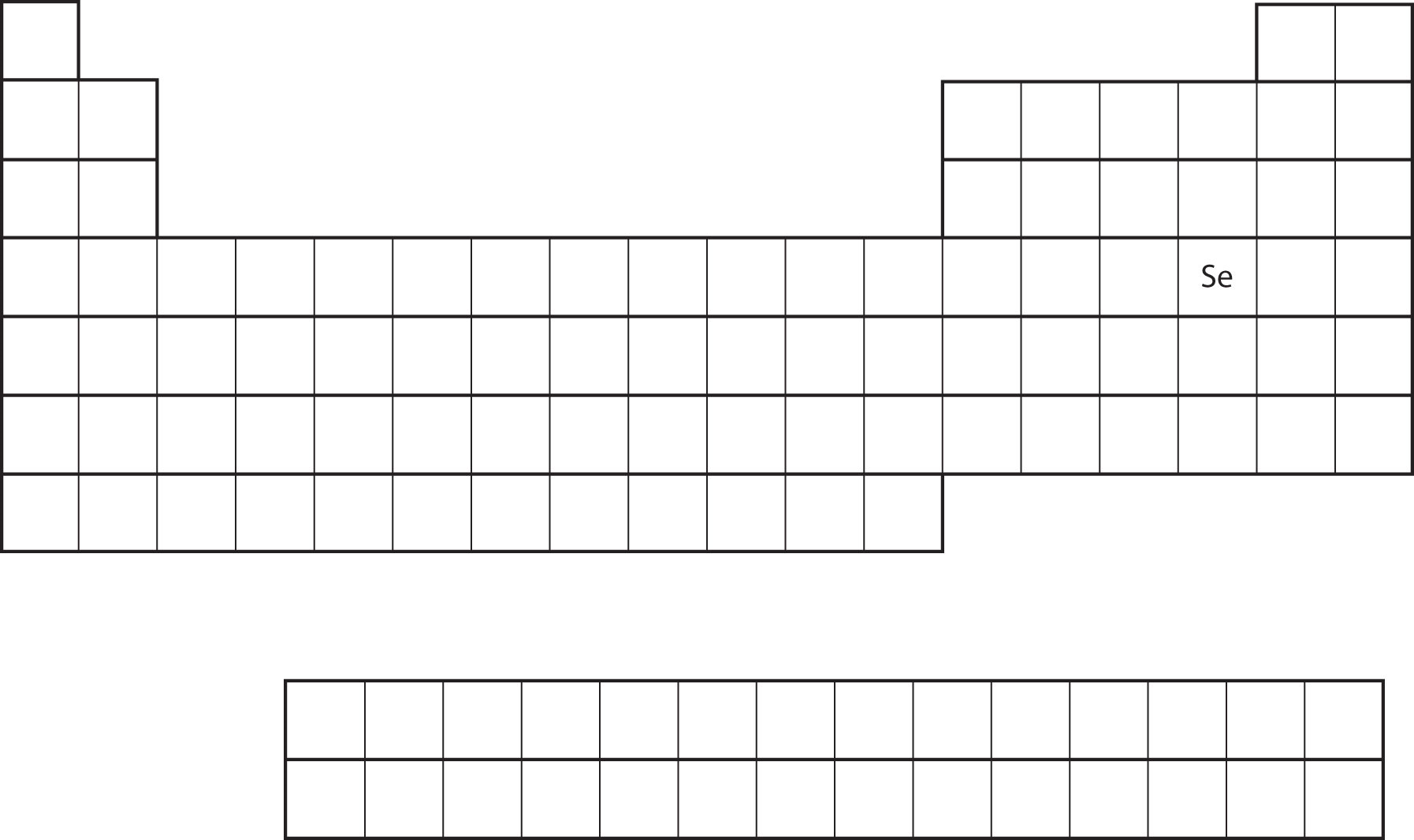
Подібність електронної конфігурації валентної оболонки передбачає, що ми можемо визначити електронну конфігурацію атома виключно за його положенням на періодичній таблиці. Розглянемо Se, як показано на малюнку\(\PageIndex{9}\). Він знаходиться в четвертому стовпчику блоку p. Це означає, що його електронна конфігурація повинна закінчуватися електронною конфігурацією p 4. Дійсно, електронна конфігурація Se є [Ar] 4 s 2 3 d 10 4 p 4, як і очікувалося.
Приклад\(\PageIndex{1}\)
З положення елемента на таблиці Менделєєва передбачити електронну конфігурацію валентної оболонки для кожного атома (рис.\(\PageIndex{10}\)).
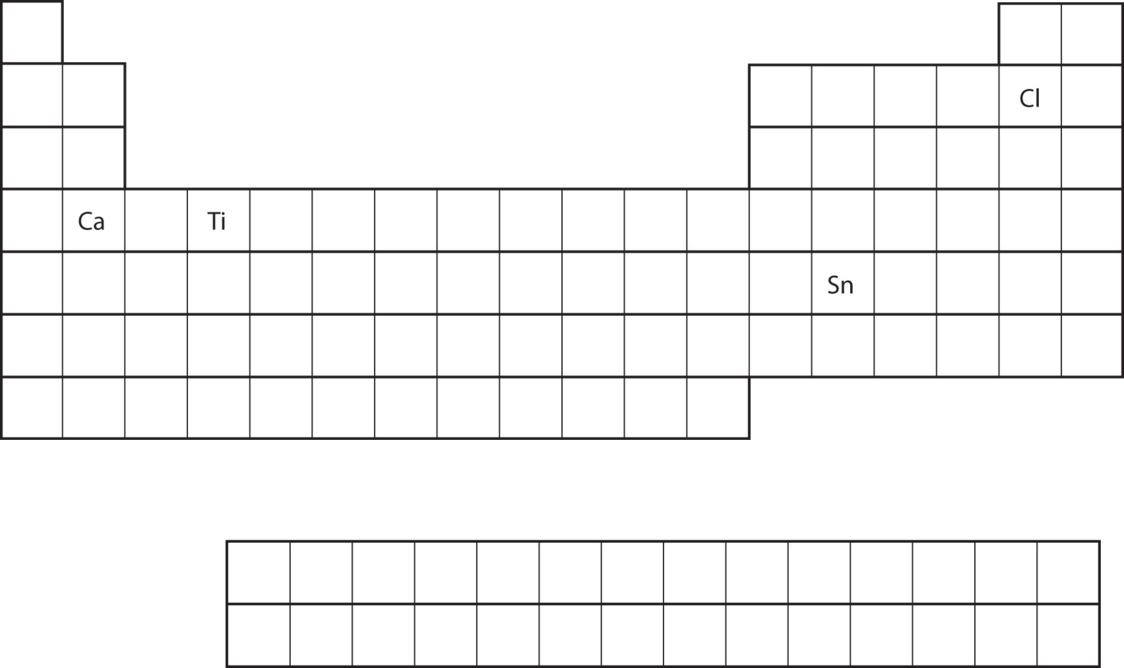
- Ca
- Сн
Рішення
- Ca знаходиться в другій колонці s блоку. Ми очікуємо, що його електронна конфігурація повинна закінчитися з s 2. Електронна конфігурація кальцію [Ar] 4 s 2.
- Sn знаходиться у другому стовпці блоку p, тому ми очікуємо, що його електронна конфігурація закінчиться на p 2. Електронна конфігурація Тіні [Кр] 5 s 2 4 d 10 5 p 2.
Вправа\(\PageIndex{1}\)
З положення елемента на таблиці Менделєєва передбачте електронну конфігурацію валентної оболонки для кожного атома. Малюнок\(\PageIndex{10}\).
- Ti
- Cl
- Відповідь на
-
[Ар] 4 с 2 3 д 2
- Відповідь б
-
[Нео] 3 s 2 3 п 5
Приклад\(\PageIndex{2}\): Алюміній
Запишіть електронну конфігурацію нейтрального атома алюмінію. Атомний номер Al дорівнює 13.
Рішення
Алюміній має 13 електронів.
Початок з періоду 1 таблиці Менделєєва, рис\(\PageIndex{2}\). Помістіть два електрони в підоболонку 1s (1s 2).
Перейдіть до періоду 2 (зліва направо). Помістіть наступні два електрони в підоболонку 2s (2s 2), а наступні шість електронів у підоболонці 2p (2p 6).
Перейдіть до періоду 3 (зліва направо). Помістіть наступні два електрони в підоболонку 3s (3s 2) і останній електрон у підоболонці 3p (3p 1).
Електронна конфігурація алюмінію 1s 2 2s 2 2p 6 3s 2 3s 2 3p 1
Вправа\(\PageIndex{2}\)
Використовуючи Рисунок\(\PageIndex{2}\) як орієнтир, напишіть електронну конфігурацію атома, який має 20 електронів
- Відповідь
-
Почніть з періоду 1 рисунка\(\PageIndex{2}\). Помістіть два електрони в підоболонку 1s (1s 2).
Перейдіть до періоду 2 (зліва направо). Помістіть наступні два електрони в підоболонку 2s (2s 2), а наступні шість електронів у підоболонці 2p (2p 6).
Перейдіть до періоду 3 (зліва направо). Помістіть наступні два електрони в підоболонку 3s (3s 2), а наступні шість електрона в підоболонці 3p (3p 6).
Перейдіть до періоду 4. Помістіть інші два електрони в підоболонку 4s (4s 2).
Конфігурація електронів 1s 2 2s 2 2p 6 3s 2 3s 2 3p 6 4s 2
Резюме
Розташування електронів в атомах відповідає за форму таблиці Менделєєва. Електронні конфігурації можна передбачити за положенням атома на періодичній таблиці