6.8: рН буфери
Що таке буфер рН?
Буфер рН - це водний розчин, що складається зі слабкої кислоти та її кон'югатної основи або навпаки, що дозволяє зміні рН бути мінімальним, коли до нього додається невелика кількість сильної кислоти або сильної основи.
Наприклад, додавання 0,020 моль HCl в 1 л води змінює рН від 7 до 1,7, тобто приблизно на 80% зміна рН. Додавання 0,020 моль NaOH в ту ж воду змінює рН від 7 до 12,3, тобто, знову ж таки, приблизно на 80% зміна рН. На відміну від чистої води, 1 л буферного розчину, що містить 0,50 моль оцтової кислоти (СН 3 СООН) і 0,50 моль СН 3 СОО - -кон'югат оцтової кислоти, змінює рН з 4,74 до 4,70 шляхом додавання тих же 0,020 моль HCl і від 4,74 до 4,77 шляхом додавання 0,020 моль NaOH, тобто приблизно 1% зміна рН, як показано на рис. 6.8.1.
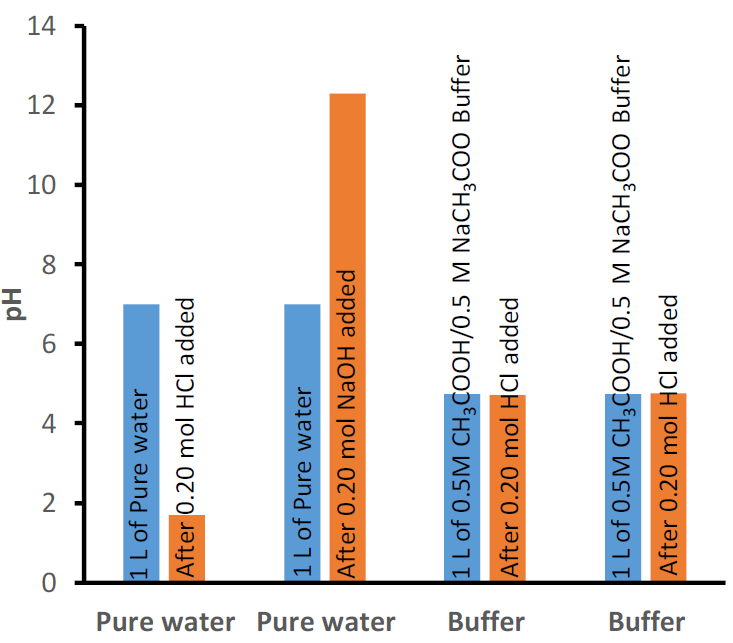
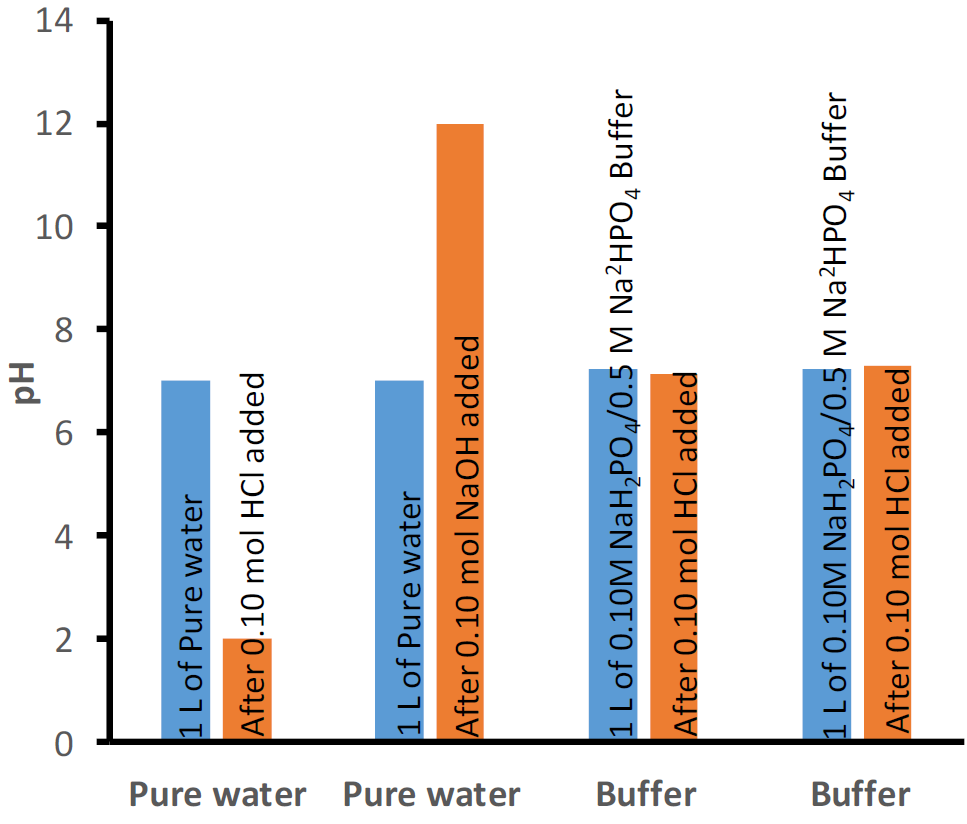
Буфери з різними початковими значеннями рН можуть бути отримані, наприклад, шляхом зміни співвідношення слабкої кислоти до її кон'югатної основи або за допомогою іншого набору слабкої кислоти та її кон'югатної основи. Одним із прикладів є буфер початкового рН 4,74, що містить 0,5 М оцтової кислоти і 0,5 М ацетату натрію, показаний на рис. 6.8.1. Іншим прикладом є буфер, що містить 0,1 М дигідрофосфату і 0,1 М гідрофосфату, який має початковий рН 7,21, як показано на рис. 6.8.2.
Буферна ємність відноситься до того, скільки сильної кислоти або сильної основи може обробити буфер, перш ніж відбудеться різка зміна рН.
Вища кількість слабкої кислоти/кон'югатної основи вище буферна ємність. Буфер має рівну кількість слабкої кислоти і його кон'югатна основа має більш високу буферну ємність, ніж той же буфер, який має нерівне співвідношення кислоти і її кон'югатної основи.
Сильна кислота і її кон'югатна основа або міцна основа і її кон'югатна кислота не роблять буферного розчину.
Механізм буферної дії
Буфер містить слабку кислоту і її кон'югатну основу в рівновазі. Наприклад, буфер оцтової кислоти/ацетату натрію має наступну рівновагу.
\ begin {рівняння}
\ математика {CH} _ {3}\ mathrm {COOH}\ стрілки праворуч\ математика {H} ^ {+} +\ mathrm {CH} _ {3}\ mathrm {COO} ^ {-}\ nonumber
\ end {рівняння}
Молярна концентрація іонів водню [Н +] визначає рН розчину. Кон'югатна основа споживає будь-яку додану сильну кислоту.
\ begin {рівняння}
\ математика {HA} +\ математика {CH} _ {3}\ математика {COO} ^ {-}\ стрілка вправо\ математика {CH} _ {3}\ mathrm {COOH} +\ mathrm {A} ^ {-}\ nonumber
\ end {рівняння}
, Де ГК - будь-яка сильна кислота, а А - це її кон'югатна основа. Концентрація СН 3 СООН збільшується і CH 3 COO - знижується, але pH зменшується мало, оскільки [Н +] збільшується лише трохи. Точно так само слабку кислоту споживає будь-яка сильна додана основа.
\ begin {рівняння}
\ математика {МОН} +\ математика {CH} _ {3}\ математика {COOH}\ стрілка вправо\ математика {CH} _ {3}\ математика {COO} ^ {-} +\ математика {M} ^ {+} +\ математика {H} _ {2}\ mathrm {O}\ nonum
\ кінець {рівняння}
Де МОН - це будь-яка міцна основа, а М + - її кон'югатна кислота. Рис. 6.8.3 ілюструє механізм буферної дії.
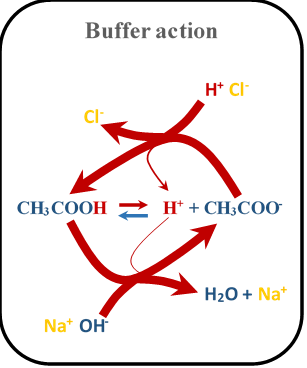
Сильна кислота та її кон'югатна основа суміш не мають буферної дії, оскільки кислота дисоціює майже 100%, не залишаючи кислоти для буферної дії. Кон'югатна основа сильної кислоти - дуже слабка основа, яка не вступає в реакцію з доданими кислотами. Це ж пояснення стосується міцної основи та її кон'югатної кислотної суміші, що не має буферної дії.
Буфери в крові
Кров підтримує свій рН ~ 7,4 насамперед за допомогою буферної системи вуглекислоти/гідрокарбонату. РН крові в діапазоні від 7,45 до 7,35 вважається здоровим, але поза цим діапазоном викликає медичні проблеми. Якщо рН крові знижується до 6,8 або підвищується до 8,0, може наступити летальний результат. Дуже важливо підтримувати рН крові у вузькому діапазоні, щоб клітини працювали правильно. Зокрема, ферменти та інші білки мають вторинні, третинні та четвертинні структури, необхідні для їх належних функцій. Водневий зв'язок відіграє вирішальну роль у визначенні структури білка. Зміни рН змінюють водневий зв'язок, роблячи білки менш ефективними або неефективними у своїх функціях.
Буферні системи регулюють рН крові. Первинна буферна система крові - вуглекислота/гідрокарбонат, як показано на рис. 6.8.4. Метаболічні процеси в клітині виробляють вуглекислий газ (СО 2), який потрапляє в кров і виробляє вугільну кислоту (Н 2 СО 3), вступаючи в реакцію з водою. Нирки постачають гідрокарбонат (HCO 3 -) - кон'югатну основу вугільної кислоти, а також утримують резервуар HCO 3 -. H 2 CO 3 споживає будь-яку додану основу, а HCO 3 - споживає будь-яку додану кислоту, тим самим мінімізуючи зміну рН за рахунок доданих кислот і підстав.
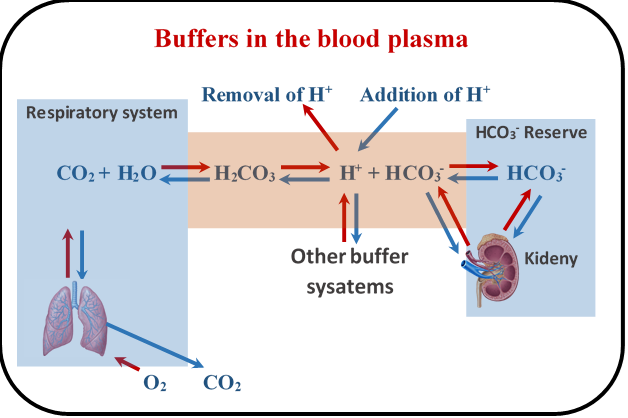
Первинний механізм регулювання рН Н 2 СО 3 /HCO 3 - буфер в крові знаходиться через легені. Коли рН крові кислий в порівнянні з середнім, швидкість дихання збільшується, видихаючи більше СО 2, що зменшує концентрацію Н +, слідуючи синім стрілкам на рис. 6.8.4, збільшуючи рН. Зниження частоти дихання має зворотний ефект. Нирки також регулюють рН крові шляхом додавання або видалення HCO 3 -, але реакція нирок затримується в порівнянні з відповіддю легенів.
