6.7: Кислотно-лужні реакції
- Page ID
- 25538
Кислотно-лужні реакції - це хімічні реакції, які передбачають перенесення протона (Н +). Приклади включають реакції кислот з металами, карбонатами та основами Arrhenius, описані нижче.
Реакції кислот з металами
Метали, як правило, видають електрон і стають катіонами. Більшість металів, званих реактивними металами, виділяють електрони протонам в кислотах і виділяють газ Н 2. Наприклад, на рис. 6.7.1 показаний магній, що вступає в реакцію з соляною кислотою наступною реакцією:
\[\mathrm{Mg}(\mathrm{s})+2 \mathrm{HCl} \rightarrow \mathrm{MgCl}_{2}(\mathrm{aq})+\mathrm{H}_{2}(\mathrm{~g}) \uparrow\nonumber\]

Лужні метали, такі як Na, видають один електрон, лужноземельні метали, як Mg, видають два електрони, а алюміній видає три електрони. Протон може приймати один електрон. Тому кількість кислих протонів має дорівнювати числу виданих електронів, щоб збалансувати перенесення електронів в цих реакціях.
Винятком є благородні метали або ювелірні метали, такі як золото, срібло, платина, мідь - вони не реагують з кислотами.
написати збалансоване рівняння для реакції алюмінію з HBr?
Рішення
Крок 1) запишіть рівняння з правильними формулами реагентів і продуктів.
\[\mathrm{Al}(\mathrm{s})+\mathrm{HBr}(\mathrm{aq}) \rightarrow \mathrm{AlBr}_{3}(\mathrm{aq})+\mathrm{H}_{2}(\mathrm{~g})\nonumber\]
Зверніть увагу, що Al видає три електрони, щоб зробити Al 3 +; саме тому три Br - прикріплені до нього в виробі, щоб збалансувати заряд.
Крок 2) збалансувати втрачені металом електрони з кількістю кислих протонів.
\[\mathrm{Al}(\mathrm{s})+3 \mathrm{HBr}(\mathrm{aq}) \rightarrow \mathrm{AlBr}_{3}(\mathrm{aq})+\mathrm{H}_{2}(\mathrm{~g})\nonumber\]
Крок 3) Збалансуйте інші елементи методом удару та випробування. Зліва є 3 атоми водню, збалансуйте їх, додавши коефіцієнт 3/2 до водню праворуч.
\[\mathrm{Al}(\mathrm{s})+3 \mathrm{HBr}(\mathrm{aq}) \rightarrow \mathrm{AlBr}_{3}(\mathrm{aq})+\frac{3}{2} \mathrm{H}_{2}(\mathrm{~g})\nonumber\]
Крок 4. Хоча рівняння збалансоване, рекомендується видалити дріб шляхом множення коефіцієнтів у всьому рівнянні з найвищим загальним коефіцієнтом для отримання остаточного збалансованого рівняння.
\[2 \mathrm{Al}(\mathrm{s})+6 \mathrm{HBr}(\mathrm{aq}) \rightarrow 2 \mathrm{AlBr}_{3}(\mathrm{aq})+3 \mathrm{H}_{2}(\mathrm{~g})\nonumber\]
Реакції кислот з карбонатами і карбонатами водню
Вугільна кислота (H 2 CO 3) - слабка кислота, що міститься в газованій воді. H 2 CO 3 є продуктом вуглекислого газу (CO 2) і води (H 2 O) шляхом наступної реакції рівноваги.
\[\ce{CO2(aq) + H2O(l) <=> H2CO3(aq)}\nonumber\]
Гідрокарбонат (НСО 3 -) і карбонат (СО 3 2 -) на один і два водню менше, ніж вугільної кислоти. Солі, що містять ГСО 3 - і СО 3 2 - приймають один і два протони відповідно з кислот, щоб зробити Н 2 СО 3. H 2 CO 3 розкладається на вуглекислий газ і воду зворотною реакцією, показаною вище. На рис. 6.7.2 показана реакція гідрокарбонату натрію з соляною кислотою.
\[\mathrm{NaHCO}_{3}(\mathrm{~s})+\mathrm{HCl}(\mathrm{aq}) \rightarrow \mathrm{NaCl}(\mathrm{aq})+\mathrm{H}_{2} \mathrm{O}(\mathrm{I})+\mathrm{CO}_{2}(\mathrm{~g}) \uparrow\nonumber\]


Малюнок\(\PageIndex{2}\): Реакція карбонату натрію з HCl. До і після додавання HCl. Вуглекислий газ бульбашки після додавання HCl. Джерело: НКЦПФР, 18.05.20, https://youtu.be/TJYOxGHNTzg, CC BY 3.0
Аналогічно карбонат кальцію, знайдений у вапняку, реагує з кислотами. Наприклад, сірчана кислота є одним із компонентів кислотних дощів, який вступає в реакцію з карбонатом кальцію і пошкоджує скульптури з каменю.
\[\mathrm{CaCO}_{3}(\mathrm{~s})+\mathrm{H}_{2} \mathrm{SO}_{4}(\mathrm{aq}) \rightarrow \mathrm{CaSO}_{4}(\mathrm{aq})+\mathrm{H}_{2} \mathrm{O}(\mathrm{l})+\mathrm{CO}_{2}(\mathrm{~g}) \uparrow\nonumber\]
Реакції кислот з основами Арреніуса
Кислоти виділяють протон (Н +), а основи Арреніуса виділяють гідроксидні іони (ОН -) в розчині. При змішуванні кислоти з основою Арреніуса Н + і ОН - іони вступають в реакцію між собою і виробляють молекули води.
\[\mathrm{H}^{+}(\mathrm{aq})+\mathrm{OH}^{-}(\mathrm{aq}) \rightarrow \mathrm{H}_{2} \mathrm{O}(\mathrm{l})\nonumber\]
Це чисте іонне рівняння реакції кислоти з основою Арреніуса. Катіон основи та аніон кислоти не реагують - вони є глядацькими іонами. Рівняння реакції для кислотно-лужної реакції записано різними способами, поясненими нижче.
молекулярне рівняння
Молекулярне рівняння показує формули речовин. Наприклад, молекулярне рівняння реакції HCl з NaOH наступне.
\[\mathrm{HCl}(\mathrm{aq})+\mathrm{NaOH}(a q) \rightarrow \mathrm{NaCl}(a q)+\mathrm{H}_{2} \mathrm{O}(\mathrm{l})\nonumber\]
Повне іонне рівняння
Повне іонне рівняння показує електроліти, дисоційовані на іони, оскільки вони насправді існують у водній фазі, тобто як водні іони. Повне іонне рівняння реакції HCl з NaOH наступне.
\[\mathrm{H}^{+}(\mathrm{aq})+\mathrm{Cl}^{-}(\mathrm{aq})+\mathrm{Na}^{+}(\mathrm{aq})+\mathrm{OH}^{-}(\mathrm{aq}) \rightarrow \mathrm{H}_{2} \mathrm{O}(\mathrm{l})+\mathrm{Na}^{+}(\mathrm{aq})+\mathrm{Cl}^{-}(\mathrm{aq})\nonumber\]
Очевидно, що Na + і Cl - не реагують —вони є глядацькими іонами.
Чисте іонне рівняння
Іони глядачів присутні по обидва боки рівняння в рівних числах. Глядацькі іони можуть бути скасовані, як і терміни в алгебраїчному рівнянні.
\[\mathrm{H}^{+}(\mathrm{aq})+\cancel{\mathrm{Cl}^{-}(\mathrm{aq})}+\cancel{\mathrm{Na}^{+}(\mathrm{aq})}+\mathrm{OH}^{-}(\mathrm{aq}) \rightarrow \mathrm{H}_{2} \mathrm{O}(\mathrm{l})+\cancel{\mathrm{Na}^{+}(\mathrm{aq})}+\cancel{\mathrm{Cl}^{-}(\mathrm{aq})}\nonumber\]
Чисте іонне рівняння показує речовини, які не є глядацькими іонами після скасування глядацьких іонів з повного іонного рівняння. Чисте іонне рівняння реакції HCl з NaOH наступне.
\[\mathrm{H}^{+}(\mathrm{aq})+\mathrm{OH}^{-}(\mathrm{aq}) \rightarrow \mathrm{H}_{2} \mathrm{O}(\mathrm{l})\nonumber\]
Всі реакції сильних кислот з сильними основами Арреніуса мають однакове чисте іонне рівняння.
Написання збалансованого хімічного рівняння реакції кислот з основами Арреніуса
Наступний приклад показує кроки, необхідні для написання збалансованого рівняння реакції кислоти з основою Арренія.
Написати збалансоване хімічне рівняння реакції між HCl і Ca (OH) 2?
Рішення
Крок 1) Напишіть формулу кислоти та основи в реагентах і солі та води в продуктах. Всі сильні електроліти розчиняються у воді, тому використовуйте (aq) для представлення їх стану.
\[\mathrm{HCl}(\mathrm{aq})+\mathrm{Ca}(\mathrm{OH})_{2}(\mathrm{aq}) \rightarrow \text { Salt(aq) }+\mathrm{H}_{2} \mathrm{O}(\mathrm{l})\nonumber\]
Крок 2) Врівноважте Н + в кислоті з ОН - в основі.
\[2 \mathrm{HCl}(\mathrm{aq})+\mathrm{Ca}(\mathrm{OH})_{2}(\mathrm{aq}) \rightarrow \mathrm{Salt}(\mathrm{aq})+\mathrm{H}_{2} \mathrm{O}(\mathrm{l})\nonumber\]
Крок 3) Збалансувати Н 2 О з Н + в кислоті, або з ОН - в основі.
\[2 \mathrm{HCl}(\mathrm{aq})+\mathrm{Ca}(\mathrm{OH})_{2}(\mathrm{aq}) \rightarrow \text { Salt }(\mathrm{aq})+2 \mathrm{H}_{2} \mathrm{O}(\mathrm{I})\nonumber\]
Крок 4) Напишіть сіль, розчісуючи катіони від основи і аніони з кислоти. Переконайтеся, що заряди збалансовані в солі, щоб зробити її нейтральною речовиною.
\[2 \mathrm{HCl}(\mathrm{aq})+\mathrm{Ca}(\mathrm{OH})_{2}(\mathrm{aq}) \rightarrow \mathrm{CaCl}_{2}(\mathrm{aq})+2 \mathrm{H}_{2} \mathrm{O}(\mathrm{I})\]
Написати збалансоване хімічне рівняння реакції між H 2 SO 4 і Ba (OH) 2?
Рішення
Крок 1) Напишіть формулу кислоти та основи в реагентах і солі та води в продуктах. Всі сильні електроліти розчиняються у воді, тому використовуйте (aq) для представлення їх стану.
\[\mathrm{H}_{2} \mathrm{SO}_{4}(\mathrm{aq})+\mathrm{Ba}(\mathrm{OH})_{2}(\mathrm{aq}) \rightarrow \mathrm{Salt}(\mathrm{aq})+\mathrm{H}_{2} \mathrm{O}(\mathrm{l})\nonumber\]
Крок 2) Врівноважте Н + в кислоті з ОН - в основі. Вони вже збалансовані в вищевказаному рівнянні.
Крок 3) Збалансувати Н 2 О з Н + в кислоті, або з ОН - в основі.
\[\mathrm{H}_{2} \mathrm{SO}_{4}(\mathrm{aq})+\mathrm{Ba}(\mathrm{OH})_{2}(\mathrm{aq}) \rightarrow \mathrm{Salt}(\mathrm{aq})+2 \mathrm{H}_{2} \mathrm{O}(\mathrm{l})\nonumber\]
Крок 4) Напишіть сіль, розчісуючи катіони від основи і аніони з кислоти. Переконайтеся, що заряди збалансовані в солі, щоб зробити її нейтральною речовиною.
\[\mathrm{H}_{2} \mathrm{SO}_{4}(\mathrm{aq})+\mathrm{Ba}(\mathrm{OH})_{2}(\mathrm{aq}) \rightarrow \mathrm{BaSO}_{4}(\mathrm{aq})+2 \mathrm{H}_{2} \mathrm{O}(\mathrm{l})\nonumber\]
антациди
Шлунок іноді виробляє надлишок HCl, що може викликати печію.
Антациди - це речовини, що використовуються для нейтралізації надлишку HCl в шлунку.

На рис. 6.7.3 показані таблетки антациду. Антациди включають основи Arrhenius з дуже низькою розчинністю у воді, як Al (OH) 3 і Mg (OH) 2, або слабкі основи, такі як CaCo 2, і NaHCO 3., які реагують з кислотою і нейтралізують:
\ [\ почати {вирівняний}
&\ mathrm {Al} (\ mathrm {OH}) _ {3} (\ mathrm {~s}) +3\ mathrm {HCl} (\ mathrm {aq})\ стрілка вправо\ mathrm {AlCl} _ {3} (\ mathrm {aq}) +3\ mathrm {H} _ {2} математика {O} (\ mathrm {l})\\
&\ mathrm {Mg} (\ mathrm {OH}) _ {2} (\ математика {~ s}) +2\ mathrm {HCl} (\ mathrm {aq})\ стрілка вправо\ математика {mGCl} _ {2} ( \ mathrm {q}) +2\ математика {H} _ {2}\ математика {O} (\ mathrm {l})\\
&\ математика {CaCo} _ {3} (\ матрм {~s}) +2\ mathrm {HCl} (\ mathrm {aq})\ стрілка вправо\ mathrm {CaCl} {2} (\ математика {q}) +\ математика {H} _ {2}\ математика {O} (\ математика {I}) +\ математика {CO} _ {2} (\ математика {~g})\\
&\ математика {NaHCO} _ {3} (\ математика {~s}) +\ mathrm {HCl} (\ математика {q})\ стрілка вправо\ математика {NaCl} (\ mathrm {aq}) +\ mathrm {H} _ {2}\ mathrm {O} (\ mathrm {I}) +\ mathrm {CO} _ {2} (g)
\ кінець {вирівняний}\ nonumber\]
Побічні ефекти антацидів
Антациди мають побічні ефекти, наприклад, алюміній та кальцій, що містять антациди, можуть викликати запор. Магнійсодержащие антациди мають послаблюючу дію. Деякі склади використовують суміш алюмінію і магнійсодержащих антацидів для скасування побічної дії один одного. Кальцій, що містить антацид, не рекомендується особам, які схильні до розвитку каменів у нирках, оскільки нирковий камінь зазвичай є сіллю кальцію. Натрій, що містять антациди, можуть підвищувати рівень натрію в рідині організму і підвищувати рН крові.
Кислотно-лужне титрування
Кислотно-лужне титрування - це аналітичний процес визначення концентрації кислоти, званої аналітом, шляхом нейтралізації її основою відомої концентрації, званої стандартною, або навпаки.
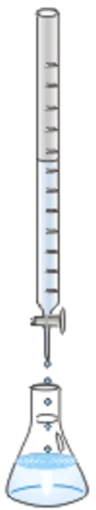
Зазвичай основа знаходиться в бюретці і додається по краплях до відомого обсягу кислоти в колбі Ерленмейера, як показано на рис. 6.7.4. Кілька крапель кислотно-лужного показника змішують з кислотою. Індикатор змінює колір при певному вузькому діапазоні рН.
- Точка, коли стехіометричне кількість основи було додано до кислоти, називається точкою еквівалентності.
- Точка, коли індикатор змінює колір, є кінцевою точкою.
Зазвичай точка еквівалентності майже така ж, як і кінцева точка.


Етапи розрахунку після титрування зазвичай такі.
- Кількість, в молі, стандарту розраховується шляхом множення кількості в літрах на молярність стандарту.
- Потім кількість аналіту в молі обчислюється за допомогою коефіцієнта перетворення моль в моль із збалансованого хімічного рівняння реакції.
- Нарешті, молярність аналіта розраховується шляхом ділення молів на обсяг в літрах аналіта.
Яка молярність розчину HCl, якщо для титрування 50,0 мл розчину HCl потрібно 42,0 мл 0,123 М розчину NaOH?
Рішення
Крок 1) Дано:\[[\mathrm{NaOH}]=0.123 \mathrm{~M}=\frac{0.123 \operatorname{~mol} ~N a O H}{1 \mathrm{~NaOH}}\nonumber\]
\[\text{Volume of standard}=42.0 \mathrm{~mL} .=42.0 \mathrm{~mL} \mathrm{~NaOH} \times \frac{1 \mathrm{~L~NaOH}}{1000 \mathrm{~mL} \mathrm{~NaOH}}=0.0420 ~L \mathrm{~NaOH}\nonumber\]
\[\text{Vol. analyte}=50.0 \mathrm{~mL}=50.0 \mathrm{~mL} \mathrm{~HCl} \times \frac{1 \mathrm{~L~HCl}}{1000 \mathrm{~mL} \mathrm{~HCl}}=0.0500 \mathrm{~L~HCl}\nonumber\]
Крок 2) Розрахуйте родимки стандарту з обсягу і продукту молярності.
\ begin {рівняння}
\ текст {Молі}\ математика {~NaOH}\ текст {~споживається} =0.0420\ математика {~L}\ mathrm {~NaOH}\ час\ frac {0,123\ матрм {~моль}\ mathrm {~NaOH}} {1\ mathrm {~NaOH} =0.00517\ матрм {~mol} {}\ mathrm {~NaOH}\ число
\ кінець {рівняння}
Крок 3) Напишіть збалансоване хімічне рівняння реакції.
\ begin {рівняння}
\ математика {HCl} (\ mathrm {aq}) +\ математика {NaOH} (\ mathrm {aq})\ стрілка вправо\ mathrm {NaCl} (\ mathrm {q}) +\ математика {H} _ {2}\ mathrm {O} (\ mathrm {l})\ nonumber\
\ end {рівняння}
Крок 4) запишіть коефіцієнт перетворення моля стандарту в моль розрахунку аналіту з рівняння.
\ begin {рівняння}
\ розрив {1\ текст {моль}\ mathrm {~HCl}} {1\ mathrm {~mol}\ mathrm {~NaOH}}\ nonumber
\ end {рівняння}
Крок 5) Обчисліть молі аналіта шляхом множення молів стандарту і коефіцієнта переведення.
\ begin {рівняння}
0,00517\ математика {~моль}\ матрм {~NaOH}\ раз\ фрейк {1\ mathrm {~mol}\ mathrm {~HCl}} {1\ mathrm {~NaOH}} =0.00517\ mathrm {~mol} {}\ mathrm {~HCl} nonumber
\ end {рівняння}
Крок 6) Обчисліть молярність аналіта шляхом ділення родимок з об'ємом в літрах аналіта.
\ begin {рівняння}
0,00517\ математика {~моль}\ матрм {~NaOH}\ раз\ фрейк {1\ mathrm {~mol}\ mathrm {~HCl}} {1\ mathrm {~NaOH}} =0.00517\ mathrm {~mol} {}\ mathrm {~HCl} nonumber
\ end {рівняння}
Після глибокого вивчення кроків розрахунки можна зробити в кілька кроків, як показано нижче.
Розрахунки:\[\quad 42.0 \mathrm{~mL} \mathrm{~NaOH} \times \frac{1 \mathrm{~L} \mathrm{~NaOH}}{1000 \mathrm{~mL} \mathrm{~NaOH}} \times \frac{0.123 \mathrm{~mol} \mathrm{~NaOH}}{1 \mathrm{~L} \mathrm{~NaOH}} \times \frac{1 \mathrm{~mol} \mathrm{~HCl}}{1 \mathrm{~mol} \mathrm{~NaOH}}=0.00517 \mathrm{~mol}{ } \mathrm{~HCl}\nonumber\]
Молярність HCl:\[\quad M=\frac{n(\mathrm{mol})}{V(L)}=\frac{0.00517 \mathrm{~mol} \mathrm{~HCl}}{50.0 \mathrm{~mL} \mathrm{~HCl}} \times \frac{1000 \mathrm{~mL} \mathrm{~HCl}}{1 \mathrm{~L~HCl}}=0.103 \mathrm{~M} { }\mathrm{~HCl}\nonumber\]
Яка молярність розчину H 2 SO 4, якщо 50,0 мл розчину H 2 SO 4 вимагає 32,3 мл 0,201 М розчину NaOH в титруванні?
Рішення
Крок 1) Задано:\ begin {рівняння}
\ почати {вирівняний}
& {[\ mathrm {NaOH}] =0.201\ mathrm {~M} =\ frac {0,201\ mathrm {~mathrm {~NaOH}}\\
&\ текст {Том} =42.0\ математика {~mL} =32.3\ матрм {~мл}\ математика {~NaOH}\ раз\ frac {1\ mathrm {~L }\ математика {~NaOH}} {1000\ математика {~mL}\ математика {~NaOH}} =0.0323\ математика {~NaOH}\\
&\ текст {Vol. аналітик} =50.0\ mathrm {~ml} = 50.0\ mathm {~ML~HCl}\ раз {фрак 1\ mathrm {~L}\ mathrm {~HCl}} {1000\ матрм {~ мл}\ матрм {~HCl}} = 0,0500\ матм {~L}\ mathrm {~HCl}
\ кінець {вирівняний}\ nonumber
\ end {рівняння}
Крок 2) Розрахуйте родимки стандарту з обсягу і продукту молярності.
\ begin {рівняння}
\ текст {Молі}\ математика {~NaOH}\ текст {споживається} =0.0323\ математика {~N}\ mathrm {~NaOH}\ час\ frac {0,201\ mathrm {~mol}\ mathrm {~NaOH}} {1\ mathrm {~NaOH}} 0.00649\ текст {~моль} {~NaOH}\ nonumber
\ кінець {рівняння}
Крок 3) Напишіть збалансоване хімічне рівняння реакції.
\ begin {рівняння}
\ математика {H} _ {2}\ математика {SO} _ {4} (\ математика {aq}) +2\ математика {NaOH} (\ mathrm {aq})\ стрілка вправо\ математика {Na} _ {2}\ математика {SO} _ {4} (\ mathrm {aq}) +2\ mathrm {H} _ {2}\ математика {O} (\ mathrm {l})\ номер
\ кінець {рівняння}
Крок 4) запишіть коефіцієнт перетворення молів стандарту в моль розрахунку аналіту з рівняння.
\ begin {рівняння}
\ розрив {1\ математика {~моль}\ математика {~H} _ {2}\ математика {SO} _ {4}} {2\ mathrm {~mol}\ mathrm {~NaOH}}\ nonumber
\ end {рівняння}
Крок 5) Обчисліть молі аналіта шляхом множення молів стандарту і коефіцієнта переведення.
\ begin {рівняння}
0.00649\ текст {моль}\ mathrm {~NaOH}\ раз\ frac {1\ mathrm {~mol}\ mathrm {~H} _ {2}\ mathrm {~mol}\ mathrm {~NaOH}} =0,00325\ mathrm {~mol} thrm {~H} _ {2} {SO} _ {4}\ номер
\ кінець {рівняння}
Крок 6) Обчисліть молярність аналіта шляхом ділення родимок з об'ємом в літрах аналіта.
\ begin {рівняння}
\ текст {Концентрація}\ математика {~H} _ {2}\ математика {SO} _ {4} =\ розриву {0,00325\ матрм {~моль}\ математика {~H} _ {2}\ математика {SO} _ {4}} {0,0500\ mathrm {~L}\ mathrm {~H} {_ 2}\ математика {SO} _ {4}} =0.0649\ математика {~M} {~H_ {2}} SO_ {4}\ число
\ кінець {рівняння}
Той же розрахунок в зведеному вигляді йде в наступному.
\[\text {Concentration of} \mathrm{~H}_{2} \mathrm{SO}_{4}=\frac{0.00325 \mathrm{~mol} \mathrm{~H}_{2} \mathrm{SO}_{4}}{0.0500 \mathrm{~L~H}_{2} \mathrm{SO}_{4}}=0.0649 \mathrm{~M} \mathrm{~H}_{2} \mathrm{SO}_{4}\nonumber\]
\[\text{Moles of} \mathrm{~H}_{2} \mathrm{SO}_{4} =\quad 32.3 \mathrm{~mL} \mathrm{~NaOH} \times \frac{1 \mathrm{~L} \mathrm{~NaOH}}{1000 \mathrm{~mL} \mathrm{~NaOH}} \times \frac{0.201 \mathrm{~mol} \mathrm{~NaOH}}{1 \mathrm{~L} \mathrm{~NaOH}} \times \frac{1 \mathrm{~mol} \mathrm{~H}_{2} \mathrm{SO}_{4}}{2 \mathrm{~mol} \mathrm{~NaOH}}=0.00326 \mathrm{~mol} \mathrm{} \mathrm{~H}_{2} \mathrm{SO}_{4}\nonumber\]
\[\text{Molarity of} \mathrm{~H}_{2} \mathrm{SO}_{4}: \quad M=\frac{n(\mathrm{~mol})}{V(L)}=\frac{0.00326 \mathrm{~mol} \mathrm{~H}_{2} \mathrm{SO}_{4}}{50.0 \mathrm{~mL} \mathrm{~H}_{2} \mathrm{SO}_{4}} \times \frac{1000 \mathrm{~mL} \mathrm{~H}_{2} \mathrm{SO}_{4}}{1 \mathrm{~L~H}_{2} \mathrm{SO}_{4}}=0.0649 \mathrm{~M} \mathrm{~H}_{2} \mathrm{SO}_{4}\nonumber\]
