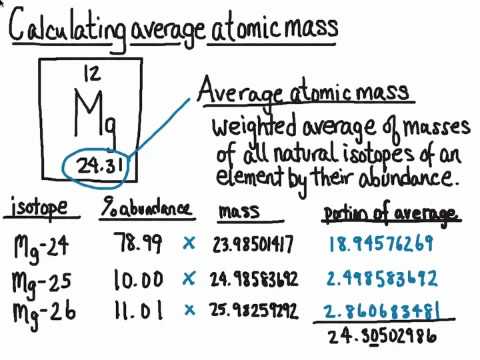
4.20: Розрахунок середньої атомної маси
Ви коли-небудь намагалися зрушити валун?
У вас є купа каменів для переміщення і потрібно вирішити, яке обладнання ви хочете орендувати, щоб перемістити їх. Якщо породи досить дрібні, можна дістати лопатою, щоб їх забрати. Більші породи можна було переміщати вручну, але великі валуни потребуватимуть якогось механічного совка. Кількість кожного виду породи також визначатиме, скільки часу вам знадобиться, щоб виконати роботу. Знання відносної кількості великих, середніх та малих порід може бути дуже корисним у вирішенні питання, як підійти до роботи.
Відсоток природного достатку
Більшість елементів відбуваються природним шляхом у вигляді суміші двох або більше ізотопів. У таблиці нижче показані природні ізотопи декількох елементів разом з відсотковим природним достатком кожного.
| Елемент | Ізотоп (символ) | Відсоток природного достатку | Атомна маса(amu) | Середня атомна маса(amu) |
|---|---|---|---|---|
| Водень | H11 | 99.985 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">1.0078 | \ (\ left (\ text {amu}\ праворуч)\)» rowspan = "3" style="вертикальне вирівнювання: середина; ">1.0080 |
| H21 | 0,015 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">2.0141 | ||
| H31 | незначний | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">3.0160 | ||
| Вуглець | C126 | 98.89 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">12.000 | \ (\ left (\ text {amu}\ праворуч)\)» rowspan = "3" style="вертикальне вирівнювання: середина; ">12.011 |
| C136 | 1.11 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">13.003 | ||
| C146 | слід | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">14.003 | ||
| Кисень | O168 | 99.759 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">15.995 | \ (\ left (\ text {amu}\ праворуч)\)» rowspan = "3" style="вертикальне вирівнювання: середина; "> 15.999 |
| O178 | 0.037 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">16.995 | ||
| O188 | 0,204 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">17.999 | ||
| хлор | Cl3517 | 75.77 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">34.969 | \ (\ left (\ text {amu}\ праворуч)\)» rowspan = "2" style="вертикальне вирівнювання: середина; ">35.453 |
| Cl3717 | 24.23 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">36.966 | ||
| Мідь | Cu6329 | 69.17 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">62.930 | \ (\ left (\ text {amu}\ праворуч)\)» rowspan = "2" style="вертикальне вирівнювання: середина; "> 63.546 |
| Cu6529 | 30.83 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">64.928 |
Для деяких елементів один особливий ізотоп сильно переважає над іншими ізотопами. Природний водень - це майже весь воден-1, а природний кисень - майже весь кисень-16. Для багатьох інших елементів, однак, більше одного ізотопу може існувати в більш значних кількостях. Хлор (атомний номер 17) - жовтувато-зелений токсичний газ. Близько трьох чвертей усіх атомів хлору мають 18 нейтронів, що дає цим атомам масове число 35. Близько чверті всіх атомів хлору мають 20 нейтронів, що дає цим атомам масове число 37. Якби ви просто обчислили середнє арифметичне точних атомних мас, ви б отримали 36.
(34.969+36.966)2=35.968amu
Очевидно, що фактична середня атомна маса з останнього стовпця таблиці значно нижче. Чому? Потрібно враховувати відсоток природного достатку кожного ізотопу, щоб розрахувати середньозважений показник. Атомна маса елемента - це середньозважене значення атомних мас природних ізотопів цього елемента. Зразок задачі нижче демонструє, як розрахувати атомну масу хлору.
Приклад4.20.1
Використовуйте атомні маси кожного з двох ізотопів хлору разом з їх відповідною відсотковою кількістю для розрахунку середньої атомної маси хлору.
Рішення
Крок 1: Перерахуйте відомі та невідомі величини та плануйте проблему.
Відомий
- Хлор-35: атомна маса=34.969amu і відсоток достатку=75.77%
- Хлор-37: атомна маса=36.966amu і відсоток достатку=24.23%
Невідомий
- Середня атомна маса хлору
Змініть кожен відсоток достатку в десятковій формі, розділивши на 100. Помножте це значення на атомну масу цього ізотопу. Складіть разом для кожного ізотопу, щоб отримати середню атомну масу.
Крок 2: Розрахуйте.
chlorine-350.7577×34.969=26.50amuchlorine-370.2423×36.966=8.957amuaverage atomic mass26.50+8.957=35.46amu
Примітка: Застосування значущих правил фігури призводить до35.45amu результату без надмірної помилки округлення. За один крок:
(0.7577×34.969)+(0.2423×36.966)=35.46amu
Крок 3: Подумайте про свій результат.
Розрахункова середня атомна маса ближче до 35, ніж до 37, оскільки більший відсоток природних атомів хлору має масове число 35. Згоден зі значенням з таблиці вище.
Резюме
- Атомна маса елемента - це середньозважене значення атомних мас природних ізотопів цього елемента.
- Розрахунки атомної маси використовують відсоток достатку кожного ізотопу.
Рецензія
- Визначте атомну масу.
- Яка інформація потрібна для обчислення атомної маси для елемента?
- Розрахуйте атомну масу для вуглецю, використовуючи дані, наведені в таблиці нижче.
|
Ізотоп |
Атомна маса |
Відсоток достатку |
|---|---|---|
|
вуглець-12 |
12.000000 |
98.90 |
|
вуглець-13 |
13.00355 |
1.100 |