4.14: Експеримент із золотою фольгою
Скільки місця займає цегла?
Коли ми дивимося на навколишній світ, він виглядає досить солідно. Ми вдаряємося рукою об стіну, і рука зупиняється — вона (нормально) не проходить крізь стіну. Ми вважаємо матерію займаною простором. Але в матерії багато порожнього місця. По суті, велика частина справи - порожній простір.
Експеримент із золотою фольгою
У 1911 році Резерфорд і колеги Ганс Гейгер і Ернест Марсден ініціювали серію новаторських експериментів, які повністю змінили б прийняту модель атома. Вони бомбардували дуже тонкі листи золотої фольги швидко рухаються альфа-частинками. Альфа-частинки, тип природних радіоактивних частинок, є позитивно зарядженими частинками з масою приблизно в чотири рази більше, ніж атома водню.
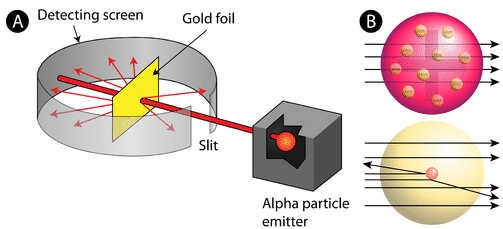
Відповідно до прийнятої атомної моделі - в якій маса і заряд атома рівномірно розподілені по атому - вчені висунули гіпотезу, що всі альфа-частинки пройдуть крізь золоту фольгу лише з невеликим відхиленням або взагалі відсутніми. Дивно, але хоча більшість альфа-частинок дійсно не відхилялися, дуже малий відсоток (близько 1 з 8000 частинок) відскочив від золотої фольги під дуже великими кутами. Деякі були навіть перенаправлені назад до джерела. Ніякі попередні знання не підготували їх до цього відкриття. У відомій цитаті Резерфорд вигукнув, що це «так, ніби ви випустили 15-дюймовий [артилерійський] снаряд по шматочку тканини, і він повернувся і вдарив вас».
Резерфорду потрібно було придумати абсолютно нову модель атома, щоб пояснити його результати. Оскільки переважна більшість альфа-частинок пройшла крізь золото, він міркував, що більша частина атома була порожнім простором. На відміну від цього, частинки, які були сильно відхилені, повинні випробувати надзвичайно потужну силу всередині атома. Він зробив висновок, що весь позитивний заряд і більша частина маси атома повинні бути зосереджені в дуже маленькому просторі в надрах атома, яке він назвав ядром. Ядро є крихітним, щільним центральним ядром атома і складається з протонів і нейтронів.
Атомна модель Резерфорда стала називатися ядерною моделлю. У ядерному атомі протони і нейтрони, які складають майже всю масу атома, розташовані в ядрі в центрі атома. Електрони розподіляються навколо ядра і займають більшу частину обсягу атома. Варто підкреслити саме те, наскільки маленьке ядро порівнюється з іншим атомом. Якби ми могли підірвати атом розміром з великий професійний футбольний стадіон, ядро було б розміром приблизно з мармур.
Модель Резерфорда виявилася важливим кроком до повного розуміння атома. Однак він не повністю розглядав природу електронів і спосіб, яким вони займали величезний простір навколо ядра. Лише через кілька років було досягнуто повного розуміння електрона. Це виявилося ключем до розуміння хімічних властивостей елементів.
Резюме
- Бомбардування золотої фольги альфа-частинками показало, що дуже малий відсоток альфа-частинок відхилявся.
- Ядерна модель атома складається з невеликого і щільного позитивно зарядженого інтер'єру, оточеного хмарою електронів.
Рецензія
- Що таке альфа-частинка?
- Що спостерігав Резерфорд, знімаючи тисячі і тисячі альфа-частинок на тонкому шматку золотої фольги?
- Як Резерфорд пояснив спостереження, що більшість альфа-частинок пройшли прямо через золоту фольгу?
- Що він сказав про частинки, які були відхилені?
- Опишіть ядерну модель Резерфорда.
