18.3: Т-лімфоцити
- Page ID
- 3926
Цілі навчання
- Охарактеризуйте процес дозрівання Т-клітин і виділення тимуса
- Поясніть генетичні події, які призводять до різноманітності Т-клітинних рецепторів
- Порівняйте та порівняйте різні класи та підтипи Т-клітин з точки зору активації та функції
- Поясніть механізм, за допомогою якого суперантигени впливають на нерегульовану активацію Т-клітин
Як пояснюється в «Огляд специфічного адаптивного імунітету», антитіла, що беруть участь у гуморальному імунітеті, часто зв'язують патогени та токсини, перш ніж вони зможуть прикріпитися до клітин господаря та вторгну Таким чином, гуморальний імунітет в першу чергу займається боротьбою зі збудниками в позаклітинних просторах. Однак збудники, які вже отримали потрапляння в клітини-хазяїни, значною мірою захищені від захисних сил, опосередкованих гуморальними антитілами. Клітинний імунітет, з іншого боку, націлює і усуває внутрішньоклітинні збудники через дії Т-лімфоцитів або Т-клітин (рис.\(\PageIndex{1}\)). Т-клітини також відіграють більш центральну роль у організації загальної адаптивної імунної відповіді (гуморальної, а також клітинної) разом із клітинним захистом вродженого імунітету.

Виробництво та дозрівання Т-клітин
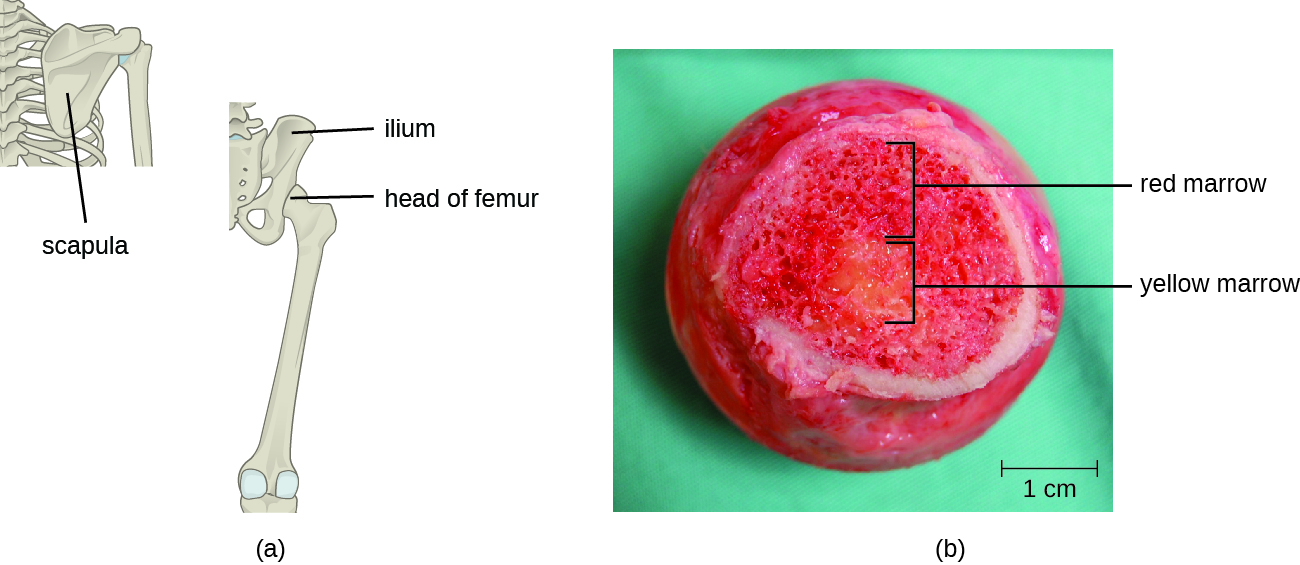
Т-клітини, як і всі інші лейкоцити, що беруть участь у вродженому і адаптаційному імунітеті, утворюються з мультипотентних гемопоетичних стовбурових клітин (ГСК) в кістковому мозку (див. Рис. Однак, на відміну від білих кров'яних тілець вродженого імунітету, можливі Т-клітини диференціюються спочатку на лімфоїдні стовбурові клітини, які потім стають маленькими незрілими лімфоцитами, іноді їх називають лімфобластами. Перші кроки диференціації відбуваються в червоному мозку кісток (рис.\(\PageIndex{2}\)), Після чого незрілі Т-лімфоцити потрапляють в кров і відправляються в тимус для завершальних етапів дозрівання (рис.\(\PageIndex{3}\)). Потрапивши в тимус, незрілі Т-лімфоцити називаються тимоцитами.
Дозрівання тимоцитів всередині тимуса можна розділити на три критичні етапи позитивного і негативного відбору, в сукупності називаються тимусовим виділенням. Перший етап відбору тимуса відбувається в корі вилочкової залози і передбачає вироблення функціонального Т-клітинного рецептора (ТКР), який необхідний для активації АПК. Тимоцити з дефектними TCR видаляються шляхом негативного відбору через індукцію апоптозу (запрограмована контрольована загибель клітин). Другий етап відбору тимуса також відбувається в корі і передбачає позитивний відбір тимоцитів, які будуть відповідним чином взаємодіяти з молекулами MHC. Тимоцити, які можуть належним чином взаємодіяти з молекулами MHC, отримують позитивну стимуляцію, яка рухає їх далі в процесі дозрівання, тоді як тимоцити, які не взаємодіють належним чином, не стимулюються і усуваються апоптозом. Третій і останній етап виділення тимуса відбувається як в корі, так і в мозковому мозку і передбачає негативний відбір для видалення самореагуючих тимоцитів, тих, що реагують на самоантигени, шляхом апоптозу. Цей останній крок іноді називають центральною толерантністю, оскільки він запобігає самореагуючим Т-клітинам у кров і потенційно спричиняє аутоімунне захворювання, яке виникає, коли імунна система атакує здорові клітини «себе».
Незважаючи на центральну толерантність, деякі самореактивні Т-клітини зазвичай виходять із вилочкової залози і потрапляють у периферичний кровотік. Тому для захисту від аутоімунного захворювання потрібна друга лінія захисту під назвою периферична толерантність. Периферична толерантність включає механізми анергії та інгібування самореактивних Т-клітин регуляторними Т-клітинами. Аенергія відноситься до стану нечуйності до антигенної стимуляції. У випадку самореактивних Т-клітин, які виходять з вилочкової залози, відсутність необхідного для активації необхідного для активації основного костимулюючого сигналу викликає енергію та запобігає аутоімунній активації. Регуляторні Т-клітини беруть участь у периферичній толерантності шляхом інгібування активації та функції самореактивних Т-клітин та секретуючи протизапальні цитокіни.
До кінця не зрозуміло, які події конкретно направляють дозрівання тимоцитів в регуляторні Т-клітини. Сучасні теорії припускають, що критичні події можуть відбуватися під час третього етапу відбору тимуса, коли більшість самореактивних Т-клітин усуваються. Регуляторні Т-клітини можуть отримувати унікальний сигнал, який нижче порогу, необхідного для націлювання на них для негативного відбору та апоптозу. Отже, ці клітини продовжують дозрівати, а потім виходити з вилочкової залози, озброївшись пригнічувати активацію самореактивних Т-клітин.
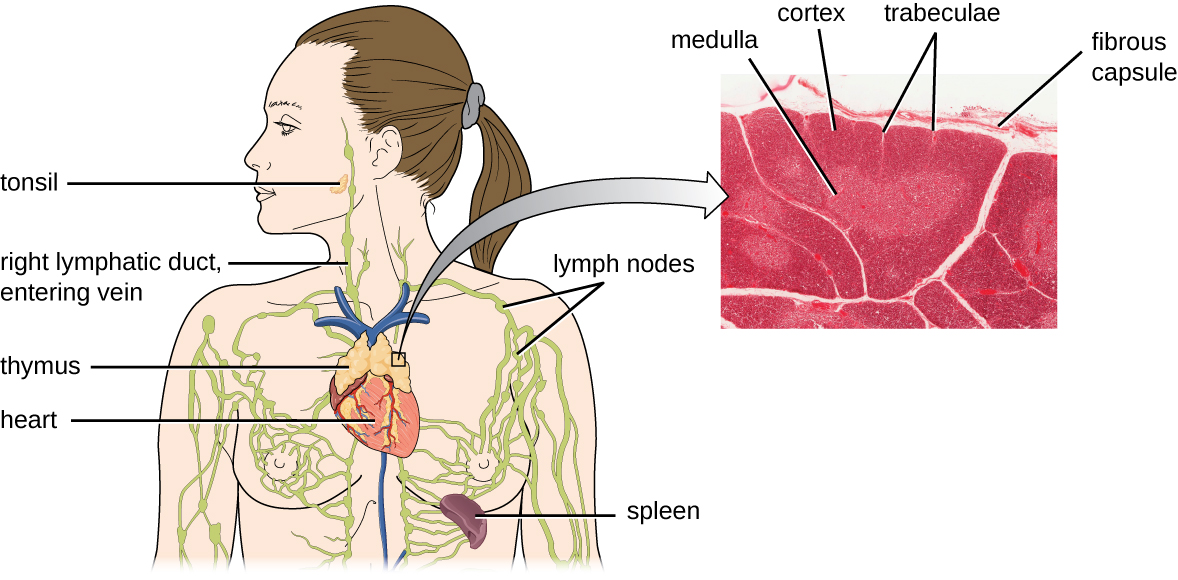
Було підраховано, що три етапи відбору тимуса усувають 98% тимоцитів. Решта 2%, які виходять з тимуса, мігрують через кровотік та лімфатичну систему до ділянок вторинних лімфоїдних органів/тканин, таких як лімфатичні вузли, селезінка та мигдалини (рис.\(\PageIndex{3}\)), де вони чекають активації через представлення специфічних антигенів БТР. Поки вони не активуються, вони відомі як зрілі наївні Т-клітини.
Вправа\(\PageIndex{1}\)
- Які анатомічні ділянки беруть участь у виробництві та дозріванні Т-клітин?
- Які три етапи беруть участь у виділенні тимуса?
- Чому важлива центральна толерантність та периферична толерантність? Що вони заважають?
Класи Т-клітин
Т-клітини можна класифікувати на три різні класи: допоміжні Т-клітини, регуляторні Т-клітини та цитотоксичні Т-клітини. Ці класи диференціюються на основі експресії певних поверхневих молекул, способу їх активації та їх функціональних ролей в адаптивному імунітеті (табл.\(\PageIndex{1}\)).
Всі Т-клітини виробляють скупчення молекул диференціації (CD), глікопротеїни поверхні клітин, які можуть бути використані для ідентифікації та розрізнення різних типів лейкоцитів. Хоча Т-клітини можуть виробляти різноманітні молекули CD, CD4 та CD8 є двома найважливішими, що використовуються для диференціації класів. Гелперні Т-клітини і регуляторні Т-клітини характеризуються експресією CD4 на їх поверхні, тоді як цитотоксичні Т-клітини характеризуються експресією CD8.
Класи Т-клітин також можна виділити за специфічними молекулами MHC і БТР, з якими вони взаємодіють для активації. Гелперні Т-клітини та регуляторні Т-клітини можуть бути активовані лише БТР, що представляють антигени, пов'язані з MHC II. На відміну від цього, цитотоксичні Т-клітини розпізнають антигени, представлені у зв'язку з MHC I, або БТР, або ядерними клітинами, інфікованими внутрішньоклітинним збудником.
Різні класи Т-клітин також відіграють різні функціональні ролі в імунній системі. Helper Т-клітини служать в якості центральних оркестраторів, які допомагають активізувати і направляти функції гуморального і клітинного імунітету. Крім того, хелперні Т-клітини підсилюють збудникові функції макрофагів і NK-клітин вродженого імунітету. Навпаки, основна роль регуляторних Т-клітин полягає у запобіганні небажаним та потенційно шкідливим імунним реакціям. Їх роль в периферичної толерантності, наприклад, захищає від аутоімунних порушень, про що говорилося раніше. Нарешті, цитотоксичні Т-клітини є первинними ефекторними клітинами для клітинного імунітету. Вони розпізнають і клітини-мішені, які були заражені внутрішньоклітинними збудниками, знищуючи інфіковані клітини разом із збудниками всередині.
| Клас | Поверхневі молекули CD | Активація | Функції |
|---|---|---|---|
| Т-клітини-помічники | CD4 | БТР, що представляють антигени, пов'язані з MHC II | Оркеструвати гуморальний і клітинний імунітет |
| Бере участь в активації макрофагів і NK-клітин | |||
| Регуляторні Т-клітини | CD4 | БТР, що представляють антигени, пов'язані з MHC II | Займається периферичною толерантністю та профілактикою аутоімунних |
| Цитотоксичні Т-клітини | CD8 | БТР або інфіковані ядерні клітини, що представляють антигени, пов'язані з MHC I | Знищують клітини, заражені внутрішньоклітинними збудниками |
Вправа\(\PageIndex{2}\)
- Які унікальні функції трьох класів Т-клітин?
- Які Т-клітини можуть бути активовані антигенами, представленими клітинами, відмінними від БТР?
Т-клітинні рецептори
Як для хелперних Т-клітин, так і для цитотоксичних Т-клітин активація - це складний процес, який вимагає взаємодії декількох молекул і впливу цитокінів. Т-клітинний рецептор (TCR) бере участь у першому етапі розпізнавання епітопу збудника в процесі активації.
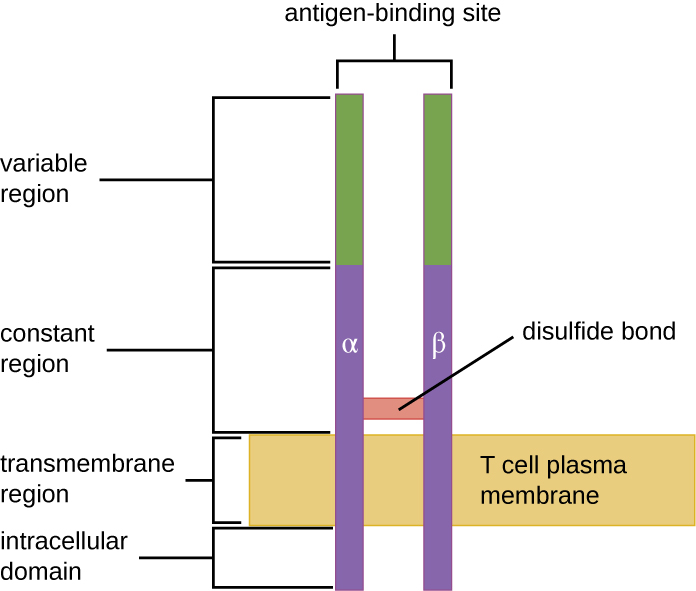
TCR походить з того ж сімейства рецепторів, що і антитіла IgD та IgM, рецептори антигену на поверхні мембрани В-клітин, і, таким чином, поділяє загальні структурні елементи. Подібно до антитіл, ТКР має змінну областьі постійну область, а змінна область забезпечує антигензв'язуючий ділянку (рис.\(\PageIndex{4}\)). Однак структура ТКР менше і менш складна, ніж молекули імуноглобуліну (рис. 18.1.4). Тоді як імуноглобуліни мають чотири пептидні ланцюга і Y-подібні структури, TCR складається всього з двох пептидних ланцюгів (α і β ланцюгів), обидва з яких охоплюють цитоплазматичну мембрану Т-клітини.
TCR є специфічними для епітопу, і було підраховано, що 25 мільйонів Т-клітин з унікальними епітоп-зв'язуючими TCR потрібні для захисту людини від широкого спектру мікробних патогенів. Оскільки геном людини містить лише близько 25 000 генів, ми знаємо, що кожен конкретний TCR не може бути закодований власним набором генів. Це ставить питання про те, як може бути досягнута така величезна популяція Т-клітин з мільйонами специфічних TCR. Відповіддю є процес, який називається генетичною перебудовою, який відбувається в тимусі під час першого етапу виділення тимуса.
Гени, які кодують змінні області TCR, поділяються на різні сегменти генів, які називаються змінними (V), різноманітними (D) та приєднуються (J) сегментами. Сегменти генів, пов'язані з α ланцюгом ТКР, складаються з 70 і більше різних V α сегментів і 61 різних J α сегментів. Сегменти генів, пов'язані з β ланцюгом TCR, складаються з 52 різних V β сегментів, двох різних D β сегментів і 13 різних J β сегментів. Під час розвитку функціонального TCR в тимусі генетична перебудова в Т-клітці об'єднує один V α сегмент і один J α сегмент в код для змінної області α ланцюга. Аналогічно генетична перебудова призводить один із V β сегментів разом з одним із D β сегментів та одним із сегментів TJ β до коду змінної області β ланцюга. Усі можливі комбінації перестановок між різними сегментами V, D та J забезпечують генетичне різноманіття, необхідне для отримання мільйонів TCR з унікальними епітопе-специфічними змінними регіонами.
Вправа\(\PageIndex{3}\)
- Які подібності та відмінності між TCR та імуноглобулінами?
- Який процес використовується для надання мільйонів унікальних сайтів TCR прив'язки?
Активація та диференціація хелперних Т-клітин
Т-клітини Helper можуть бути активовані лише БТР, що представляють оброблені іноземні епітопи у зв'язку з MHC II. Першим кроком у процесі активації є розпізнавання TCR специфічного іноземного епітопу, представленого в антигензв'язуючій щілині MHC II. Другий етап передбачає взаємодію CD4 на хелперної Т-клітині з областю молекули MHC II, відокремленої від антигензв'язуючої щілини. Ця друга взаємодія закріплює комплекс MHC II-TCR і гарантує, що допоміжна Т-клітина розпізнає як чужорідний («не сам») епітоп, так і «себе» антиген APC; обидва розпізнавання потрібні для активації клітини. На третьому етапі APC і Т-клітини виділяють цитокіни, які активують Т-клітину хелпера. Активована допоміжна Т-клітина потім проліферує, діляючись мітозом для отримання клональних наївних помічників Т-клітин, які диференціюються на підтипи з різними функціями (рис.\(\PageIndex{5}\)).
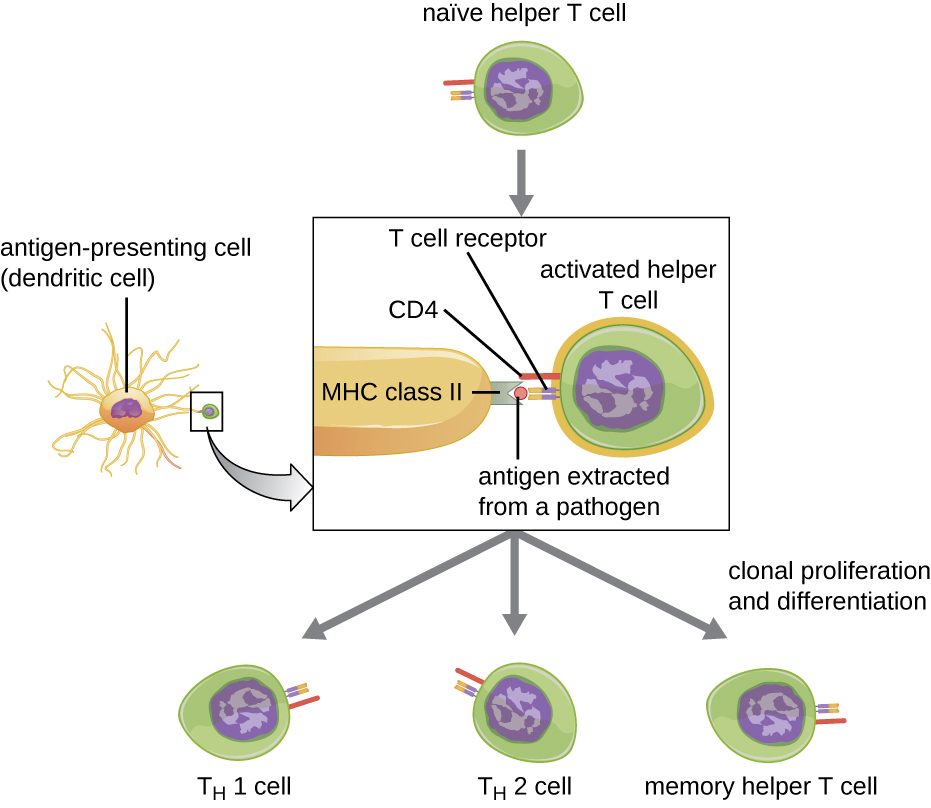
Активовані помічники Т-клітини можуть диференціюватися на один з чотирьох різних підтипів, зведені в табл\(\PageIndex{2}\). Процес диференціювання спрямований АЦ-секретовані цитокіни. Залежно від того, які цитокіни, секретовані APC, взаємодіють з активованою Т-клітиною помічника, клітина може диференціюватися на Т-хелпер 1 (T H 1) клітину, клітину Т-хелпера 2 (T H 2) або Т-клітинку помічника пам'яті. Два типи допоміжних Т-клітин є відносно короткочасними ефекторними клітинами, що означає, що вони виконують різні функції негайної імунної відповіді. На відміну від цього, Т-клітини помічників пам'яті відносно довго живуть; вони запрограмовані на «запам'ятовування» конкретного антигену або епітопу, щоб встановити швидку, сильну, вторинну реакцію на подальші впливи.
Клітини T H 1 виділяють власні цитокіни, які беруть участь у стимуляції та оркестрації інших клітин, що беруть участь в адаптаційному і вродженому імунітеті. Наприклад, вони стимулюють цитотоксичні Т-клітини, посилюючи їх вбивство інфікованих клітин і сприяючи диференціації в пам'яті цитотоксичні Т-клітини. Клітини T H 1 також стимулюють макрофаги та нейтрофіли, щоб вони стали більш ефективними у знищенні внутрішньоклітинних бактерій. Вони також можуть стимулювати NK-клітини, щоб вони стали більш ефективними при знищенні клітин-мішеней.
Клітини T H 2 відіграють важливу роль у організації гуморальної імунної відповіді через їх секрецію цитокінів, які активують В-клітини та пряму диференціацію В-клітин та вироблення антитіл. Різні цитокіни, що виробляються клітинами T H 2, оркеструють перемикання класу антитіл, що дозволяє В-клітинам перемикатися між виробництвом IgM, IgG, IgA та IgE, якщо це необхідно для виконання специфічних функцій антитіл та забезпечення гуморальних імунних реакцій, специфічних для патогенів.
Третій підтип Т-клітин хелперів під назвою клітини T H 17 був виявлений за допомогою спостережень, що імунітет до деяких інфекцій не пов'язаний з клітинами T H 1 або T H 2. Клітини T H 17 та цитокіни, які вони виробляють, виявляються спеціально відповідальними за захист організму від хронічних слизово-шкірних інфекцій. Пацієнти, які не мають достатньої кількості клітин T H 17 у слизовій оболонці (наприклад, хворі на ВІЛ), можуть бути більш сприйнятливі до бактеріємії та шлунково-кишкових інфекцій. 1
| Підтип | Функції |
|---|---|
| Т Н 1 клітина | Стимулюють цитотоксичні Т-клітини та виробляють цитотоксичні Т-клітини пам'яті |
| Стимулювати макрофаги і нейтрофіли (ПМН) для більш ефективного внутрішньоклітинного знищення патогенів | |
| Стимулюйте клітини NK, щоб вбивати ефективніше | |
| T H 2 клітини | Стимулювати активацію та диференціювання В-клітин у плазматичні клітини та В-клітини пам'яті |
| Пряме перемикання класу антитіл в В-клітині | |
| Т Н 17 клітин | Стимулювати імунітет до специфічних інфекцій, таких як хронічні слизово-шкірні інфекції |
| Т-клітини помічника пам'яті | «Запам'ятати» конкретний збудник і встановити сильну, швидку вторинну реакцію при повторному впливі |
Активація та диференціація цитотоксичних Т-клітин
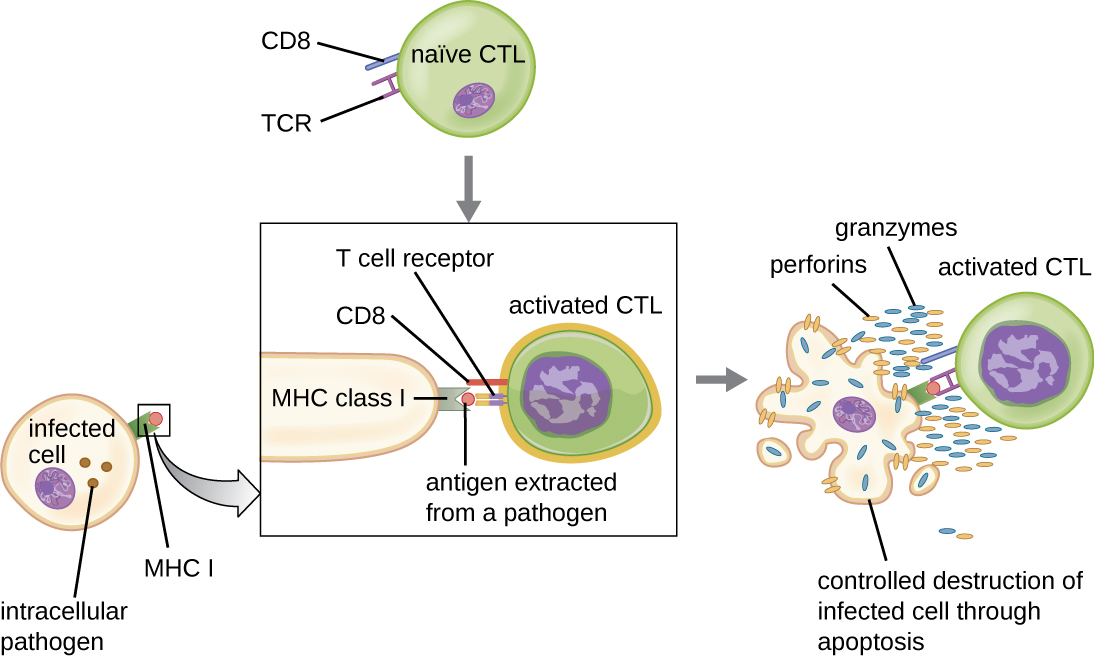
Цитотоксичні Т-клітини (також називаються цитотоксичними Т-лімфоцитами або CTL) активуються БТР у триступеневому процесі, подібному до процесу помічника Т-клітин. Ключова відмінність полягає в тому, що активація цитотоксичних Т-клітин передбачає розпізнавання антигену, представленого MHC I (на відміну від MHC II) і взаємодії CD8 (на відміну від CD4) з рецепторним комплексом. Після успішного спільного розпізнавання чужорідного епітопу та самоантигену вироблення цитокінів APC та цитотоксичної Т-клітиною активізують клональну проліферацію та диференціювання. Активовані цитотоксичні Т-клітини можуть диференціюватися в ефекторні цитотоксичні Т-клітини, які націлені на патогени для руйнування або клітини пам'яті, готові реагувати на подальше опромінення.
Як зазначалося, проліферація і диференціація цитотоксичних Т-клітин стимулюється також цитокінами, що виділяються з Т-Н 1 клітин, активованих тим же чужорідним епітопом. Костимуляція, яка виходить з цих Т-Н 1 клітин, забезпечується секретованими цитокінами. Хоча активація цитотоксичних Т-клітин можлива без стимуляції клітин T H 1, активація не є такою ефективною або тривалою.
Після активації цитотоксичні Т-клітини служать ефекторними клітинами клітинного імунітету, розпізнаючи та вбиваючи клітини, інфіковані внутрішньоклітинними патогенами, за механізмом, дуже схожим на механізм NK-клітин. Однак, тоді як NK-клітини розпізнають неспецифічні сигнали клітинного стресу або аномалії, цитотоксичні Т-клітини розпізнають інфіковані клітини за допомогою антигенної презентації патоген-специфічних епітопів, пов'язаних з MHC I. Після того, як інфікована клітина розпізнана, TCR цитотоксичної Т-клітини зв'язується з епітопом і вивільняє перфорин і гранзими, що руйнують заражену клітину (рис.\(\PageIndex{6}\)). Перфорин - це білок, який створює пори в клітині-мішені, а гранзими - протеази, які потрапляють в пори і викликають апоптоз. Цей механізм запрограмованої загибелі клітин є контрольованим та ефективним засобом знищення та видалення інфікованих клітин без вивільнення збудників всередині для зараження сусідніх клітин, як це може статися, якщо заражені клітини були просто лізовані.
У цьому відео ви можете побачити цитотоксичну Т-клітину, що індукує апоптоз в клітині-мішені.
Вправа\(\PageIndex{4}\)
- Порівняйте і порівняйте активацію хелперних Т-клітин і цитотоксичних Т-клітин.
- Які різні функції підтипів помічників Т-клітин?
- Який механізм CTL-опосередкованого руйнування інфікованих клітин?
Суперантигени та нерегульована активація Т-клітин
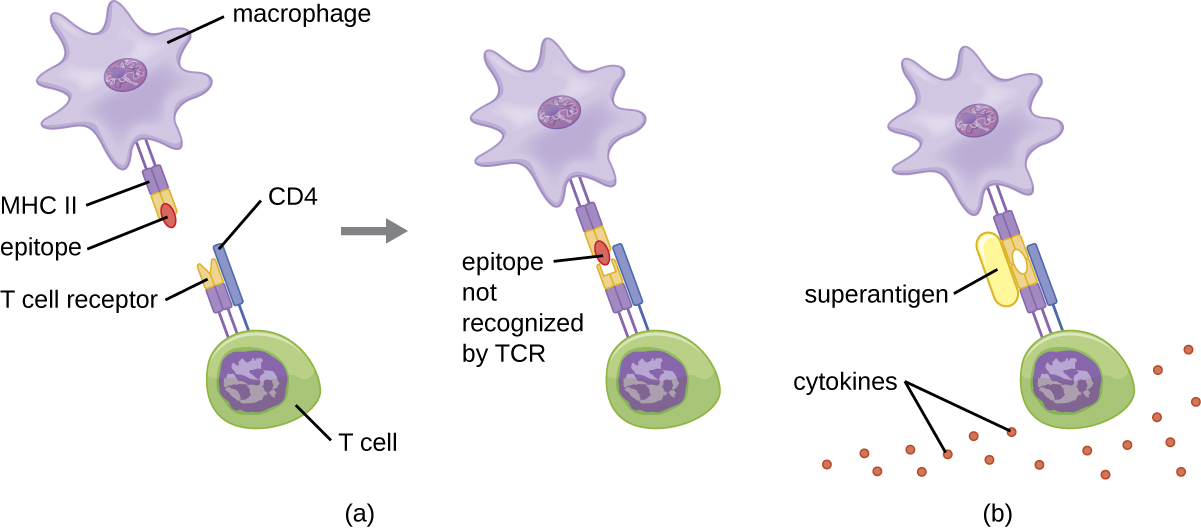
Коли активація Т-клітин контролюється і регулюється, результатом є захисна реакція, яка ефективна в боротьбі з інфекціями. Однак, якщо активація Т-клітин нерегульована і надмірна, результат може бути небезпечним для життя. Деякі бактеріальні та вірусні збудники виробляють токсини, відомі як суперантигени (див. Фактори вірулентності бактеріальних та вірусних патогенів), які можуть викликати таку нерегульовану відповідь. Відомі бактеріальні суперантигени включають токсин синдрому токсичного шоку (TSST), стафілококові ентеротоксини, стрептококові пірогенні токсини, стрептококовий суперантиген та стрептококовий мітогенний екзотоксин. Віруси, які, як відомо, продукують суперантигени, включають вірус Епштейна-Барр (вірус герпесу людини 4), цитомегаловірус (вірус герпесу людини 5) та інші.
Механізм активації Т-клітин суперантигенами передбачає їх одночасне зв'язування з молекулами MHC II БТР і змінною областю TCR β ланцюга. Це зв'язування відбувається поза антигензв'язуючої щілини MHC II, тому суперантиген буде мосту разом і активувати MHC II і TCR без специфічного чужорідного розпізнавання епітопу (рис.\(\PageIndex{7}\)). Результатом є надмірне, неконтрольоване вивільнення цитокінів, часто званих цитокіновим штормом, що стимулює надмірну запальну реакцію. Це може призвести до небезпечного зниження артеріального тиску, шоку, поліорганної недостатності, а потенційно, смерті.
Вправа\(\PageIndex{5}\)
- Які приклади суперантигенів?
- Як суперантиген активує Т-клітину хелпера?
- Яку дію надає суперантиген на Т-клітину?
Справа в точці: Суперантигени
Мелісу, інакше здорову 22-річну жінку, доставляє до відділення невідкладної допомоги її стурбований хлопець. Вона скаржиться на раптовий початок високої температури, блювоту, діарею і м'язові болі. У своєму початковому інтерв'ю вона розповідає лікуючому лікареві, що вона перебуває на гормональному контролі народжуваності, а також через два дні в менструаційній частині її циклу. Вона не приймає ніяких інших ліків і не зловживає будь-якими наркотиками або алкоголем. Вона не курець. Вона не є діабетиком і в даний час не має інфекції будь-якого роду, наскільки їй відомо.
Під час очікування в травмпункті у Меліси починає різко знижуватися артеріальний тиск і її психічний стан погіршується до загальної плутанини. Лікар вважає, що вона, ймовірно, страждає синдромом токсичного шоку (ТСС). TSS викликається токсином TSST-1, суперантигеном, пов'язаним із золотистим стафілококом, а неправильне використання тампонів є частою причиною інфекцій, що призводять до TSS. Суперантиген неналежним чином стимулює поширену активацію Т-клітин та надмірне вивільнення цитокінів, що призводить до масивної та системної запальної реакції, яка може призвести до летального результату.
Вагінальні або цервікальні мазки можуть бути взяті для підтвердження наявності мікроба, але ці тести не є критичними для виконання на основі симптомів Меліси та історії хвороби. Лікар призначає регідратацію, підтримуючу терапію та антибіотики, щоб зупинити бактеріальну інфекцію. Вона ж призначає препарати для підвищення артеріального тиску Меліси. Меліса проводить три дні в лікарні, проходячи лікування; крім того, її функція нирок контролюється через високий ризик ниркової недостатності, пов'язаної з ТСС. Через 72 години Мелісса досить добре виписується, щоб продовжити одужання в домашніх умовах.
Вправа\(\PageIndex{6}\)
Яким чином антибіотикотерапія допомогла б боротися з суперантигеном?
Клінічна спрямованість: Частина 2
Набряклі лімфатичні вузли, живіт та селезінка Олівії свідчать про сильну імунну відповідь на системну інфекцію. Крім того, маленька Олівія неохоче повертає голову і, здається, відчуває сильний біль у шиї. Лікар призначає повний аналіз крові, посів крові, люмбальну пункцію. Отримана спинномозкова рідина (спинномозкова рідина) виглядає каламутною і додатково оцінюється за допомогою оцінки плями Грама та культивування потенційних бактеріальних збудників. Повний аналіз крові вказує на підвищену кількість лейкоцитів у крові Олівії. Збільшення лейкоцитів реєструється при 28,5 К/мкл (нормальний діапазон: 6,0-17,5 К/мкл). Відсоток нейтрофілів був зафіксований як 60% (нормальний діапазон: 23— 45%). Рівні глюкози в лікворі реєстрували на рівні 30 мг/100 мл (нормальний діапазон: 50-80 мг/100 мл). Кількість лейкоцитів в лікворі становила 1,163/мм3 (нормальний діапазон: 5—20/мм 3).
Вправа\(\PageIndex{7}\)
- Виходячи з цих результатів, у вас є попередній діагноз?
- Яке рекомендоване лікування, засноване на цьому попередньому діагнозі?
Ключові поняття та резюме
- Незрілі Т-лімфоцити виробляються в червоному кістковому мозку і відправляються в тимус для дозрівання.
- Виділення тимуса - це триступеневий процес негативного і позитивного відбору, який визначає, які Т-клітини дозріють і вийдуть з тимуса в периферичний кровотік.
- Центральна толерантність передбачає негативний відбір самореактивних Т-клітин в тимусі, а периферична толерантність включає в себе анергію та регуляторні Т-клітини, які запобігають самореактивним імунним реакціям та аутоімунітету.
- TCR схожий за структурою з імуноглобулінами, але менш складний. Мільйони унікальних епітоп-зв'язуючих TCR кодуються через процес генетичної перебудови сегментів генів V, D та J.
- Т-клітини можна розділити на три класи - допоміжні Т-клітини, цитотоксичні Т-клітини та регуляторні Т-клітини - на основі їх експресії CD4 або CD8, молекул MHC, з якими вони взаємодіють для активації, та їх відповідних функцій.
- Активовані помічники Т-клітини диференціюються на T H 1, T H 2, T H 17 або підтипи Т-клітин пам'яті. Диференціювання направляють специфічні цитокіни, яким вони піддаються. Т Н 1, Т Н 2 і Т Н 17 виконують різні функції, пов'язані зі стимуляцією адаптаційної та вродженої імунного захисту. Т-клітини пам'яті - це довгоживучі клітини, які можуть швидко реагувати на вторинне опромінення.
- Після активації цитотоксичні Т-клітини націлюються і вбивають клітини, інфіковані внутрішньоклітинними збудниками. Вбивство вимагає розпізнавання специфічних епітопів збудника, представлених на поверхні клітини, за допомогою молекул MHC I. Вбивство опосередковано перфорином і гранзимами, які викликають апоптоз.
- Суперантигени - це бактеріальні або вірусні білки, які викликають неспецифічну активацію Т-клітин хелперів, що призводить до надмірного вивільнення цитокінів (цитокіновий шторм) і системної, потенційно смертельної запальної реакції.
Виноски
- 1 Блашиц С., Раффателлу М. «Цитокіни Th17 та бар'єр слизової оболонки кишечника». J Клін Іммунол. 2010 Мар; 30 (2) :196-203. доп: 10.1007/s10875-010-9368-7.
