14.5: Тестування ефективності протимікробних препаратів
- Page ID
- 4081
Цілі навчання
- Поясніть поняття лікарської резистентності
- Опишіть, як мікроорганізми розвиваються або набувають лікарської стійкості
- Опишіть різні механізми стійкості до протимікробних препаратів
Стійкість до протимікробних препаратів - явище не нове. У природі мікроби постійно розвиваються для того, щоб подолати антимікробні сполуки, що виробляються іншими мікроорганізмами. Людський розвиток антимікробних препаратів та їх широке клінічне застосування просто забезпечили ще один селективний тиск, який сприяє подальшій еволюції. Кілька важливих факторів можуть прискорити еволюцію лікарської резистентності. До них відносяться надмірне і неправильне використання протимікробних препаратів, неналежне застосування протимікробних препаратів, субтерапевтичне дозування, недотримання пацієнтом рекомендованого курсу лікування.
Вплив збудника антимікробної сполуки може вибрати для хромосомних мутацій, що надають резистентність, які можуть бути перенесені вертикально до наступних мікробних поколінь і з часом стають переважними в мікробної популяції, яка багаторазово піддається впливу антимікробних препаратів. Крім того, багато генів, відповідальних за стійкість до ліків, знаходяться на плазмідах або в транспозонах, які можуть бути легко перенесені між мікробами за допомогою горизонтальної передачі генів (див. Як безстатеві прокаріоти досягають генетичної різноманітності). Транспозони також мають здатність переміщати гени опору між плазмідами та хромосомами для подальшого сприяння поширенню резистентності.
Механізми стійкості до наркотиків
Існує кілька загальних механізмів стійкості до ліків, які узагальнені на рис\(\PageIndex{1}\). Ці механізми включають ферментативну модифікацію препарату, модифікацію антимікробної мішені та запобігання проникненню або накопиченню ліків.
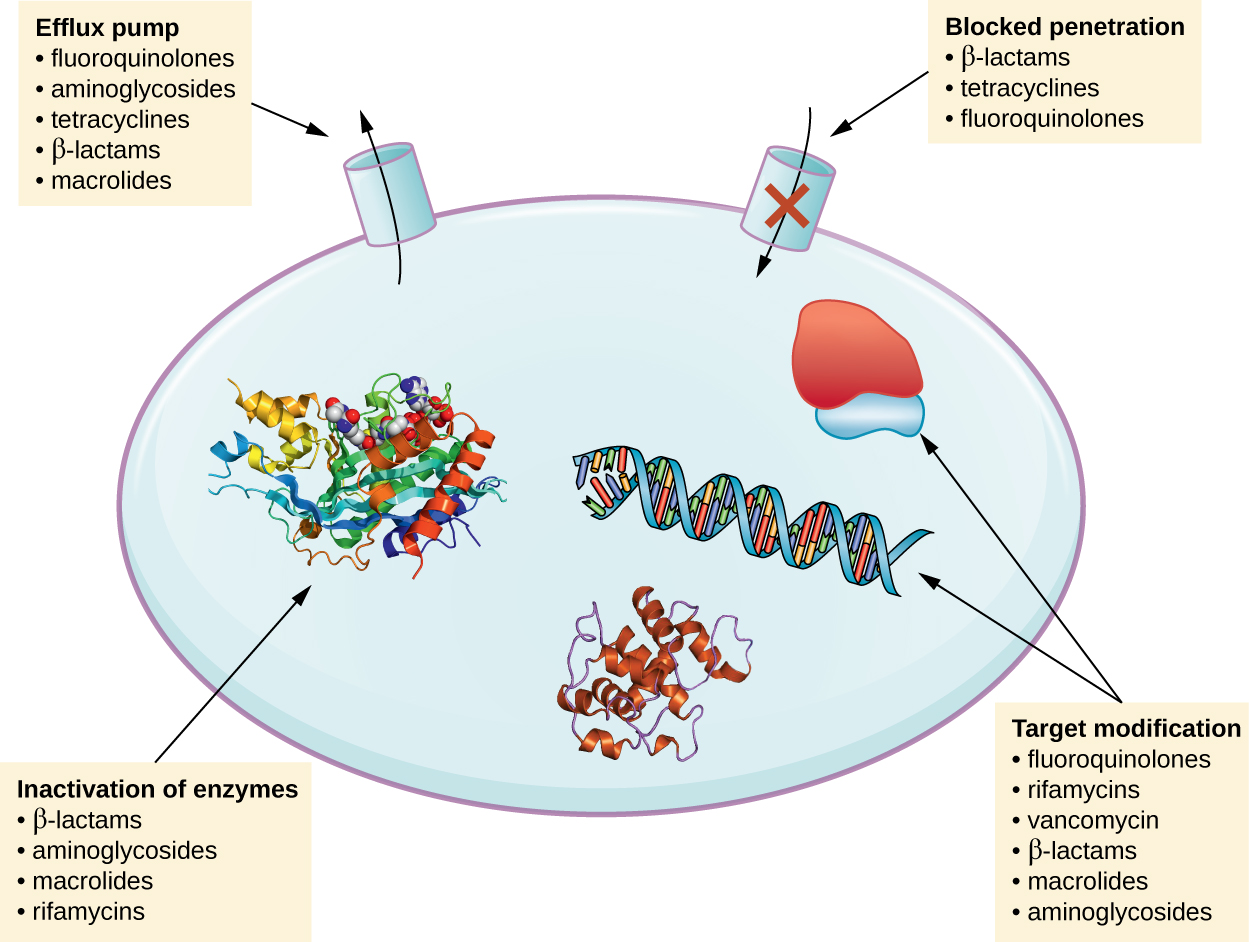
Модифікація або інактивація наркотиків
Гени резистентності можуть кодувати ферменти, які хімічно модифікують антимікробну речовину, тим самим інактивуючи його, або знищують антимікробний засіб шляхом гідролізу Резистентність до багатьох видів протимікробних препаратів відбувається за допомогою цього механізму. Наприклад, резистентність до аміноглікозидів може відбуватися через ферментативний перенесення хімічних груп до молекули препарату, погіршуючи зв'язування препарату з його бактеріальною мішенню. Для β-лактамів стійкість бактерій може включати ферментативний гідроліз β-лактамного зв'язку всередині β-лактамного кільця молекули препарату. Як тільки β-лактамний зв'язок порушується, препарат втрачає антибактеріальну активність. Цей механізм резистентності опосередкований β-лактамазами, які є найбільш поширеним механізмом β-лактамної резистентності. Інактивація рифампіну зазвичай відбувається за допомогою глікозилювання, фосфорилювання або рибозилювання аденозиндифосфату (АДФ), а стійкість до макролідів та лінкозамідів також може виникати через ферментативну інактивацію препарату або модифікації.
Профілактика клітинного поглинання або витіку
Мікроби можуть розвивати механізми резистентності, які передбачають інгібування накопичення антимікробного препарату, що потім перешкоджає досягненню препарату своєї клітинної мети. Ця стратегія поширена серед грамнегативних патогенів і може включати зміни ліпідного складу зовнішньої мембрани, селективності поринового каналу та/або концентрації поринових каналів. Наприклад, поширеним механізмом резистентності до карбапенема серед синьогнійної палички є зменшення кількості його поріну PrD, який є первинним порталом входу для карбапенемів через зовнішню мембрану цього збудника. Крім того, багато грампозитивних і грамнегативних патогенних бактерій виробляють потокові насоси, які активно транспортують антимікробний препарат з клітини і запобігають накопиченню препарату до рівня, який був би антибактеріальним. Наприклад, стійкість до β-лактамів, тетрациклінів та фторхінолонів зазвичай виникає через активний витік з клітини, і досить часто для одного насоса потоку має здатність транслокувати кілька типів протимікробних препаратів.
Цільова модифікація
Оскільки антимікробні препарати мають дуже конкретні цілі, структурні зміни цих цілей можуть запобігти зв'язуванню наркотиків, роблячи препарат неефективним. Завдяки спонтанним мутаціям в генах, що кодують антибактеріальні мішені ліків, бактерії мають еволюційну перевагу, що дозволяє їм розвивати резистентність до ліків. Цей механізм розвитку опору досить поширений. Генетичні зміни, що впливають на активну ділянку пеніцилін-зв'язуючих білків (ПБП), можуть пригнічувати зв'язування β-лактамних препаратів і забезпечувати стійкість до декількох препаратів цього класу. Цей механізм дуже поширений серед штамів Streptococcus pneumoniae, які змінюють власні ПБП за допомогою генетичних механізмів. На відміну від цього, штами Staphylococcus aureus розвивають стійкість до метициліну (MRSA) через придбання нового низькоафінного PBP, а не структурно змінюють свої існуючі ПБФ. Цей новий PBP з низькою спорідненістю не тільки забезпечує стійкість до метициліну, але він забезпечує стійкість практично до всіх β-лактамних препаратів, за винятком нових цефалоспоринів п'ятого покоління, розроблених спеціально для знищення MRSA. Інші приклади цієї стратегії опору включають зміни в
- субодиниці рибосом, що забезпечують стійкість до макролідів, тетрациклінів і аміноглікозидів;
- структура ліпополісахариду (ЛПС), що забезпечує стійкість до поліміксинів;
- РНК-полімераза, що забезпечує стійкість до рифампіну;
- ДНК-гіраза, що забезпечує стійкість до фторхінолонів;
- метаболічні ферменти, що забезпечують стійкість до сульфанічних препаратів, сульфонів і триметоприму; і
- пептидоглікану субодиниці пептидних ланцюгів, що забезпечують стійкість до глікопептидів.
Цільове перевиробництво або ферментативний байпас
Коли антимікробний препарат функціонує як антиметаболіт, орієнтуючись на конкретний фермент для пригнічення його активності, існують додаткові способи, за якими може виникнути стійкість мікробів. По-перше, мікроб може надмірно продукувати цільовий фермент таким чином, що існує достатня кількість антимікробного ферменту для проведення належної ферментативної реакції. По-друге, бактеріальна клітина може розвинути шунтування, яке обходить необхідність функціонального ферменту-мішені. Обидві ці стратегії були знайдені як механізми резистентності до сульфаніламідів. Показано, що стійкість до ванкоміцину серед S. aureus передбачає зниження перехресного зчеплення пептидних ланцюгів у клітинній стінці бактерій, що забезпечує збільшення мішеней для зв'язування ванкоміцину у зовнішній клітинній стінці. Підвищене зв'язування ванкоміцину у зовнішній клітинній стінці забезпечує закупорку, яка перешкоджає проникненню вільних молекул наркотиків туди, де вони можуть блокувати синтез нової клітинної стінки.
Цільова міміка
Нещодавно виявлений механізм резистентності під назвою мімікрия міміки передбачає вироблення білків, які зв'язують та секвестують наркотики, запобігаючи зв'язуванню препаратів зі своєю мішенню. Наприклад, Mycobacterium tuberculosis виробляє білок з регулярними пентапептидними повторами, які, як видається, імітують структуру ДНК. Цей білок пов'язує фторхінолони, секвеструючи їх і утримуючи від зв'язування з ДНК, забезпечуючи М. туберкульоз резистентність до фторхінолонів. Було виявлено, що білки, які імітують А-сайт бактеріальної рибосоми, також сприяють стійкості до аміноглікозидів. 1
Вправа\(\PageIndex{1}\)
Перерахуйте кілька механізмів лікарської резистентності.
Мікроби, стійкі до наркотиків та перехресна стійкість
З клінічної точки зору, наші найбільші занепокоєння - це мікроби, стійкі до багатьох ліків (MDR) та перехресна стійкість. MDR розмовно відомі як «супербуги» і несуть один або кілька механізмів опору (ів), що робить їх стійкими до декількох протимікробних препаратів. При перехресної резистентності єдиний механізм резистентності надає стійкість до декількох антимікробних препаратів. Наприклад, наявність насоса для відливу, який може експортувати кілька антимікробних препаратів, є поширеним способом для мікробів бути стійкими до декількох препаратів за допомогою єдиного механізму опору. В останні роки з'явилося кілька клінічно важливих супербактерій, і CDC повідомляє, що супербактерії несуть відповідальність за понад 2 мільйони інфекцій у США щорічно, що призводить до щонайменше 23 000 летальних випадків. 2 Кілька надбухів, розглянутих у наступних розділах, були названі збудниками ESKAPE. Ця абревіатура відноситься до назв збудників (Enterococcus faecium, золотистий стафілокок, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa та Enterobacter spp.), але це також підходить тим, що ці хвороботворні мікроорганізми здатні «втекти» від багатьох звичайних форм антимікробної терапії. Таким чином, інфекції збудниками ESKAPE можуть бути важкими для лікування, і вони викликають велику кількість внутрішньолікарняних інфекцій.
Метіцилін-стійкий золотистий стафілокок (MRSA)
Метицилін, напівсинтетичний пеніцилін, був розроблений для протистояння інактивації β-лактамазами. На жаль, незабаром після введення метициліну в клінічну практику з'явилися і почали поширюватися стійкі до метициліну штами S. aureus. Механізм резистентності, придбання нового низькоспорідненого PBP, забезпечив S. aureus стійкість до всіх наявних β-лактам. Штами метицилін-резистентних S. aureus (MRSA) є широко поширеними умовно-патогенними збудниками і особливо турбують шкірні та інші ранові інфекції, але також можуть викликати пневмонію та септицемію. Хоча спочатку проблема в установах охорони здоров'я (лікарняний MRSA [HA-MRSA]), інфекції MRSA тепер також набуваються через контакт із зараженими представниками широкої громадськості, які називаються MRSA, пов'язані з громадою (CA-MRSA). Приблизно третина населення переносить S. aureus як член їх нормальної носової мікробіоти без хвороб, і близько 6% цих штамів стійкі до метициліну. 3 4
Клавуланова кислота: Маленький помічник пеніциліну
З введенням пеніциліну на початку 1940-х років і його подальшим масовим виробництвом суспільство стало думати про антибіотики як чудодійні ліки від широкого спектру інфекційних захворювань. На жаль, ще в 1945 році резистентність до пеніциліну була вперше задокументована і почала поширюватися. Більше 90% поточних клінічних ізолятів S. aureus стійкі до пеніциліну. 5
Хоча розробка нових протимікробних препаратів є одним з рішень цієї проблеми, вчені дослідили нові підходи, включаючи розробку сполук, що інактивують механізми резистентності. Розвиток клавуланової кислоти є раннім прикладом цієї стратегії. Клавуланова кислота - це молекула, що виробляється бактерією Streptococcus clavuligerus. Він містить β-лактамне кільце, що робить його структурно схожим на пеніцилін та інші β-лактами, але не виявляє клінічної ефективності при самостійному введенні. Натомість клавуланова кислота необоротно зв'язується в межах активної ділянки β-лактамаз і запобігає їх інактивації спільно введеного пеніциліну.
Клавуланова кислота була вперше розроблена в 1970-х роках і масово продавалася в поєднанні з амоксициліном, починаючи з 1980-х років під торговою маркою Аугментин. Як це зазвичай буває, незабаром з'явилася стійкість до комбінації амоксицилін-клавуланової кислоти. Резистентність найчастіше виникає внаслідок того, що бактерії збільшують вироблення своєї β-лактамази та переважують інгібуючі ефекти клавуланової кислоти, мутуючи їх β-лактамазу, тому вона більше не інгібується клавулановою кислотою або від придбання нової β-лактамази, яка не інгібується клавулановою кислотою. Незважаючи на зростаючі проблеми з резистентністю, клавуланова кислота та споріднені інгібітори β-лактамази (сульбактам і тазобактам) представляють важливу нову стратегію: розробку сполук, які безпосередньо пригнічують антимікробну резистентність ферментів.
Ванкоміцин резистентні ентерококи і золотистий стафілокок
Ванкоміцин ефективний тільки проти грампозитивних організмів, і він використовується для лікування ранових інфекцій, септичних інфекцій, ендокардитів і менінгітів, які викликані збудниками, стійкими до інших антибіотиків. Вважається однією з останніх ліній захисту від таких резистентних інфекцій, включаючи MRSA. З підвищенням стійкості до антибіотиків у 1970-х та 1980-х роках використання ванкоміцину збільшилося, і не дивно, що ми побачили появу та поширення стійких до ванкоміцину ентерококів (VRE), стійких до ванкоміцину S. aureus (VRSA) та ванкоміцину-проміжного S. aureus (VISA). Механізм стійкості до ванкоміцину серед ентерококів полягає в модифікації мішеней, що передбачає структурну зміну пептидного компонента пептидогліканових субодиниць, що перешкоджає зв'язуванню ванкоміцину. Ці штами, як правило, поширюються серед пацієнтів у клінічних умовах шляхом контакту з медичними працівниками та забрудненими поверхнями та медичним обладнанням.
Штами VISA і VRSA відрізняються один від одного механізмом опору і ступенем опору, який надає кожен механізм. Штами VISA проявляють проміжну стійкість, з мінімальною інгібуючою концентрацією (МІК) 4-8 мкг/мл, а механізм передбачає збільшення мішеней ванкоміцину. Штами VISA зменшують зшивання пептидних ланцюгів в клітинній стінці, забезпечуючи збільшення мішеней ванкоміцину, які затримують ванкоміцин у зовнішній клітинній стінці. На відміну від цього, штами VRSA набувають резистентність до ванкоміцину шляхом горизонтального перенесення генів резистентності з VRE, можливість надається особам, коінфікованим як VRE, так і MRSA. VRSA демонструють більш високий рівень опору, з мікрофонами 16 мкг/мл або вище. 6 У випадку всіх трьох типів бактерій, стійких до ванкоміцину, необхідна швидка клінічна ідентифікація, щоб можна було впровадити належні процедури для обмеження поширення. Оксазолідинони, такі як лінезолід, корисні для лікування цих стійких до ванкоміцину, умовно-патогенних мікроорганізмів, а також MRSA.
β-лактамази з розширеним спектром дії, що продукують грамнегативні патогени
Грамнегативні патогени, які виробляють β-лактамази розширеного спектру (ESBLS), виявляють стійкість далеко за межі лише пеніцилінів. Спектр β-лактамів, інактивованих ESBLS, забезпечує стійкість до всіх пеніцилінів, цефалоспоринів, монобактамів та комбінацій β-лактамази інгібіторів, але не до карбапенемів. Ще більше занепокоєння викликає те, що гени, що кодують ESBL, зазвичай знаходяться на мобільних плазмідах, які також містять гени для стійкості до інших класів ліків (наприклад, фторхінолонів, аміноглікозидів, тетрациклінів), і можуть легко поширюватися на інші бактерії шляхом горизонтального перенесення генів. Ці мультирезистентні бактерії є членами кишкової мікробіоти деяких особин, але вони також є важливими причинами опортуністичних інфекцій у госпіталізованих пацієнтів, від яких вони можуть поширюватися іншим людям.
Карбапеном стійкі до грамнегативних бактерій
Виникнення стійких до карбапенем Enterobacteriaceae (CRE) та стійкості до карбапенема серед інших грамнегативних бактерій (наприклад, P. aeruginosa, Acinetobacter baumannii, Stenotrophomonas maltophila) є зростаючою проблемою охорони здоров'я. Ці збудники розвивають стійкість до карбапенемів за допомогою різних механізмів, включаючи вироблення карбапенемаз (β-лактамаз широкого спектру дії, які інактивують всі β-лактами, включаючи карбапенеми), активний витік карбапенемів з клітини та/або запобігання потраплянню карбапенему через поринові канали. Подібно до проблем з ESBLS, стійкі до карбапеном, грамнегативні збудники, як правило, стійкі до декількох класів антибактеріальних препаратів, а деякі навіть розвинули пан-резистентність (стійкість до всіх наявних антибактеріальних препаратів). Інфекції стійкими до карбапеном грамнегативними патогенами зазвичай відбуваються в медичних установах через взаємодію із зараженими особами або медичними пристроями або в результаті хірургічного втручання.
Мультимедикаментозна стійка мікобактерії туберкульо
Виникнення мультирезистентних мікобактерій туберкульозу (МЛУ-ТБ) та інтенсивно стійких до ліків Mycobacterium tuberculosis (ШЛУ-ТБ) також викликає значне занепокоєння у всьому світі. Штами МЛУ-ТБ стійкі як до рифампіну, так і до ізоніазиду, комбінації препаратів зазвичай призначають для лікування туберкульозу. Штами ШЛУ-ТБ додатково стійкі до будь-якого фторхінолону та принаймні одного з трьох інших препаратів (амікацин, канаміцин або капреоміцин), що використовуються в якості другої лінії лікування, залишаючи цих пацієнтів дуже мало варіантів лікування. Обидва типи збудників особливо проблемні у осіб з ослабленим імунітетом, включаючи тих, хто страждає на ВІЛ-інфекцію. Розвиток резистентності у цих штамів часто є наслідком неправильного застосування протимікробних препаратів для лікування туберкульозу, відбору на резистентність.
Вправа\(\PageIndex{2}\)
Як призводить резистентність до наркотиків до суперклопів?
Щоб дізнатися більше про 18 найбільш стійких до наркотиків загроз для США, відвідайте веб-сайт CDC.
Фабричне землеробство та стійкість до наркотиків
Хоча тваринництво вже давно є основною частиною сільського господарства в Америці, зростання концентрованих операцій з годівлі тварин (CAFO) з 1950-х років спричинило деякі нові екологічні проблеми, включаючи забруднення води та повітря біологічними відходами та етичні питання щодо прав тварин також пов'язані з вирощуванням тварин таким чином. Крім того, збільшення CaFO передбачає широке застосування антимікробних препаратів у вирощуванні худоби. Протимікробні препарати використовуються для запобігання розвитку інфекційних захворювань у близьких кварталах КАФОС; однак більшість протимікробних препаратів, що використовуються в заводському господарстві, призначені для сприяння зростанню - іншими словами, для вирощування більших тварин.
Механізм, що лежить в основі цього посиленого зростання, залишається неясним. Ці антибіотики не обов'язково можуть бути такими ж, як ті, що застосовуються клінічно для людини, але вони структурно пов'язані з препаратами, що використовуються для людини. Як результат, використання антимікробних препаратів у тварин може вибрати для протимікробної стійкості, при цьому ці резистентні бактерії стають перехресно стійкими до препаратів, які зазвичай використовуються у людей. Наприклад, використання тилозину у тварин, як видається, вибирає бактерії також перехресно стійкі до інших макролідів, включаючи еритроміцин, зазвичай використовується у людей.
Концентрації стійких до наркотиків штамів бактерій, що генеруються CaFo, збільшуються у воді та ґрунті, що оточують ці ферми. Якщо не безпосередньо патогенні у людини, ці стійкі бактерії можуть служити резервуаром рухливих генетичних елементів, які потім можуть передавати гени резистентності до патогенів людини. На щастя, процес приготування, як правило, інактивує будь-які протимікробні препарати, що залишаються в м'ясі, тому люди, як правило, не вживають ці препарати безпосередньо. Тим не менш, багато людей закликають до більш розсудливого використання цих препаратів, можливо, стягуючи фермерів плату за користувачів, щоб зменшити нерозбірливе використання. Фактично, у 2012 році FDA опублікувало рекомендації для фермерів, які добровільно припиняють використання антимікробних препаратів, за винятком ветеринарного нагляду та коли це необхідно для забезпечення здоров'я тварин. Хоча дотримання вказівок є добровільним в цей час, FDA рекомендує те, що він називає «розумним» використанням антимікробних препаратів у тварин, що виробляють їжу, намагаючись зменшити стійкість до протимікробних препаратів.
Клінічна спрямованість: Частина 3
На жаль, інфекція сечовивідних шляхів Маріси не дозволилася при лікуванні ципрофлоксацином. Лабораторні дослідження показали, що її інфекція була викликана штамом Klebsiella pneumoniae зі значною стійкістю до протимікробних препаратів. Профіль стійкості цього K. pneumoniae включав стійкість до класу карбапенем антибактеріальних препаратів, групи β-лактамів, які зазвичай зарезервовані для лікування високостійких бактерій. K. pneumoniae - це опортуністична, капсульована, грамнегативна паличка, яка може бути членом нормальної мікробіоти кишкового тракту, але може також викликати ряд захворювань, включаючи пневмонію та ІМП.
Конкретні лабораторні тести, які шукали виробництво карбапенемази, були проведені на зразках Маріси і повернулися позитивними. Виходячи з цього результату, у поєднанні з її історією здоров'я, підозрювалося виробництво карбапенемази, відомої як Нью-Делі Металло-β-лактамаза (NDM). Хоча походження карбапенемази NDM не повністю відомо, багато пацієнтів, інфікованих штамами, що містять NDM, мають історії подорожей, пов'язані з госпіталізацією в Індії або навколишніх країнах.
Вправа\(\PageIndex{1}\)
Як би лікарі визначали, які види протимікробних препаратів слід вводити?
Ключові поняття та резюме
- Стійкість до протимікробних препаратів зростає і є результатом відбору стійких до ліків штамів в клінічних середовищах, надмірного використання та неправильного використання антибактеріальних препаратів, застосування субтерапевтичних доз антибактеріальних препаратів та поганої дотримання пацієнтом антибактеріальної лікарської терапії.
- Гени резистентності до наркотиків часто переносяться на плазмідах або в транспозонах, які можуть легко піддаватися вертикальному перенесенню та між мікробами через горизонтальну передачу генів.
- Загальні режими стійкості до протимікробних препаратів включають модифікацію або інактивацію ліків, запобігання клітинного поглинання або витіку, модифікацію цілі, перевиробництво цілі або ферментативне шунтування та міміку міміки.
- Виникають проблемні мікробні штами, що демонструють велику протимікробну стійкість; багато з цих штамів можуть проживати як члени нормальної мікробіоти у людей, але також можуть викликати опортуністичну інфекцію. Передача багатьох з цих високостійких мікробних штамів часто відбувається в клінічних умовах, але також може бути позалікарняною.
Виноски
- 1 Д.Х. Фонг, А.М. Бергхуїс. «Розпущення субстрату ферменту резистентності до антибіотиків аміноглікозидів за допомогою мімікриї міміки». Журнал ЕМБО 21 № 10 (2002) :2323—2331.
- 2 Центри з контролю та профілактики захворювань. «Антибіотикова/антимікробна резистентність». http://www.cdc.gov/drugresistance/index.html. Доступ до 2 червня 2016 року.
- 3 А.С.Калохе та співавт. «Сприйнятливість до наркотиків до туберкульозу та молекулярно-діагностичне тестування: огляд літератури. Американський журнал медичних наук 345 немає. 2 (2013) :143—148.
- 4 Центри з контролю та профілактики захворювань. «Метіцилін-резистентний золотистий стафілокок (MRSA): Загальна інформація про MRSA в співтоваристві». http://www.cdc.gov/mrsa/community/index.html. Доступ до 2 червня 2016 р.
- 5 Ф.Д. Лоуї «Стійкість до протимікробних препаратів: приклад золотистого стафілокока». Журнал клінічних досліджень 111 № 9 (2003) :1265—1273.
- 6 Центри з контролю та профілактики захворювань. «Інфекції, пов'язані з охороною здоров'я (ОВЗ): Загальна інформація про VISA/VRSA.» www.CDC.gov/HAI/Організми/VIS... visa_vrsa.html. Доступ до 2 червня 2016 року.
