14.3: Препарати, орієнтовані на інші мікроорганізми
- Page ID
- 4075
Цілі навчання
- Опишіть механізми дії, пов'язані з препаратами, які пригнічують біосинтез клітинної стінки, синтез білка, мембранну функцію, синтез нуклеїнових кислот та метаболічний шлях.
Важливою якістю для антимікробного препарату є селективна токсичність, що означає, що він вибірково вбиває або пригнічує ріст мікробних мішеней, завдаючи при цьому мінімальної шкоди або взагалі не завдаючи шкоди господареві. Більшість антимікробних препаратів, які зараз використовуються в клінічному застосуванні, є антибактеріальними, оскільки прокаріотична клітина забезпечує більшу різноманітність унікальних мішеней для селективної токсичності порівняно з грибами, паразитами та вірусами. Кожен клас антибактеріальних препаратів має унікальний спосіб дії (спосіб, яким препарат впливає на мікроби на клітинному рівні), і вони зведені на малюнку\(\PageIndex{1}\) і табл\(\PageIndex{1}\).
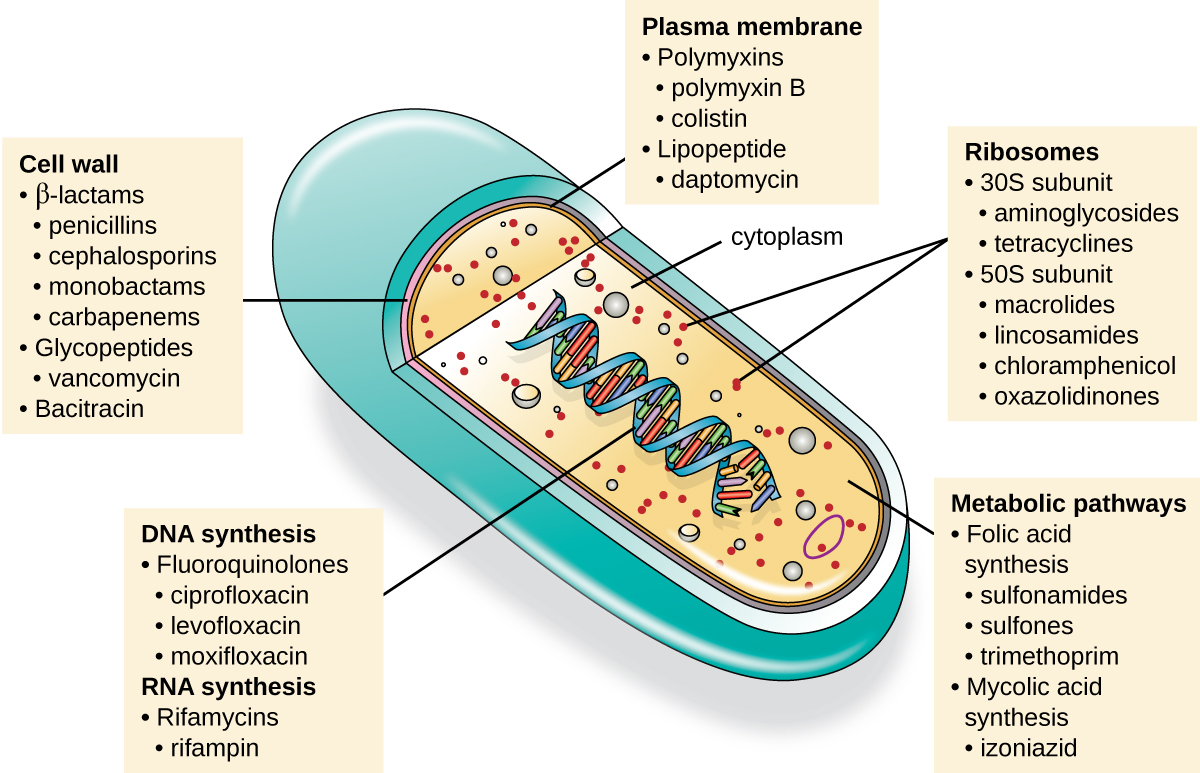
| Режим дії | Цільова | Клас наркотиків |
|---|---|---|
| Пригнічують біосинтез клітинної стінки | Пеніцилін-зв'язуючі білки | β-лактами: пеніциліни, цефалоспорини, монобактами, карбапенеми |
| Субодиниці пептидоглікану | глікопептиди | |
| Транспорт субодиниці пептидоглікану | Бацитрацин | |
| Пригнічують біосинтез білків | 30S рибосомальна субодиниця | Аміноглікозиди, тетрацикліни |
| 50S рибосомальна субодиниця | Макроліди, лінкозаміди, хлорамфенікол, оксазолідинони | |
| Порушити мембрани | Ліпополісахарид, внутрішня і зовнішня мембрани | Поліміксин В, колістин, даптоміцин |
| Пригнічують синтез нуклеїнових кислот | РНК | Рифаміцин |
| ДНК | фторхінолони | |
| Антиметаболіти | Фермент синтезу фолієвої кислоти | Сульфаніламіди, триметоприм |
| Фермент синтезу міколевої кислоти | Гідразид ізонікотинової кислоти | |
| Інгібітор синтази мікобактерій аденозинтрифосфату (АТФ) | Мікобактеріальна АТФ-синтаза | Діарілхінолін |
Інгібітори біосинтезу клітинної стінки
Кілька різних класів антибактеріальних препаратів блокують етапи біосинтезу пептидоглікану, роблячи клітини більш сприйнятливими до осмотичного лізису (табл.\(\PageIndex{2}\)). Тому антибактеріальні засоби, які націлені на біосинтез клітинної стінки, є бактерицидними за своєю дією. Оскільки клітини людини не виробляють пептидоглікан, цей спосіб дії є прекрасним прикладом селективної токсичності.
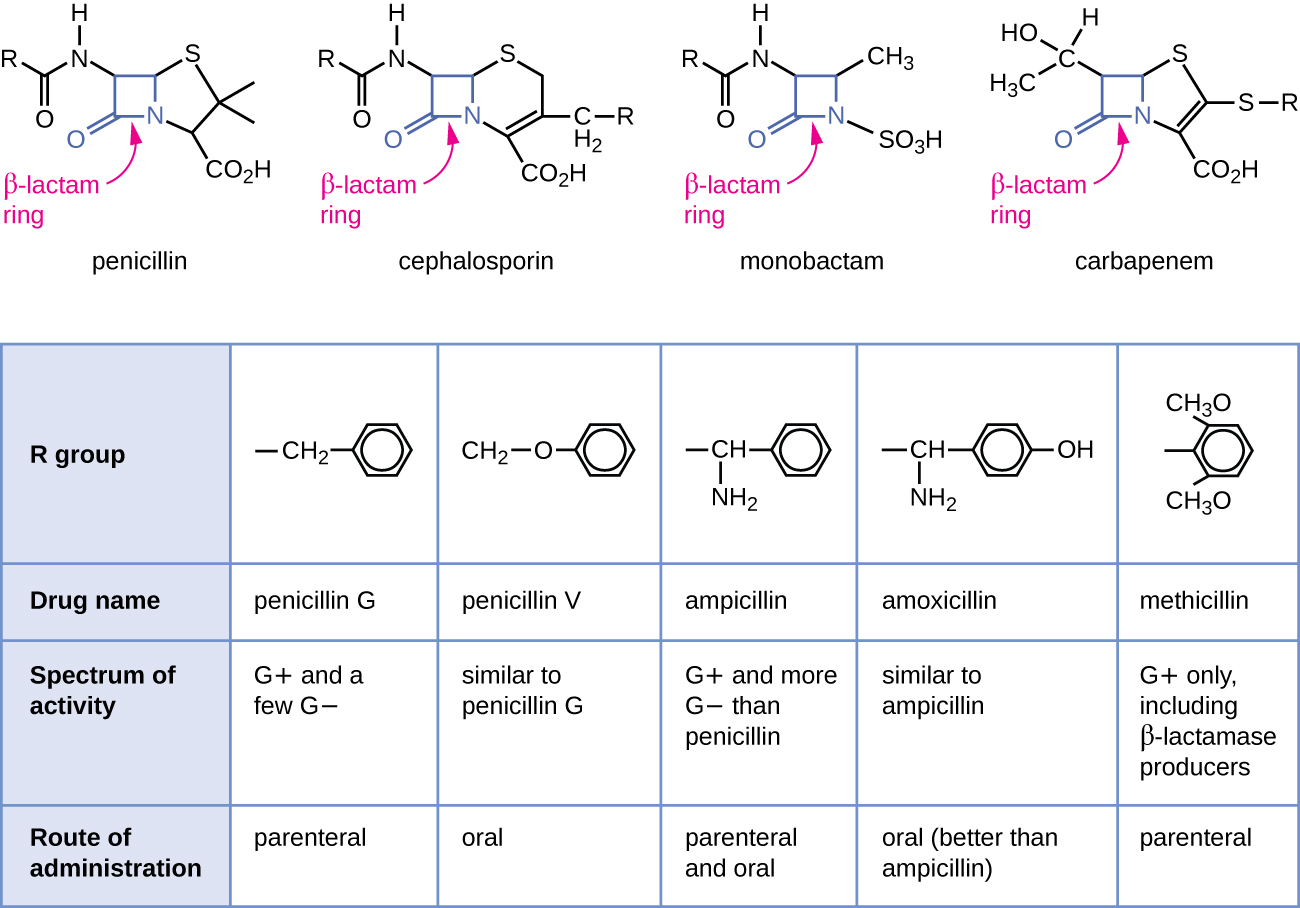
Пеніцилін, перший виявлений антибіотик, є одним з декількох антибактеріальних препаратів у класі, який називається β-лактами. Ця група сполук включає пеніциліни, цефалоспорини, монобактами та карбапенеми, і характеризується наявністю β-лактамного кільця, знайденого в центральній структурі молекули препарату (рис.\(\PageIndex{2}\)). β-лактамні антибактеріальні засоби блокують зшивання пептидних ланцюгів під час біосинтезу нового пептидоглікану в клітинній стінці бактерій. Вони здатні блокувати цей процес, оскільки структура β-лактаму схожа на структуру компонента субодиниці пептидоглікану, який розпізнається ферментом зшивання транспептидази, також відомим як пеніцилін-зв'язуючий білок (PBP). Хоча β-лактамне кільце повинно залишатися незмінним, щоб ці препарати зберігали свою антибактеріальну активність, стратегічні хімічні зміни груп R дозволили розробити широкий спектр напівсинтетичних β-лактамних препаратів з підвищеною потенцією, розширеним спектром активності та більш тривалим періодом напіврозпаду для кращого дозування, серед інших характеристик.
Пеніцилін G і пеніцилін V є природними антибіотиками від грибів і в першу чергу активні проти грампозитивних бактеріальних збудників, а також кількох грамнегативних бактеріальних збудників, таких як Pasteurella multocida. Малюнок\(\PageIndex{2}\) підсумовує напівсинтетичний розвиток деяких пеніцилінів. Додавання аміногрупи (-NH 2) до пеніциліну G створило амінопеніциліни (тобто ампіцилін та амоксицилін), які мають підвищений спектр активності щодо більшої кількості грамнегативних патогенів. Крім того, додавання гідроксильної групи (-ОН) до амоксициліну підвищило кислотну стабільність, що дозволяє поліпшити всмоктування всередину. Метицилін - це напівсинтетичний пеніцилін, який був розроблений для вирішення проблеми поширення ферментів (пеніциліназ), які інактивували інші пеніциліни. Зміна групи R пеніциліну G на більш об'ємну диметоксифенільну групу забезпечила захист β-лактамного кільця від ферментативного руйнування пеніциліназами, даючи нам перший пеніцилінорезистентний пеніцилін.
Подібно до пеніцилінів, цефалоспорини містять β-лактамне кільце (рис.\(\PageIndex{2}\)) і блокують транспептидазную активність пеніцилін-зв'язуючих білків. Однак β-лактамне кільце цефалоспоринів зливається з кільцем з шести членів, а не п'ятичленним кільцем, знайденим у пеніцилінах. Ця хімічна відмінність забезпечує цефалоспоринам підвищену стійкість до ферментативної інактивації β-лактамазами. Препарат цефалоспорин С спочатку був виділений з гриба Cephalosporium acremonium в 1950-х роках і має аналогічний спектр активності пеніциліну проти грампозитивних бактерій, але активний відносно більшої кількості грамнегативних бактерій, ніж пеніцилін. Ще одна важлива структурна відмінність полягає в тому, що цефалоспорин С має дві групи R, порівняно лише з однією групою R для пеніциліну, і це забезпечує більшу різноманітність хімічних змін та розвитку напівсинтетичних цефалоспоринів. Сімейство напівсинтетичних цефалоспоринів набагато більше пеніцилінів, і ці препарати були класифіковані на покоління, засновані насамперед на їх спектрі активності, збільшуючись в спектрі від вузького спектра, цефалоспоринів першого покоління до широкого спектру, четвертого покоління цефалоспорини. Розроблено новий цефалоспорин п'ятого покоління, який активний проти метицилін-стійкого золотистого стафілокока (MRSA).
Карбапенеми та монобактами також мають β-лактамне кільце як частину своєї основної структури, і вони пригнічують транспептидазну активність пеніцилін-зв'язуючих білків. Єдиним монобактамом, який використовується клінічно, є ацтреонам. Це антибактеріальний засіб вузького спектра дії, що має активність лише проти грамнегативних бактерій. На відміну від цього, сімейство карбапенем включає в себе різноманітні напівсинтетичні препарати (іміпенем, меропенем і доріпенем), які забезпечують дуже широкий спектр активності щодо грампозитивних і грамнегативних бактеріальних збудників.
Препарат ванкоміцин, що входить до класу сполук під назвою глікопептиди, був відкритий в 1950-х роках як природний антибіотик з актиноміцета Amycolatopsis orientalis. Подібно до β-лактамів, ванкоміцин пригнічує біосинтез клітинної стінки і є бактерицидним. Однак, на відміну від β-лактамів, структура ванкоміцину не схожа на структуру субодиниць пептидоглікану клітинної стінки і безпосередньо не інактивує пеніцилін-зв'язуючі білки. Швидше, ванкоміцин - це дуже велика, складна молекула, яка зв'язується з кінцем пептидного ланцюга попередників клітинної стінки, створюючи структурну закупорку, яка перешкоджає включенню субодиниць клітинної стінки у зростаючу N-ацетилглюкозамін та N-ацетилмурамінову кислоту (NAM-NAG) кістяк пептидоглікану структура (трансглікозилювання). Ванкоміцин також структурно блокує транспептидацію. Ванкоміцин бактерицидний проти грампозитивних бактеріальних збудників, але він не активний щодо грамнегативних бактерій через нездатність проникати через захисну зовнішню мембрану.
Препарат бацитрацин складається з групи структурно схожих пептидних антибіотиків, спочатку виділених з Bacillus subtilis. Бацитрацин блокує активність певної клітинно-мембранної молекули, яка відповідає за рух попередників пептидоглікану з цитоплазми до зовнішньої частини клітини, в кінцевому підсумку перешкоджаючи їх включенню в клітинну стінку. Бацитрацин ефективний проти широкого спектру бактерій, включаючи грампозитивні організми, виявлені на шкірі, таких як стафілокок і стрептокок. Хоча за деяких обставин його можна вводити перорально або внутрішньом'язово, бацитрацин виявився нефротоксичним (пошкоджує нирки). Тому його частіше поєднують з неоміцином і поліміксином в місцевих мазях, таких як Неоспорін.
| Механізм дії | Клас наркотиків | специфічні препарати | Натуральний або напівсинтетичний | Спектр діяльності |
|---|---|---|---|---|
| Взаємодіяти безпосередньо з ПБП і пригнічувати активність транспептидази | Пеніциліни | Пеніцилін G, пеніцилін V | Природні | Вузький спектр проти грампозитивних і декількох грамнегативних бактерій |
| Ампіцилін, амоксицилін | Напівсинтетичні | Вузький спектр проти грампозитивних бактерій, але зі збільшеним грамнегативним спектром | ||
| Метіцилін | Напівсинтетичні | Вузький спектр лише проти грампозитивних бактерій, включаючи штами, що продукують пеніциліназу | ||
| Цефалоспорини | Цефалоспорин С | Природні | Вузький спектр, схожий на пеніцилін, але зі збільшеним грамнегативним спектром | |
| Цефалоспорини першого покоління | Напівсинтетичні | Вузький спектр, схожий на цефалоспорин С | ||
| Цефалоспорини другого покоління | Напівсинтетичні | Вузький спектр, але зі збільшеним грамнегативним спектром порівняно з першим поколінням | ||
| Цефалоспорини третього і четвертого покоління | Напівсинтетичні | Широкий спектр дії проти грампозитивних та грамнегативних бактерій, включаючи деякі продуценти β-лактамази | ||
| Цефалоспорини п'ятого покоління | Напівсинтетичні | Широкий спектр дії проти грампозитивних і грамнегативних бактерій, включаючи MRSA | ||
| Монобактами | Азтреонам | Напівсинтетичні | Вузький спектр проти грамнегативних бактерій, включаючи деякі продуценти β-лактамази | |
| Карбапенеми | Іміпенем, меропенем, доріпенем | Напівсинтетичні | Найширший спектр β-лактамів проти грампозитивних та грамнегативних бактерій, включаючи багатьох продуцентів β-лактамази | |
| Великі молекули, які зв'язуються з пептидним ланцюгом субодиниць пептидоглікану, блокуючи трансглікозилювання і транспептидацію | глікопептиди | Ванкоміцин | Природні | Вузький спектр лише проти грампозитивних бактерій, включаючи штами, стійкі до багатьох препаратів |
| Блокування транспортування субодиниць пептидоглікану через цитоплазматичну мембрану | Бацитрацин | Бацитрацин | Природні | Широкий спектр дії проти грампозитивних і грамнегативних бактерій |
Вправа\(\PageIndex{1}\)
Опишіть спосіб дії β-лактамів.
Інгібітори біосинтезу білка
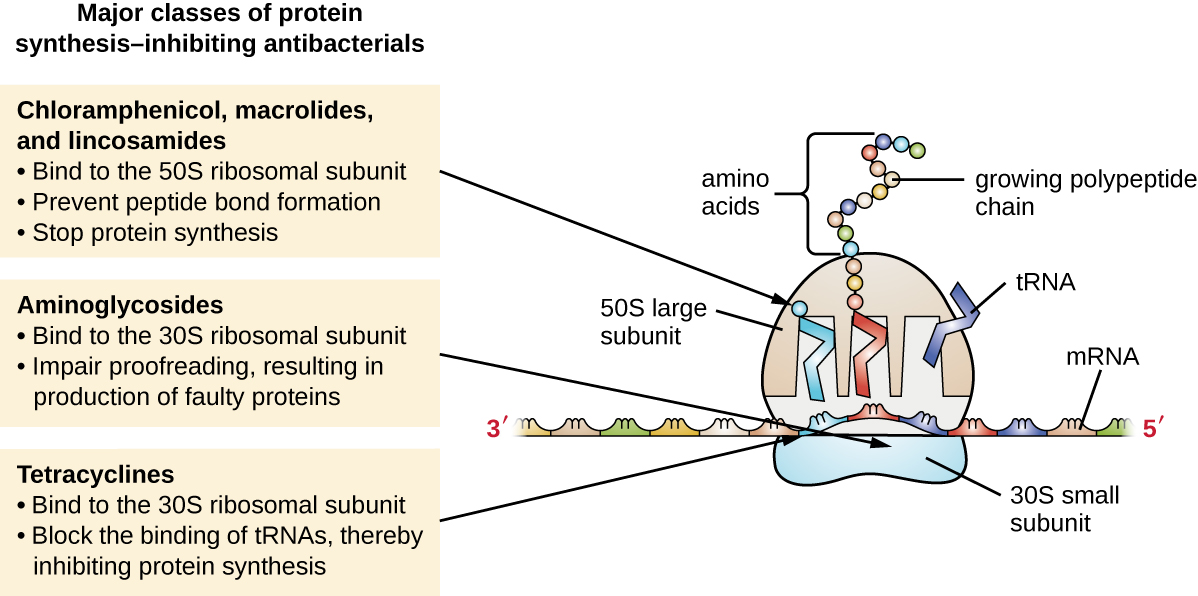
Цитоплазматичні рибосоми, знайдені в клітині тварин (80S), структурно відрізняються від тих, що містяться в бактеріальних клітині (70-ті), що робить біосинтез білка хорошою селективною мішенню для антибактеріальних препаратів. Кілька видів інгібіторів біосинтезу білка розглядаються в цьому розділі і узагальнені на рис\(\PageIndex{3}\).
Інгібітори синтезу білка, які пов'язують субодиницю
Аміноглікозиди - великі високополярні антибактеріальні препарати, які зв'язуються з 30S субодиницею бактеріальних рибосом, погіршуючи коректорську здатність рибосомального комплексу. Це порушення викликає розбіжності між кодонами і антикодонами, в результаті чого відбувається вироблення білків з неправильними амінокислотами і укороченими білками, які вставляються в цитоплазматичну мембрану. Порушення цитоплазматичної мембрани несправними білками вбиває клітини бактерій. Аміноглікозиди, до складу яких входять такі препарати, як стрептоміцин, гентаміцин, неоміцин та канаміцин, є потужними антибактеріальними засобами широкого спектру дії. Однак було показано, що аміноглікозиди є нефротоксичними (пошкоджують нирки), нейротоксичними (пошкоджують нервову систему) та ототоксичними (пошкоджують вухо).
Ще одним класом антибактеріальних сполук, які зв'язуються з субодиницею 30S, є тетрацикліни. На відміну від аміноглікозидів, ці препарати є бактеріостатичними і пригнічують синтез білка, блокуючи асоціацію тРНК з рибосомою під час трансляції. Природні тетрацикліни, що виробляються різними штамами Streptomyces, були вперше виявлені в 1940-х роках, а також було вироблено кілька напівсинтетичних тетрациклінів, включаючи доксициклін і тигециклін. Хоча тетрацикліни мають широкий спектр у своєму охопленні бактеріальних збудників, побічні ефекти, які можуть обмежити їх використання, включають фототоксичність, постійне знебарвлення зубів, що розвиваються, та токсичність печінки у високих дозах або у пацієнтів з порушенням функції нирок.
Інгібітори синтезу білка, які зв'язують субодиницю 50S
Існує кілька класів антибактеріальних препаратів, які працюють через зв'язування з 50S субодиницею бактеріальних рибосом. Макролідні антибактеріальні препарати мають велику, складну кільцеву структуру і є частиною більшого класу природним чином вироблених вторинних метаболітів, які називаються полікетідами, складними сполуками, що утворюються поетапно шляхом повторного додавання двовуглецевих одиниць механізмом, подібним до того, що використовується для жирних синтез кислоти. Макроліди - це бактеріостатичні препарати широкого спектру дії, які блокують подовження білків шляхом інгібування утворення пептидних зв'язків між специфічними комбінаціями амінокислот. Першим макролідом був еритроміцин. Він був виділений в 1952 році від Streptomyces erythreus і запобігає транслокації. До напівсинтетичних макролідів відносяться азитроміцин і телітроміцин. Порівняно з еритроміцином, азитроміцин має більш широкий спектр активності, меншу кількість побічних ефектів та значно більш тривалий період напіввиведення (1,5 години для еритроміцину проти 68 годин для азитроміцину), що дозволяє одноразово дозувати та короткий 3-денний курс терапії (тобто препарат Zpac) для більшості інфекцій. Телітроміцин є першим напівсинтетичним у класі, відомому як кетоліди. Хоча телітроміцин проявляє підвищену потенцію та активність проти мікролідів резистентних патогенів, Управління з контролю за продуктами та ліками США (FDA) обмежило його використання для лікування позалікарняної пневмонії та вимагає найсильнішої етикетки «попередження чорного ящика» для препарату через серйозну гепатотоксичність.
До лінкозамідів відносять природним чином вироблений лінкоміцин і напівсинтетичний кліндаміцин. Хоча структурно відрізняються від макролідів, лінкозаміди схожі за своїм способом дії з макролідами шляхом зв'язування з рибосомною субодиницею 50S та запобігання утворенню пептидних зв'язків. Лінкозаміди особливо активні щодо стрептококової і стафілококової інфекцій.
Препарат хлорамфенікол являє собою ще один структурно виразний клас антибактеріальних препаратів, які також зв'язуються з рибосомою 50S, пригнічуючи утворення пептидних зв'язків. Хлорамфенікол, вироблений Streptomyces venezuelae, був відкритий в 1947; в 1949 році він став першим антибіотиком широкого спектру дії, який був схвалений FDA. Хоча це природний антибіотик, він також легко синтезується і був першим антибактеріальним препаратом синтетично масового виробництва. В результаті масового виробництва, широкого спектру дії та здатності ефективно проникати в тканини, хлорамфенікол історично використовувався для лікування широкого спектру інфекцій, від менінгіту до черевного тифу до кон'юнктивіту. На жаль, серйозні побічні ефекти, такі як синдром смертельної сірої дитини та придушення вироблення кісткового мозку, обмежили його клінічну роль. Хлорамфенікол також викликає анемію двома різними способами. Один з механізмів передбачає націлювання мітохондріальних рибосом всередині гемопоетичних стовбурових клітин, викликаючи оборотне, дозозалежне придушення вироблення клітин крові. Після припинення дозування хлорамфеніколу вироблення клітин крові приходить в норму. Цей механізм підкреслює схожість між 70-ми рибосомами бактерій та рибосомами 70-х у наших мітохондріях. Другий механізм анемії є ідіосинкратичним (тобто механізм не зрозумілий) і передбачає незворотну летальну втрату продукції клітин крові, відому як апластична анемія. Цей механізм апластичної анемії не залежить від дози і може розвиватися після припинення терапії. Через проблеми токсичності використання хлорамфеніколу у людей в даний час рідко в Сполучених Штатах і обмежується важкими інфекціями, які не піддаються лікуванню менш токсичними антибіотиками. Оскільки його побічні ефекти набагато менш важкі у тварин, його використовують у ветеринарії.
Оксазолідинони, включаючи лінезолід, є новим класом синтетичних інгібіторів синтезу білків широкого спектру дії, які зв'язуються з рибосомальною субодиницею 50S як грампозитивних, так і грамнегативних бактерій. Однак механізм їх дії дещо відрізняється від механізму інших інгібіторів синтезу субодиниці, що зв'язують білок 50S, які вже обговорювалися. Натомість вони, здається, перешкоджають утворенню комплексу ініціації (асоціація субодиниці 50S, субодиниці 30S та інших факторів) для трансляції, і вони запобігають транслокації зростаючого білка з ділянки рибосомального А на ділянку P. Таблиця\(\PageIndex{3}\) узагальнює інгібітори синтезу білка.
| Молекулярна ціль | Механізм дії | Клас наркотиків | специфічні препарати | Бактеріостатичні або бактерицидні | Спектр діяльності |
|---|---|---|---|---|---|
| 30S субодиниця | Викликає розбіжності між кодонами і антикодонами, що призводить до несправних білків, які вставляються в і порушують цитоплазматичну мембрану | аміноглікозиди | Стрептоміцин, гентаміцин, неоміцин, канаміцин | бактерицидний | Широкий спектр |
| Блокує асоціацію ТРНК з рибосомою | Тетрацикліни | Тетрациклін, доксициклін, тигециклін | Бактеріостатичний | Широкий спектр | |
| 50S субодиниця | Блокує утворення пептидних зв'язків між амінокислотами | Макроліди | Еритроміцин, азитроміцин, телітроміцин | Бактеріостатичний | Широкий спектр |
| лінкозаміди | Лінкоміцин, кліндаміцин | бактеріостатичний | Вузький спектр | ||
| Не застосовується | хлорамфенікол | бактеріостатичний | Широкий спектр | ||
| Перешкоджає формуванню комплексу ініціації між 50S і 30S субодиницями та іншими факторами. | оксазолідинони | Лінезолід | бактеріостатичний | Широкий спектр |
Вправа\(\PageIndex{2}\)
Порівняйте та порівняйте різні типи інгібіторів синтезу білка.
Інгібітори мембранної функції
Невелика група антибактеріальних препаратів націлена на бактеріальну мембрану як спосіб їх дії (табл.\(\PageIndex{4}\)). Поліміксини - це природні поліпептидні антибіотики, які були вперше виявлені в 1947 році як продукти Bacillus polymyxa; клінічно використовувалися лише поліміксин В і поліміксин Е (колістин). Вони ліпофільні з миючими властивостями і взаємодіють з ліпополісахаридним компонентом зовнішньої мембрани грамнегативних бактерій, в кінцевому підсумку порушуючи як їх зовнішню, так і внутрішню мембрани і вбиваючи бактеріальні клітини. На жаль, мембранно-таргетинговий механізм не є селективною токсичністю, і ці препарати також націлені і пошкоджують мембрану клітин нирок і нервової системи при системному введенні. Через ці серйозні побічні ефекти та їх погане всмоктування з травного тракту поліміксин В використовується в безрецептурних місцевих антибіотичних мазей (наприклад, Неоспорін), а пероральний колістин історично використовувався лише для знезараження кишечника, щоб запобігти інфекціям, що походять від мікробів кишечника в пацієнтів з ослабленим імунітетом або для тих, хто переніс певні операції на черевній порожнині. Однак поява і поширення мультирезистентних патогенів призвело до посилення застосування внутрішньовенного колістину в лікарнях, часто як препарат останнього засобу для лікування серйозних інфекцій. Антибактеріальний даптоміцин - це циклічний ліпопептид, що виробляється Streptomyces roseosporus, який, здається, працює як поліміксини, вставляючи в мембрану клітин бактерій і порушуючи її. Однак, на відміну від поліміксину В та колістину, які націлені лише на грамнегативні бактерії, даптоміцин спеціально спрямований на грампозитивні бактерії. Зазвичай він вводять внутрішньовенно і, здається, добре переноситься, показуючи оборотну токсичність в скелетних м'язах.
| Механізм дії | Клас наркотиків | специфічні препарати | Спектр діяльності | Клінічне використання |
|---|---|---|---|---|
| Взаємодіє з ліпополісахаридом в зовнішній мембрані грамнегативних бактерій, вбиваючи клітину через можливе порушення зовнішньої мембрани і цитоплазматичної мембрани | Поліміксини | Поліміксин B | Вузький спектр проти грамнегативних бактерій, включаючи штами з мультимедикаментозною стійкістю | Препарати місцевого застосування для запобігання інфекцій в ранах |
| Поліміксин Е (колістин) | Вузький спектр проти грамнегативних бактерій, включаючи штами з мультимедикаментозною стійкістю | Пероральне дозування для знезараження кишечника для запобігання інфекцій у пацієнтів з ослабленим імунітетом або пацієнтів, які проходять інвазивну хірургію/процедури. | ||
| Внутрішньовенне дозування для лікування серйозних системних інфекцій, спричинених патогенами, стійкими до препаратів | ||||
| Вставляє в цитоплазматичну мембрану грампозитивних бактерій, порушуючи мембрану і вбиваючи клітину | Ліпопептид | Даптоміцин | Вузький спектр проти грампозитивних бактерій, включаючи штами з мультимедикаментозною стійкістю | Ускладнені інфекції шкіри та структури шкіри та бактеріємії, спричинені грампозитивними збудниками, включаючи MRSA |
Вправа\(\PageIndex{3}\)
Як поліміксини пригнічують функцію мембрани?
Інгібітори синтезу нуклеїнових кислот
Деякі антибактеріальні препарати працюють, пригнічуючи синтез нуклеїнових кислот (табл.\(\PageIndex{5}\)). Наприклад, метронідазол є напівсинтетичним членом сімейства нітроімідазолів, який також є антипротозойним засобом. Він перешкоджає реплікації ДНК в клітинах-мішенях. Препарат рифампін є напівсинтетичним членом сімейства рифаміцину і функціонує шляхом блокування РНК-полімеразної активності у бактерій. Ферменти РНК-полімерази у бактерій структурно відрізняються від ферментів у еукаріотів, забезпечуючи селективну токсичність проти бактеріальних клітин. Застосовується для лікування самих різних інфекцій, але його первинне застосування, часто в коктейлі з іншими антибактеріальними препаратами, є проти мікобактерій, що викликають туберкульоз. Незважаючи на вибірковість свого механізму, рифампін може спонукати ферменти печінки посилювати метаболізм інших препаратів, що вводяться (антагонізм), що призводить до гепатотоксичності (токсичність печінки) і негативно впливаючи на біодоступність і терапевтичний ефект супутніх препаратів.
Одним з представників сімейства хінолонів, групи синтетичних протимікробних препаратів, є налидиксовая кислота. Він був виявлений в 1962 році як побічний продукт під час синтезу хлорохіну, протималярійного препарату. Налідиксовая кислота вибірково пригнічує активність бактеріальної ДНК-гірази, блокуючи реплікацію ДНК. Хімічні модифікації вихідного хінолонового хребта призвели до вироблення фторхінолонів, таких як ципрофлоксацин і левофлоксацин, які також пригнічують активність ДНК-гірази. Ципрофлоксацин і левофлоксацин ефективні проти широкого спектру грампозитивних або грамнегативних бактерій і є одними з найбільш часто призначаються антибіотиків, що використовуються для лікування широкого спектру інфекцій, включаючи інфекції сечовивідних шляхів, респіраторні інфекції, абдомінальні інфекції та шкірні інфекції. Однак, незважаючи на їх селективну токсичність щодо ДНК-гірази, побічні ефекти, пов'язані з різними фторхінолонами, включають фототоксичність, нейротоксичність, кардіотоксичність, дисфункцію метаболізму глюкози та підвищений ризик розриву сухожилля.
| механізми дії | Клас наркотиків | специфічні препарати | спектр діяльності | Клінічне використання |
|---|---|---|---|---|
| Пригнічує активність бактеріальної РНК-полімерази і блокує транскрипцію, вбиваючи клітину | Рифаміцин | Рифампін | Вузький спектр з активністю проти грампозитивних і обмеженого числа грамнегативних бактерій. Також активний відносно мікобактерій туберкульозу. | Комбінована терапія при лікуванні туберкульозу |
| Пригнічує активність ДНК-гірази і блокує реплікацію ДНК, вбиваючи клітину | фторхінолони | Ципрофлоксацин, офлоксацин, моксифлоксацин | Широкий спектр дії проти грампозитивних і грамнегативних бактерій | Широке розмаїття шкірних і системних інфекцій |
Вправа\(\PageIndex{4}\)
Чому інгібітори синтезу бактеріальних нуклеїнових кислот не орієнтовані на клітини-господаря?
Інгібітори метаболічних шляхів
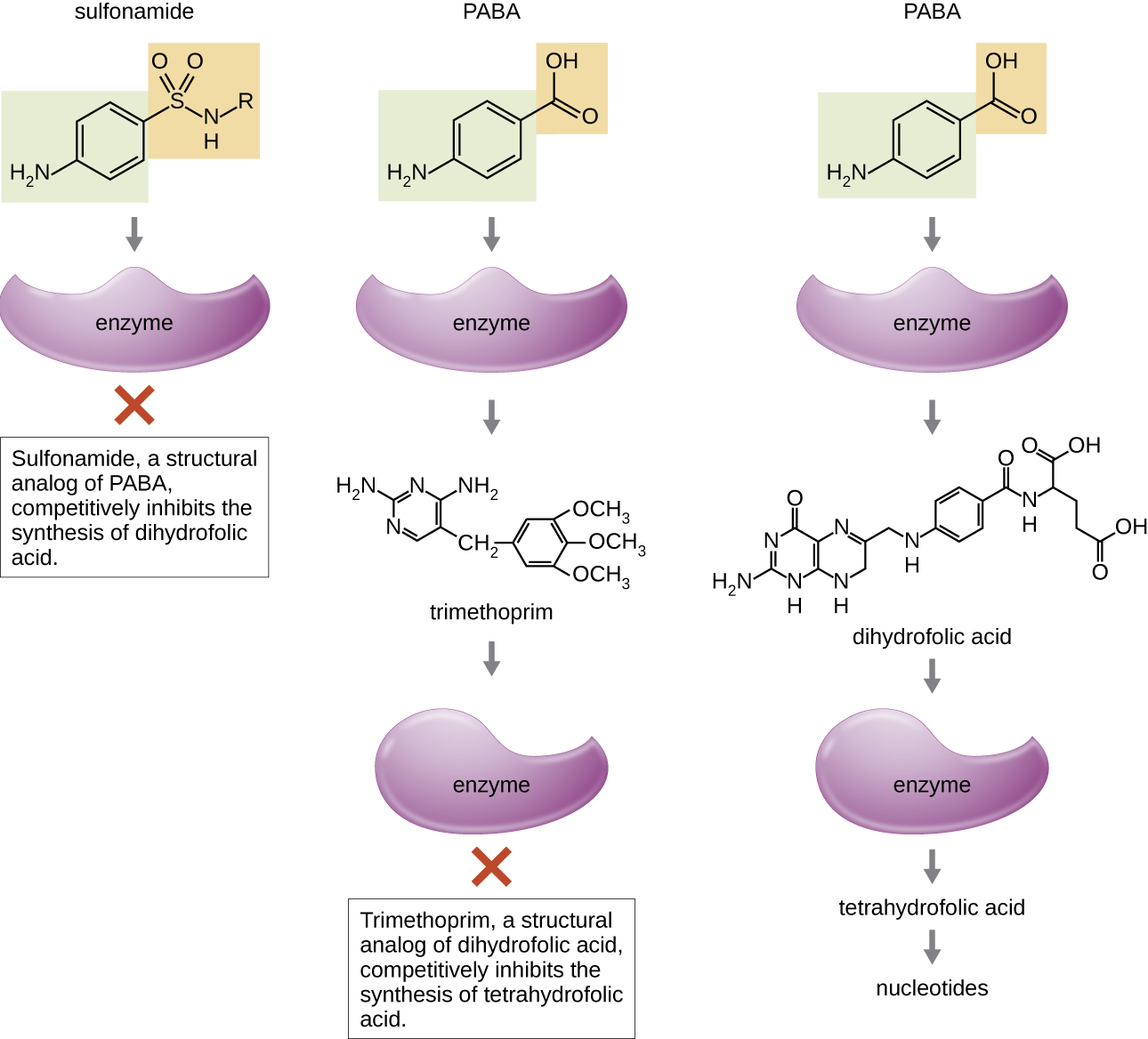
Деякі синтетичні препарати контролюють бактеріальні інфекції, функціонуючи як антиметаболіти, конкурентні інгібітори бактеріальних метаболічних ферментів (табл.\(\PageIndex{6}\)). Сульфаніламіди (сульфаніламіди) є найстарішими синтетичними антибактеріальними засобами і є структурними аналогами пара-амінобензойної кислоти (PABA), раннього проміжного продукту в синтезі фолієвої кислоти (рис.\(\PageIndex{4}\)). Інгібуючи фермент, який бере участь у виробництві дигідрофолієвої кислоти, сульфаніламіди блокують бактеріальний біосинтез фолієвої кислоти і, згодом, піримідинів і пуринів, необхідних для синтезу нуклеїнової кислоти. Цей механізм дії забезпечує бактеріостатичне пригнічення росту на тлі широкого спектру грампозитивних і грамнегативних збудників. Оскільки люди отримують фолієву кислоту з їжі замість того, щоб синтезувати її внутрішньоклітинно, сульфаніламіди вибірково токсичні для бактерій. Однак алергічні реакції на сульфінові препарати зустрічаються часто. Сульфони структурно схожі на сульфаніламіди, але сьогодні не використовуються зазвичай, за винятком лікування хвороби Хансена (прокази).
Триметоприм - синтетична антимікробна сполука, яка служить антиметаболітом в межах того ж шляху синтезу фолієвої кислоти, що і сульфаніламіди. Однак триметоприм є структурним аналогом дигідрофолієвої кислоти і гальмує більш пізню стадію метаболічного шляху (рис.\(\PageIndex{4}\)). Триметоприм застосовується в комбінації з сульфаметоксазолом сульфаметоксазол для лікування інфекцій сечовивідних шляхів, вушних інфекцій та бронхіту. Як обговорювалося, комбінація триметоприму та сульфаметоксазолу є прикладом антибактеріальної синергії. При самостійному використанні кожен антиметаболіт лише зменшує вироблення фолієвої кислоти до рівня, коли відбувається бактеріостатичне гальмування росту. Однак при використанні в комбінації інгібування обох етапів метаболічного шляху знижує синтез фолієвої кислоти до рівня, смертельного для бактеріальної клітини. Через важливість фолієвої кислоти при внутрішньоутробному розвитку слід ретельно розглядати застосування сульфанідних препаратів і триметоприму під час ранньої вагітності.
Препарат ізоніазид є антиметаболітом зі специфічною токсичністю для мікобактерій і здавна застосовується в комбінації з рифампіном або стрептоміцином при лікуванні туберкульозу. Його вводять як пропрепарат, що вимагає активації за допомогою дії внутрішньоклітинного ферменту бактеріальної пероксидази, утворюючи ізоніазид-нікотинамід аденін-динуклеотид (NAD) та ізоніазид-нікотинамід аденіндинуклеотид фосфат (NADP), в кінцевому підсумку запобігаючи синтезу міколевої кислоти, яка необхідні для мікобактеріальних клітинних стінок. Можливі побічні ефекти застосування ізоніазиду включають гепатотоксичність, нейротоксичність та гематологічну токсичність (анемію).
| Метаболічний шлях Target | Механізм дії | Клас наркотиків | специфічні препарати | Спектр діяльності |
|---|---|---|---|---|
| Синтез фолієвої кислоти | Пригнічує фермент, який бере участь у виробленні дигідрофолієвої кислоти | Сульфаніламіди | Сульфаметоксазол | Широкий спектр дії проти грампозитивних і грамнегативних бактерій |
| Сульфони | Дапсон | |||
| Пригнічує фермент, який бере участь у виробленні тетрагідрофолієвої кислоти | Не застосовується | Триметоприм | Широкий спектр дії проти грампозитивних і грамнегативних бактерій | |
| Синтез міколевої кислоти | Перешкоджає синтезу міколевой кислоти | Не застосовується | Ізоніазид | Вузький спектр проти Mycobacterium spp., включаючи M. tuberculosis |
Вправа\(\PageIndex{5}\)
Як сульфаніламіди та триметоприм вибірково націлюються на бактерії?
Інгібітор АТФ-синтази
Бедаквілін, що представляє синтетичний антибактеріальний клас сполук під назвою діарилхінолони, використовує новий спосіб дії, який спеціально пригнічує ріст мікобактерій. Хоча специфічний механізм ще не з'ясований, ця сполука, здається, втручається у функцію синтаз АТФ, можливо, втручаючись у використання градієнта іонів водню для синтезу АТФ шляхом окислювального фосфорилювання, що призводить до зниження виробництва АТФ. Завдяки своїм побічним ефектам, включаючи гепатотоксичність і потенційно летальну аритмію серця, його застосування зарезервовано для серйозних, інакше не піддаються лікуванню випадків туберкульозу.
Клінічна спрямованість: Частина 2
Читаючи ретельну історію здоров'я Маріси, лікар помітив, що під час госпіталізації у В'єтнамі вона була катетеризована та отримала антимікробні препарати цефтазидиму та метронідазолу. Дізнавшись про це, лікар призначив КТ живота Маріси, щоб виключити апендицит; лікар також попросив аналіз крові, щоб перевірити, чи є у неї підвищений вміст лейкоцитів, і замовив аналіз сечі та культуру сечі, щоб шукати наявність лейкоцитів, еритроцитів та бактерій .
Зразок сечі Маріси повернувся позитивним на наявність бактерій, що свідчить про інфекцію сечовивідних шляхів (ІМП). Лікар призначив ципрофлоксацин. Тим часом її сечу культивували для вирощування бактерії для подальшого тестування.
Вправа\(\PageIndex{6}\)
- Які види протимікробних препаратів зазвичай призначають при ІМП?
- Виходячи з антимікробних препаратів, які їй дали у В'єтнамі, які з протимікробних препаратів для лікування ІМП ви б прогнозували бути неефективними?
Ключові поняття та резюме
- Антибактеріальні сполуки проявляють селективну токсичність, багато в чому завдяки відмінностям між прокаріотичною та еукаріотичною структурою клітин.
- Інгібітори синтезу клітинної стінки, включаючи β-лактами, глікопептиди та бацитрацин, перешкоджають синтезу пептидоглікану, роблячи клітини бактерій більш схильними до осмотичного лізису.
- Існують різноманітні інгібітори синтезу бактеріального білка широкого спектру дії, які вибірково націлені на прокаріотичну рибосому 70S, включаючи ті, що зв'язуються з субодиницею 30S (аміноглікозиди та тетрацикліни) та інші, які зв'язуються з субодиницею 50S (макроліди, лінкозаміди, хлорамфенікол та оксазолідинони).
- Поліміксини - це ліпофільні поліпептидні антибіотики, які націлені на ліпополісахаридний компонент грамнегативних бактерій і в кінцевому підсумку порушують цілісність зовнішніх і внутрішніх мембран цих бактерій.
- Інгібітори синтезу нуклеїнових кислот рифаміцини та фторхінолони націлені на транскрипцію РНК бактерій та реплікацію ДНК відповідно.
- Деякі антибактеріальні препарати є антиметаболітами, виступаючи в якості конкурентних інгібіторів бактеріальних метаболічних ферментів. Сульфаніламіди і триметоприм - антиметаболіти, які перешкоджають синтезу бактеріальної фолієвої кислоти. Ізоніазид - антиметаболіт, який перешкоджає синтезу міколівої кислоти в мікобактеріях.
