8.1: Енергія, матерія та ферменти
- Page ID
- 3937
Цілі навчання
- Визначте і опишіть метаболізм
- Порівняйте та контрастуйте автотрофи та гетеротрофи
- Охарактеризуйте важливість окислювально-відновних реакцій в обміні речовин
- Опишіть, чому ATP, FAD, NAD + та NADP + важливі в клітині
- Визначте структуру і структурні компоненти ферменту
- Охарактеризуйте відмінності між конкурентними та неконкурентними інгібіторами ферментів
Клінічна спрямованість: Частина 1
Ханна - 15-місячна дівчина з штату Вашингтон. Літо вона проводить у Гамбії, де її батьки працюють в неурядовій організації. Приблизно через 3 тижні після її приїзду до Гамбії апетит Ханни почав зменшуватися, і її батьки помітили, що вона здавалася надзвичайно млявою, втомленою і розгубленою. Вона також здавалася дуже дратівливою, коли була на відкритому повітрі, особливо вдень. Коли у неї почалася блювота, її батьки зрозуміли, що вона зловила 24-годинний вірус, але коли її симптоми збереглися, вони відвезли її до клініки. Місцевий лікар помітив, що рефлекси Ханни здаються аномально повільними, і коли він оглянув її очі світлом, вона здавалася надзвичайно світлочутливою. Вона також, здавалося, відчуває жорстку шию.
Вправа\(\PageIndex{1}\)
Які можливі причини симптомів Ханни?
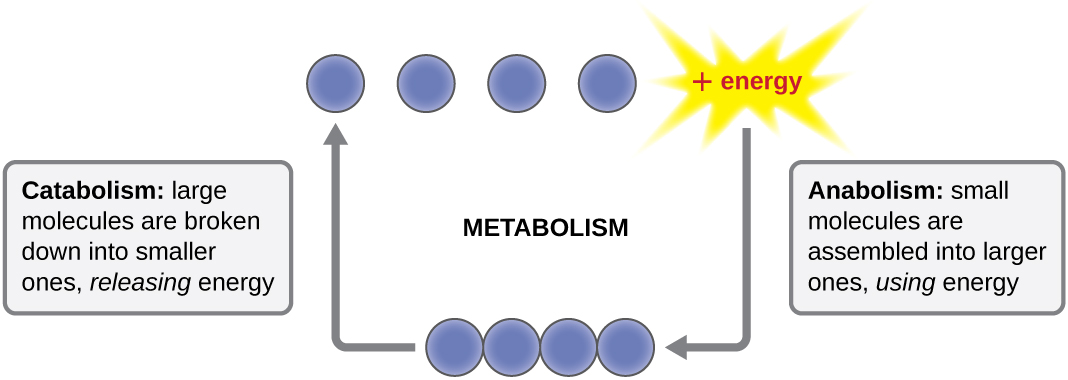
Термін, який використовується для опису всіх хімічних реакцій всередині клітини, - це метаболізм (рис.\(\PageIndex{1}\)). Клітинні процеси, такі як побудова або руйнування складних молекул, відбуваються через низку ступеневих, взаємопов'язаних хімічних реакцій, які називаються метаболічними шляхами. Реакції, які є спонтанними та енергією вивільнення, є ексергонічними реакціями, тоді як ендергонічні реакції вимагають енергії для продовження. Термін анаболізм відноситься до тих ендергонічних метаболічних шляхів, що беруть участь у біосинтезі, перетворюючи прості молекулярні будівельні блоки в більш складні молекули, і підживлюється використанням клітинної енергії. І навпаки, термін катаболізм відноситься до ексергонічних шляхів, які розщеплюють складні молекули на простіші. Молекулярна енергія, що зберігається в зв'язках складних молекул, вивільняється катаболічними шляхами і збирається таким чином, що її можна використовувати для отримання високоенергетичних молекул, які використовуються для руху анаболічних шляхів. Таким чином, з точки зору енергії і молекул клітини постійно балансують катаболізм з анаболізмом.
Класифікація за вуглецем та джерелом енергії
Організми можна ідентифікувати відповідно до джерела вуглецю, який вони використовують для обміну речовин, а також їх джерела енергії. Приставки auto- («self») і hetero- («інше») відносяться до походження джерел вуглецю, які можуть використовувати різні організми. Організми, які перетворюють неорганічний вуглекислий газ (СО 2) в органічні вуглецеві сполуки, є автотрофами. Рослини і ціанобактерії - відомі приклади автотрофів. І навпаки, гетеротрофи покладаються на більш складні органічні вуглецеві сполуки як поживні речовини; вони забезпечуються їм спочатку автотрофами. Багато організмів, починаючи від людини і закінчуючи багатьма прокаріотами, включаючи добре вивчену кишкову паличку, є гетеротрофними.
Організми також можна ідентифікувати за джерелом енергії, який вони використовують. Вся енергія виходить від перенесення електронів, але джерело електронів відрізняється між різними типами організмів. Приставки фото- («світло») і хіміо- («хімічні») відносяться до джерел енергії, які використовують різні організми. Ті, хто отримує свою енергію для перенесення електронів від світла, є фототрофами, тоді як хемотрофи отримують енергію для перенесення електронів шляхом розриву хімічних зв'язків. Існує два типи хемотрофів: органотрофи і літотрофи. Органотрофи, включаючи людину, гриби та багато прокаріоти, є хемотрофами, які отримують енергію з органічних сполук. Літотрофи («litho» означає «гірська порода») - хемотрофи, які отримують енергію з неорганічних сполук, включаючи сірководень (H 2 S) і відновлене залізо. Літотрофія унікальна для мікробного світу.
Стратегії, що використовуються для отримання як вуглецю, так і енергії, можуть бути об'єднані для класифікації організмів за типом харчування. Більшість організмів є хемогетеротрофами, оскільки вони використовують органічні молекули як джерела електронів, так і вуглецю. Таблиця\(\PageIndex{1}\) узагальнює цю та інші класифікації.
| Класифікації | Джерело енергії | Джерело вуглецю | Приклади | |
|---|---|---|---|---|
| Хемотрофи | Хемоавтотрофи | Хімічна | Неорганічні | Бактерії, що окислюють водень, сірку, залізо, азот та чадний газ |
| Хемогетеротрофи | Хімічна | Органічні сполуки | Всі тварини, більшість грибів, найпростіших і бактерій | |
| Фототрофи | Фотоавтотрофи | Світло | Неорганічні | Всі рослини, водорості, ціанобактерії та зелені та фіолетові сірчані бактерії |
| Фотогетеротрофи | Світло | Органічні сполуки | Зелені та фіолетові несірчані бактерії, геліобактерії | |
Вправа\(\PageIndex{2}\)
- Поясніть різницю між катаболізмом і анаболізмом.
- Поясніть різницю між автотрофами і гетеротрофами.
Окислення і зниження метаболізму
Перенесення електронів між молекулами має важливе значення, оскільки більша частина енергії, що зберігається в атомах і використовується для функцій паливних елементів, знаходиться у вигляді високоенергетичних електронів. Передача енергії у вигляді електронів дозволяє клітині передавати і використовувати енергію поступово; тобто в невеликих пакетах, а не в одиничному, руйнівному сплеску. Реакції, які видаляють електрони з донорських молекул, залишаючи їх окисленими, є реакціями окислення; ті, які додають електрони до молекул акцептора, залишаючи їх зменшеними, є реакціями відновлення. Оскільки електрони можуть переміщатися від однієї молекули до іншої, окислення і відновлення відбуваються в тандемі. Ці пари реакцій називаються окислювально-відновними реакціями, або окислювально-відновними реакціями.
Енергоносії: NAD +, NADP +, FAD та ATP
Енергія, що виділяється при розпаді хімічних зв'язків всередині поживних речовин, може зберігатися або за рахунок відновлення електронних носіїв, або в зв'язках аденозинтрифосфату (АТФ). У живих системах малий клас сполук функціонує як рухливі носії електронів, молекули, які зв'язуються з високоенергетичними електронами між сполуками в шляхах і шаткують їх між ними. Основні носії електронів, які ми розглянемо, походять з групи вітамінів групи В і є похідними нуклеотидів; це нікотинамід аденін-динуклеотид, нікотин аденін-динуклеотид фосфат і флавін аденин динуклеотид. Ці сполуки можна легко відновлювати або окислювати. Нікотинамід-аденіндинуклеотид (NAD +/NADH) є найпоширенішим рухомим носієм електронів, що використовується в катаболізмі. NAD + - окислена форма молекули; NADH - відновлена форма молекули. Нікотин аденін-динуклеотидфосфат (NADP +), окислена форма варіанту NAD +, що містить екстрафосфатну групу, є ще одним важливим носієм електронів; при зниженні він утворює НАДПГ. Окислена форма флавіну аденіндинуклеотиду є FAD, а його відновлена форма - FADH 2. Обидва NAD +/NADH і FAD/FADH 2 широко використовуються для екстракції енергії з цукрів під час катаболізму в хемогетеротрофах, тоді як NADP +/NADPH відіграє важливу роль в анаболічних реакціях і фотосинтезі. У сукупності FADH 2, NADH та NADPH часто називають зменшенням потужності через їх здатність здавати електрони різним хімічним реакціям.
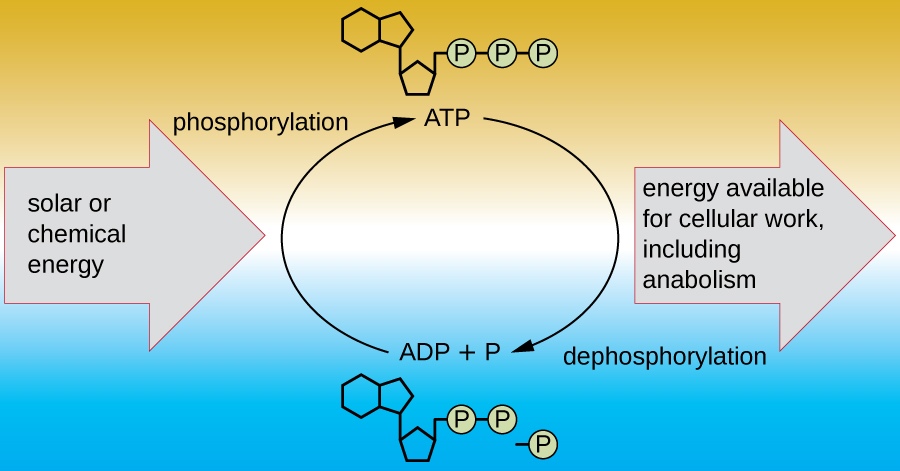
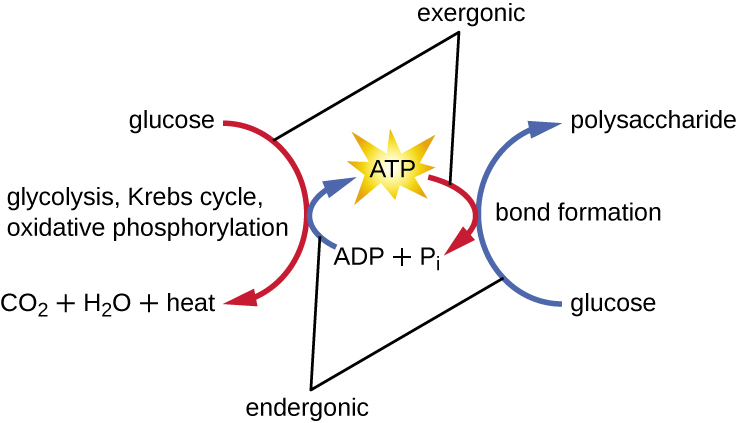
Жива клітина повинна мати можливість обробляти енергію, що виділяється під час катаболізму, таким чином, що дозволяє клітині безпечно зберігати енергію і вивільняти її для використання лише в міру необхідності. Живі клітини досягають цього за допомогою з'єднання аденозинтрифосфату (АТФ). АТФ часто називають «енергетичною валютою» клітини, і, як і валюта, це універсальне з'єднання може використовуватися для заповнення будь-якої енергетичної потреби клітини. В основі АТФ лежить молекула аденозинмонофосфату (АМФ), яка складається з молекули аденіну, пов'язаної з молекулою рибози, і єдиною фосфатною групою. Рибоза - це п'ятивуглецевий цукор, що міститься в РНК, а АМФ - один з нуклеотидів в РНК. Додавання другої фосфатної групи до цієї молекули ядра призводить до утворення аденозиндифосфату (АДФ); додавання третьої фосфатної групи утворює АТФ (рис.\(\PageIndex{2}\)). Додавання фосфатної групи до молекули, процес, який називається фосфорилювання, вимагає енергії. Фосфатні групи негативно заряджені і таким чином відштовхуються одна від одної, коли вони розташовані послідовно, оскільки вони знаходяться в АДФ і АТФ. Це відштовхування робить молекули АДФ і АТФ за своєю суттю нестабільними. Таким чином, зв'язки між фосфатними групами (одна в АДФ і дві в АТФ) називаються високоенергетичними фосфатними зв'язками. Коли ці високоенергетичні зв'язки розриваються, щоб вивільнити один фосфат (званий неорганічним фосфатом [P i]) або двох з'єднаних фосфатних груп (називається пірофосфат [PP i]) з АТФ за допомогою процесу, званого дефосфорилювання, енергія виділяється для приводу ендергонічних реакцій (рис.\(\PageIndex{3}\)).
Вправа\(\PageIndex{3}\)
Яка функція носія електронів?
Структура і функції ферменту
Речовина, що сприяє прискоренню хімічної реакції, є каталізатором. Каталізатори не використовуються і не змінюються під час хімічних реакцій і, отже, є багаторазовими. Тоді як неорганічні молекули можуть служити каталізаторами для широкого спектру хімічних реакцій, білки, звані ферментами, служать каталізаторами біохімічних реакцій всередині клітин. Таким чином, ферменти відіграють важливу роль у контролі клітинного метаболізму.
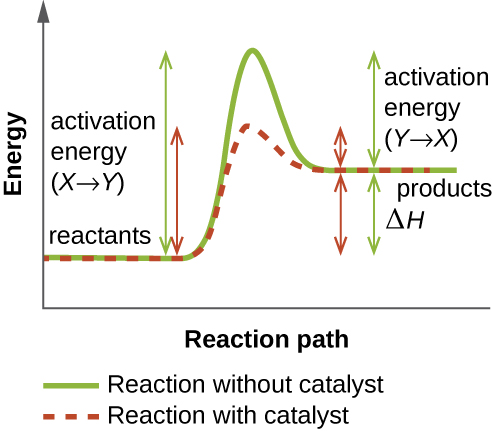
Фермент функціонує за рахунок зниження енергії активації хімічної реакції всередині клітини. Енергія активації - це енергія, необхідна для формування або розриву хімічних зв'язків і перетворення реагентів в продукти (рис.\(\PageIndex{4}\)). Ферменти знижують енергію активації шляхом зв'язування з молекулами реагенту і утримуючи їх таким чином, щоб прискорити реакцію.
Хімічні реагенти, з якими зв'язується фермент, називаються субстратами, а розташування всередині ферменту, де субстрат зв'язується, називається активною ділянкою ферменту. Характеристики амінокислот поблизу активної ділянки створюють дуже специфічне хімічне середовище всередині активної ділянки, що індукує придатність до зв'язування, хоча і коротко, з певним субстратом (або субстратами). Завдяки цій головоломці, як матч між ферментом і його субстратами, ферменти відомі своєю специфічністю. Насправді, оскільки фермент зв'язується зі своїм субстратом (ами), структура ферменту трохи змінюється, щоб знайти найкраще прилягання між перехідним станом (структурним проміжним продуктом між субстратом та продуктом) та активним місцем, подібно до того, як гумова рукавичка формує до руки, вставленої в неї. Ця активно-сайтова модифікація в присутності підкладки, поряд з одночасним утворенням перехідного стану, називається індукованим приляганням (рис.\(\PageIndex{5}\)). Загалом, існує спеціально підібраний фермент для кожного субстрату і, таким чином, для кожної хімічної реакції; однак, є певна гнучкість, а також. Деякі ферменти мають здатність впливати на кілька різних структурно пов'язаних субстратів.
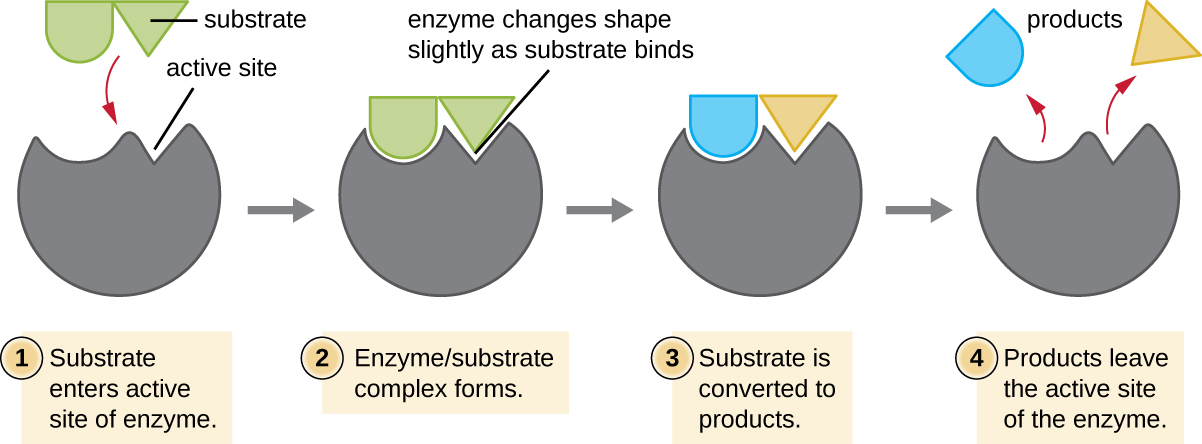
Ферменти схильні до впливу місцевих умов навколишнього середовища, таких як рН, концентрація субстрату та температура. Хоча підвищення температури навколишнього середовища, як правило, збільшує швидкість реакції, фермент каталізується або іншим чином, підвищення або зменшення температури поза оптимальним діапазоном може впливати на хімічні зв'язки всередині активної ділянки, роблячи їх менш придатними для зв'язування субстратів. Високі температури в кінцевому підсумку призведуть до денатурації ферментів, як і інших біологічних молекул, втрачаючи тривимірну структуру та функцію. Ферменти також підходять для найкращого функціонування в певному діапазоні рН, і, як і при температурі, екстремальні значення рН навколишнього середовища (кислі або основні) можуть спричинити денатурацію ферментів. Активні амінокислотні бічні ланцюги мають свої кислотні або основні властивості, які оптимальні для каталізу і, отже, чутливі до змін рН.
Іншим фактором, що впливає на активність ферменту, є концентрація субстрату: активність ферменту підвищується при більш високих концентраціях субстрату, поки він не досягне точки насичення, при якій фермент не може зв'язувати додатковий субстрат. Загалом, ферменти оптимізовані для найкращої роботи в умовах навколишнього середовища, в яких живуть організми, які їх виробляють. Наприклад, хоча мікроби, які населяють гарячі джерела, мають ферменти, які найкраще працюють при високих температурах, патогени людини мають ферменти, які найкраще працюють при 37° C. аналогічно, в той час як ферменти, що виробляються більшістю організмів, найкраще працюють при нейтральному рН, мікроби, що ростуть в кислих середовищах, роблять ферменти оптимізовані до низького рН умови, що дозволяють їх зростання в тих умовах.
Багато ферментів не працюють оптимально або навіть взагалі, якщо вони не пов'язані з іншими специфічними молекулами-помічниками, або тимчасово через іонні або водневі зв'язки, або постійно через більш міцні ковалентні зв'язки. Зв'язування з цими молекулами сприяє оптимальній конформації та функціонуванню відповідних ферментів. Два типи молекул - це кофактори та коферменти. Кофакторами є неорганічні іони, такі як залізо (Fe 2+) та магній (Mg 2+), які допомагають стабілізувати конформацію та функцію ферменту. Одним із прикладів ферменту, який потребує іона металу як кофактора, є фермент, який будує молекули ДНК, ДНК-полімеразу, для функціонування якої потрібен зв'язаний іон цинку (Zn 2+).
Коферменти - це органічні молекули-помічники, які необхідні для дії ферментів. Як і ферменти, вони не споживаються і, отже, багаторазові. Найпоширенішими джерелами коферментів є дієтичні вітаміни. Деякі вітаміни є попередниками коферментів, а інші діють безпосередньо як коферменти.
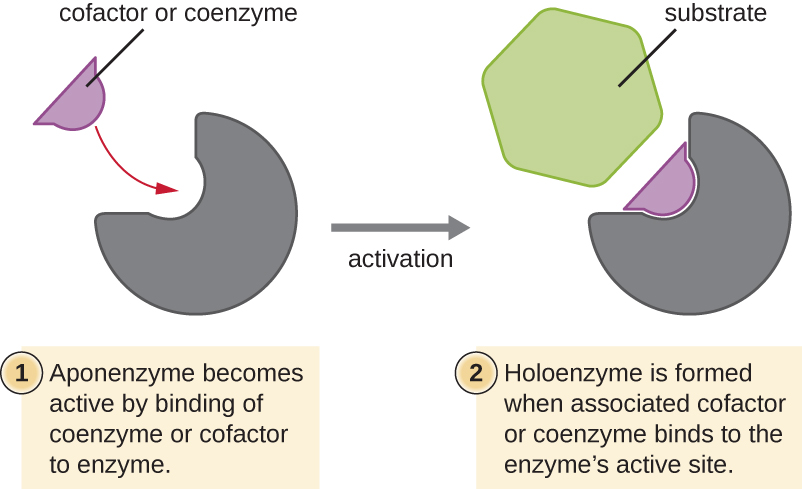
Деякі кофактори і коферменти, такі як коензим А (КоА), часто зв'язуються з активною ділянкою ферменту, допомагаючи в хімії переходу субстрату в продукт (рис.\(\PageIndex{6}\)). У таких випадках фермент, який не має необхідного кофактора або коферменту, називається апоферментом і є неактивним. І навпаки, фермент з необхідним асоційованим кофактором або коензимом називається холоензимом і є активним. NADH і АТФ також є прикладами часто використовуваних коферментів, які забезпечують високоенергетичні електрони або фосфатні групи відповідно, які зв'язуються з ферментами, тим самим активуючи їх.
Вправа\(\PageIndex{4}\)
Яку роль відіграють ферменти в хімічній реакції?
Інгібітори ферментів
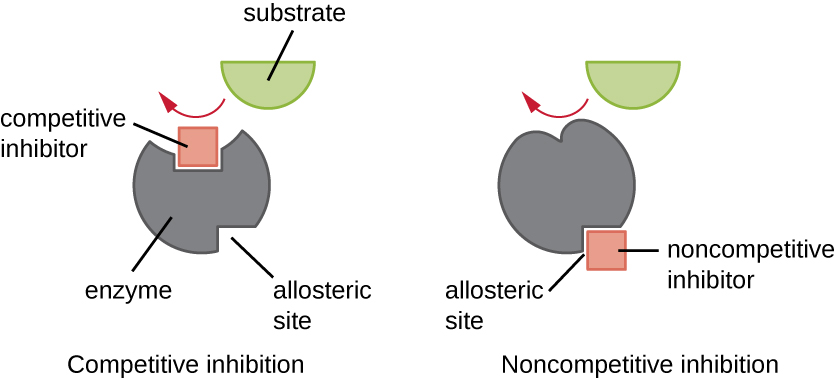
Ферменти можуть регулюватися способами, які або сприяють, або знижують їх активність. Існує багато різних видів молекул, які пригнічують або сприяють функції ферментів, і для цього існують різні механізми (рис.\(\PageIndex{7}\)). Конкурентний інгібітор - це молекула, досить схожа на субстрат, що може конкурувати з субстратом за зв'язування з активною ділянкою, просто блокуючи субстрат від зв'язування. Щоб конкурентний інгібітор був ефективним, концентрація інгібітора повинна бути приблизно дорівнює концентрації субстрату. Сульфанічні препарати є хорошим прикладом конкурентної конкуренції. Вони використовуються для лікування бактеріальних інфекцій, оскільки вони зв'язуються з активним місцем ферменту в межах шляху синтезу бактеріальної фолієвої кислоти. При наявності в достатній дозі препарат сульфату перешкоджає синтезу фолієвої кислоти, а бактерії не в змозі рости, оскільки не можуть синтезувати ДНК, РНК та білки. Люди не постраждали, оскільки ми отримуємо фолієву кислоту з наших дієт.
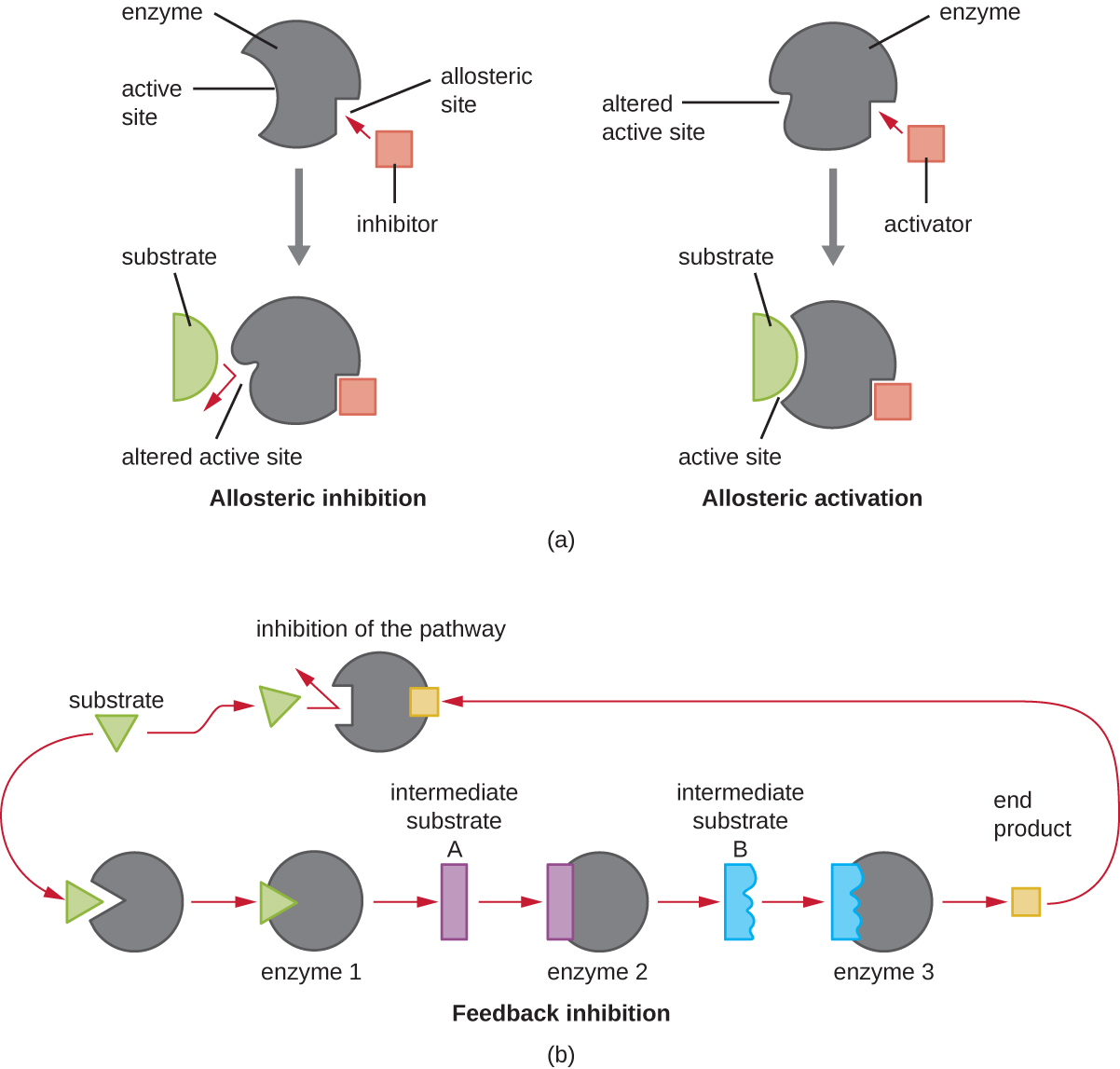
З іншого боку, неконкурентний (аллостеричний) інгібітор зв'язується з ферментом на аллостеричному місці, місці, відмінному від активного сайту, і все ще вдається блокувати зв'язування субстрату з активною ділянкою, індукуючи конформаційну зміну, яка зменшує спорідненість ферменту до його субстрату (рис. \(\PageIndex{8}\)). Оскільки для ефективного інгібування потрібна лише одна молекула інгібітора на фермент, концентрація інгібіторів, необхідних для неконкурентного інгібування, як правило, набагато нижча, ніж концентрація субстрату.
На додаток до алостеричних інгібіторів, існують аллостеричні активатори, які зв'язуються з місцями на ферменті далеко від активної ділянки, індукуючи конформаційну зміну, яка збільшує спорідненість активного сайту (ів) ферменту до його субстрату (ів).
Аллостеричний контроль є важливим механізмом регуляції метаболічних шляхів, що беруть участь як в катаболізмі, так і в анаболізмі. Найбільш ефективним і елегантним способом клітини еволюціонували також для використання продуктів власних метаболічних реакцій для зворотного інгібування активності ферментів. Інгібування зворотного зв'язку передбачає використання продукту шляху для регулювання власного подальшого виробництва. Клітина реагує на велику кількість конкретних продуктів уповільненням вироблення під час анаболічних або катаболічних реакцій (рис.\(\PageIndex{8}\)).
Вправа\(\PageIndex{5}\)
Поясніть різницю між конкурентним інгібітором і неконкурентним інгібітором.
Ключові поняття та резюме
- Метаболізм включає в себе хімічні реакції, що розщеплюють складні молекули (катаболізм) і ті, що будують складні молекули (анаболізм).
- Організми можуть бути класифіковані відповідно до їх джерела вуглецю. Автотрофи перетворюють неорганічний вуглекислий газ в органічний вуглець; гетеротрофи використовують фіксовані органічні вуглецеві сполуки.
- Організми також можуть бути класифіковані відповідно до їх джерела енергії. Фототрофи отримують свою енергію від світла. Хемотрофи отримують свою енергію з хімічних сполук. Органотрофи використовують органічні молекули, а літотрофи - неорганічні хімічні речовини.
- Клітинні носії електронів приймають високоенергетичні електрони з продуктів харчування і пізніше служать донорами електронів в наступних окислювально-відновних реакціях. FAD/FADH 2, NAD +/NADH та NADP + /NADPH є важливими носіями електронів.
- Аденозинтрифосфат (АТФ) служить енергетичною валютою клітини, безпечно зберігаючи хімічну енергію в двох високоенергетичних фосфатних зв'язках для подальшого використання для управління процесами, що вимагають енергії.
- Ферменти - це біологічні каталізатори, які збільшують швидкість хімічних реакцій всередині клітин за рахунок зниження енергії активації, необхідної для протікання реакції.
- У природі ексергонічні реакції не вимагають енергії, що перевищує енергію активації, щоб протікати, і вони вивільняють енергію. Вони можуть протікати без ферментів, але з повільною швидкістю. І навпаки, ендергонічні реакції вимагають енергії поза енергією активації, щоб відбутися. У клітині ендергонічні реакції з'єднуються з ексергонічними реакціями, що робить комбінацію енергетично сприятливою.
- Субстрати зв'язуються з активною ділянкою ферменту. Цей процес, як правило, змінює структури як активної ділянки, так і субстрату, сприяючи утворенню перехідного стану; це відомо як індуковане прилягання.
- Кофакторами є неорганічні іони, які стабілізують конформацію і функцію ферментів. Коферменти - це органічні молекули, необхідні для правильної функції ферментів і часто отримують з вітамінів. Фермент, який не має кофактора або коферменту, є апоферментом; фермент зі зв'язаним кофактором або коензимом - голофермент.
- Конкурентні інгібітори регулюють ферменти шляхом зв'язування з активною ділянкою ферменту, запобігаючи зв'язування субстра Неконкурентні (аллостеричні) інгібітори зв'язуються з аллостеричними сайтами, викликаючи конформаційну зміну ферменту, що перешкоджає його функціонуванню. Інгібування зворотного зв'язку відбувається, коли продукт метаболічного шляху неконкурентно зв'язується з ферментом на початку шляху, в кінцевому підсумку перешкоджаючи синтезу продукту.
