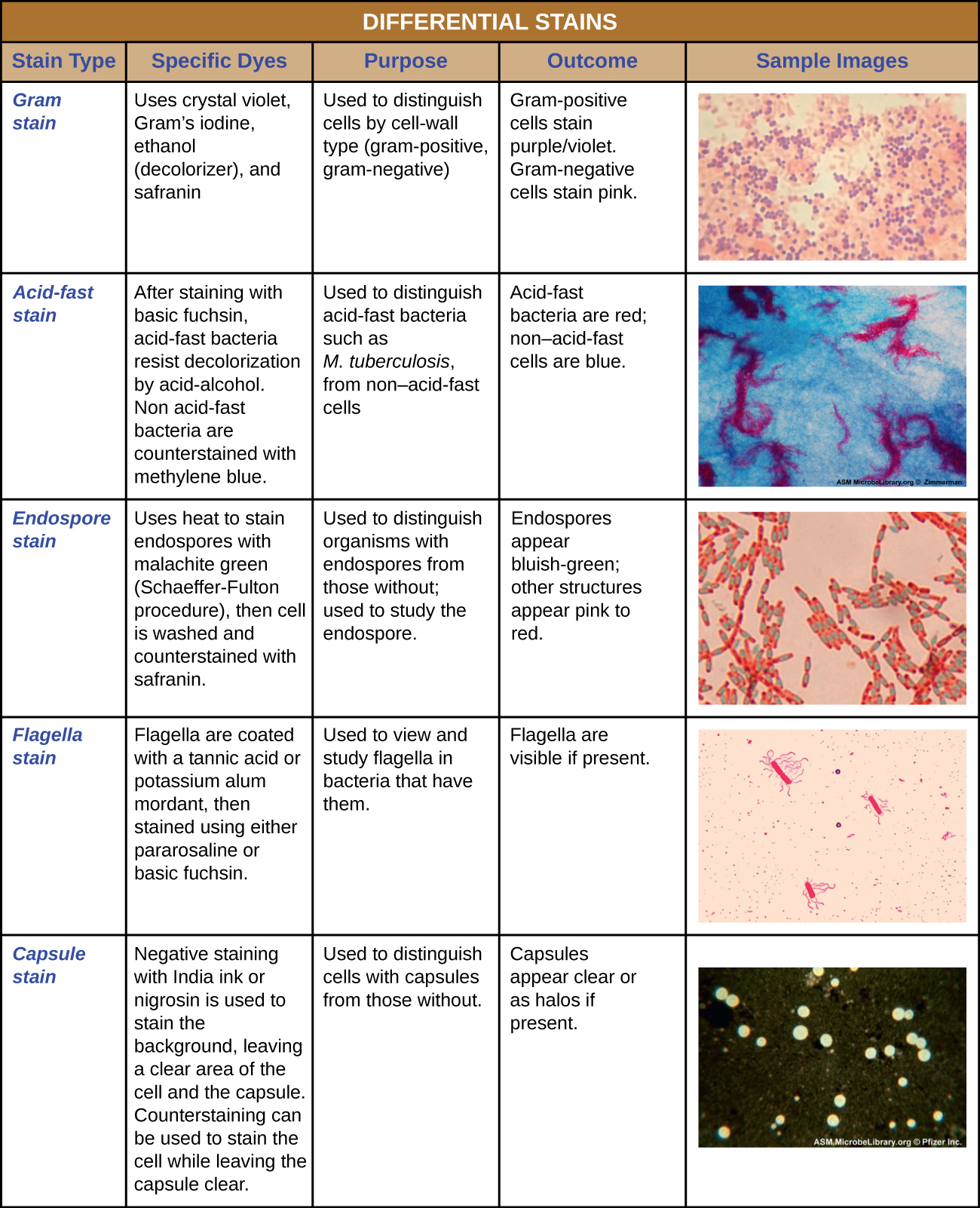
2.4: Фарбування мікроскопічних зразків
- Page ID
- 3981
Цілі навчання
- Розрізняйте прості та диференціальні плями
- Опишіть унікальні особливості часто використовуваних плям
- Поясніть процедури та назвіть клінічні програми для фарбування грам, ендоспор, кислотостійких, негативних капсул та джгутиків
У своєму природному стані більшість клітин і мікроорганізмів, які ми спостерігаємо під мікроскопом, не мають кольору і контрасту. Це ускладнює, якщо не неможливо, виявити важливі клітинні структури та їх відмінні характеристики без штучної обробки екземплярів. Ми вже натякали на певні прийоми, що включають плями і флуоресцентні барвники, і в цьому розділі ми більш детально обговоримо конкретні методики підготовки зразків. Дійсно, були розроблені численні методи для виявлення конкретних мікробів, клітинних структур, послідовностей ДНК або показників інфекції в зразках тканин під мікроскопом. Тут ми зупинимося на найбільш клінічно актуальних методиках.
Підготовка зразків до світлової мікроскопії
У клінічних умовах світлові мікроскопи є найбільш часто використовуваними мікроскопами. Існує два основних типи препарату, що використовуються для перегляду зразків за допомогою світлового мікроскопа: мокрі кріплення та фіксовані зразки.
Найпростіший вид приготування - мокре кріплення, при якому екземпляр поміщається на гірку в краплю рідини. Деякі екземпляри, такі як крапля сечі, вже знаходяться в рідкому вигляді і можуть відкладатися на гірці за допомогою крапельниці. Тверді зразки, такі як зішкріб шкіри, можна помістити на гірку перед додаванням краплі рідини для приготування мокрого кріплення. Іноді використовується рідина просто вода, але часто для посилення контрасту додають плями. Після того, як рідина була додана в слайд, зверху поміщається кришка, і зразок готовий до дослідження під мікроскопом.
Другий спосіб підготовки зразків до світлової мікроскопії - фіксація. «Закріплення» зразка відноситься до процесу кріплення осередків до гірки. Фіксація часто досягається або нагріванням (термофіксацією), або хімічною обробкою зразка. Крім кріплення зразка до гірки, фіксація також вбиває мікроорганізми в зразку, зупиняючи їх рух і обмін речовин, зберігаючи цілісність їх клітинних компонентів для спостереження.
Для теплової фіксації зразка на предметі викладають тонкий шар зразка (званий мазком), а потім слайд ненадовго нагрівають над джерелом тепла (рис.\(\PageIndex{1}\)). Хімічні фіксатори часто краще нагрівати для зразків тканин. Хімічні агенти, такі як оцтова кислота, етанол, метанол, формальдегід (формалін) та глутаральдегід, можуть денатурувати білки, зупиняти біохімічні реакції та стабілізувати клітинні структури в зразках тканин (рис.\(\PageIndex{1}\)).

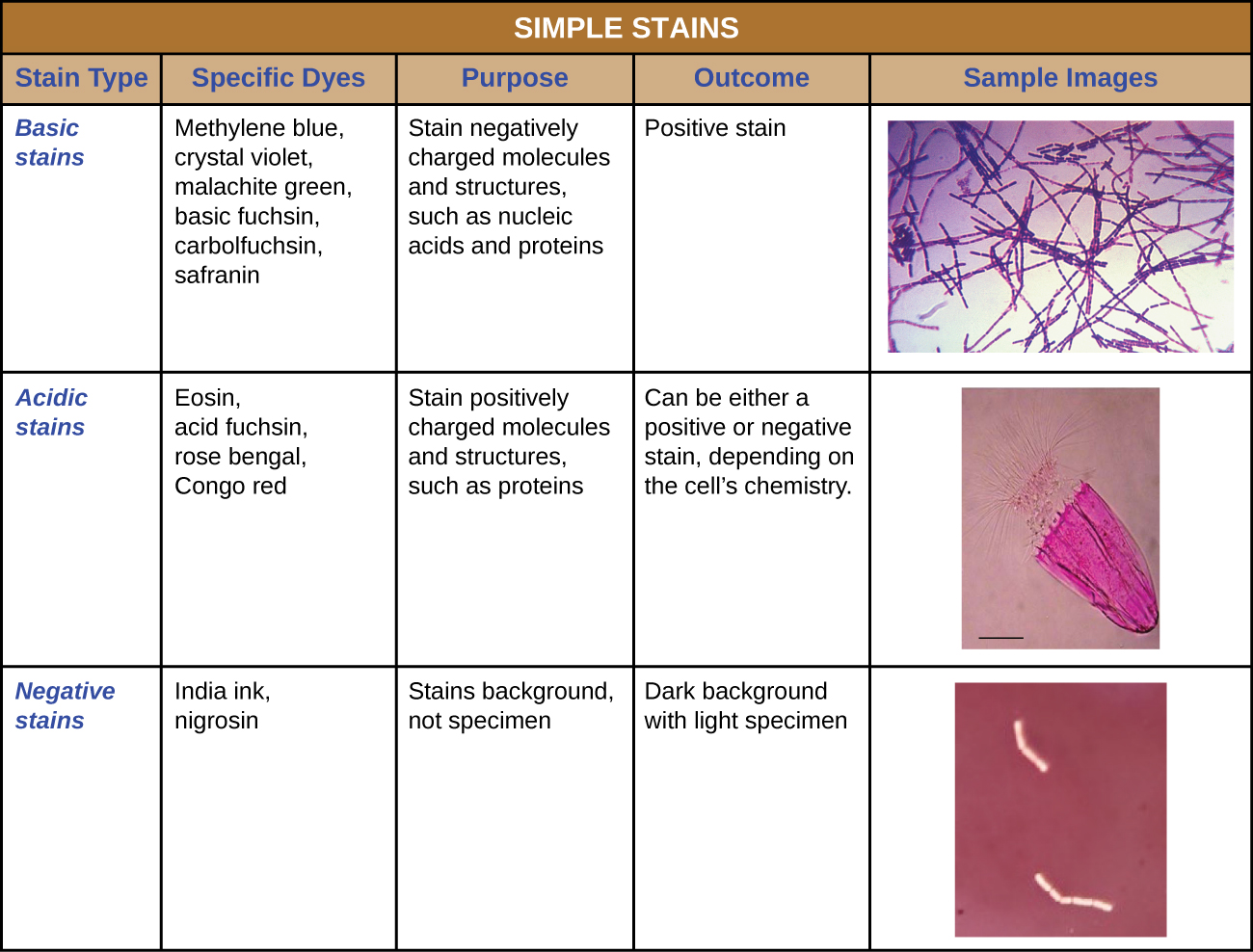
Крім фіксації, фарбування майже завжди наноситься на колір певних особливостей зразка перед дослідженням його під світловим мікроскопом. Плями, або барвники, містять солі, що складаються з позитивного іона та негативного іона. Залежно від типу барвника позитивним або негативним іоном може бути хромофор (кольоровий іон); інший, некольоровий іон називається контрійоном. Якщо хромофор є позитивно зарядженим іоном, пляма класифікується як основний барвник; якщо негативним іоном є хромофор, пляма вважається кислим барвником.
Барвники підбираються для фарбування виходячи з хімічних властивостей барвника і спостережуваного зразка, які визначають, як барвник буде взаємодіяти зі зразком. У більшості випадків переважно використовувати позитивну пляму, барвник, який поглинається спостережуваними клітинами або організмами, додаючи кольору предметам, що цікавлять, щоб вони виділялися на тлі. Однак є сценарії, в яких вигідно використовувати негативну пляму, яка поглинається фоном, але не клітинами або організмами зразка. Негативне фарбування виробляє контур або силует організмів на барвистому тлі (рис.\(\PageIndex{2}\)).

Оскільки клітини зазвичай мають негативно заряджені клітинні стінки, позитивні хромофори в основних барвниках, як правило, прилипають до клітинних стінок, роблячи їх позитивними плямами. Таким чином, зазвичай використовувані основні барвники, такі як основний фуксин, кристалічний фіолетовий, малахітовий зелений, метиленовий синій та сафранін, зазвичай служать позитивними плямами. З іншого боку, негативно заряджені хромофори в кислих барвниках відштовхуються негативно зарядженими клітинними стінками, роблячи їх негативними плямами. Зазвичай використовувані кислотні барвники включають кислоту фуксин, еозин та бенгальську троянду. Малюнок\(\PageIndex{10}\) надає більш детальну інформацію.
Деякі техніки фарбування передбачають нанесення тільки одного барвника на зразок; інші вимагають більше одного барвника. При простому фарбуванні використовується один барвник, щоб підкреслити окремі структури в зразку. Проста пляма, як правило, змушує всі організми в зразку здаватися однаковим кольором, навіть якщо зразок містить більше одного типу організму. На відміну від цього, диференціальне фарбуваннявідрізняє організми на основі їх взаємодії з множинними плямами. Іншими словами, два організми в диференційованому зразку можуть здаватися різними кольорами. Диференціальні методи фарбування, які зазвичай використовуються в клінічних умовах, включають фарбування за Грамом, кислотостійке фарбування, фарбування ендоспором, фарбування джгутиків та фарбування капсул. Малюнок\(\PageIndex{11}\) надає більш докладно про ці диференціальні техніки фарбування.
Вправа\(\PageIndex{1}\)
- Поясніть, чому важливо зафіксувати зразок перед переглядом його під світловим мікроскопом.
- Які типи зразків повинні бути хімічно закріплені на відміну від термофіксації?
- Чому кислотний барвник може реагувати по-різному з даним зразком, ніж основний барвник?
- Поясніть різницю між позитивним плямою і негативним плямою.
- Поясніть різницю між простим і диференціальним фарбуванням.
фарбування за грамом
Процедура фарбування Грама - це диференціальна процедура фарбування, яка включає в себе кілька етапів. Він був розроблений датським мікробіологом Гансом Крістіаном Грамом в 1884 році як ефективний метод розрізнення бактерій з різними типами клітинних стінок, і навіть сьогодні він залишається однією з найбільш часто використовуваних технік фарбування. Етапи процедури фарбування Грама перераховані нижче і проілюстровані на малюнку\(\PageIndex{3}\).
- Спочатку на термозакріплений мазок наносять кристалічну фіалку, первинну пляму, надаючи всім клітинам фіолетовий колір.
- Далі додається Грам-йод, морилка. Морилка - це речовина, яка використовується для встановлення або стабілізації плям або барвників; в цьому випадку йод Грама діє як уловлювальний агент, який комплексується з кристалічним фіолетовим, роблячи комплекс кристалічного фіолетово-йоду грудкою і залишається міститься в товстих шарах пептидоглікану в клітинних стінках.
- Далі додається знебарвлюючий засіб, зазвичай етанол або розчин ацетон/етанолу. Клітини, які мають товсті пептидогліканові шари в своїх клітинних стінках, набагато менше піддаються впливу знебарвлюючого агента; вони, як правило, зберігають кристалічний фіолетовий барвник і залишаються фіолетовими. Однак знебарвлюючий засіб легше вимиває барвник з клітин з більш тонкими шарами пептидоглікану, роблячи їх знову безбарвними.
- Нарешті, додається вторинне протистояння, як правило, сафранін. Це забарвлює знебарвлені клітини в рожевий колір і менш помітний в клітині, які все ще містять кристалічний фіолетовий барвник.
Фіолетові, кришталево-фіолетові забарвлені клітини називаються грампозитивними клітинами, тоді як червоні, пофарбовані сафраніном клітини - грамнегативними (рис.\(\PageIndex{4}\)). Однак є кілька важливих міркувань при інтерпретації результатів плями за Грамом. По-перше, старі бактеріальні клітини можуть мати пошкодження своїх клітинних стінок, що призводить до їх появи грамнегативних, навіть якщо вид грампозитивний. Таким чином, найкраще використовувати свіжі бактеріальні культури для фарбування по Граму. По-друге, такі помилки, як залишати на знебарвлювачі занадто довго, можуть вплинути на результати. У деяких випадках більшість клітин будуть здаватися грампозитивними, тоді як деякі виявляються грамнегативними (як на малюнку\(\PageIndex{4}\)). Це говорить про пошкодження окремих клітин або що знебарвлювач був залишений занадто довго; клітини все одно слід класифікувати як грампозитивні, якщо всі вони є одним і тим же видом, а не змішаною культурою.
Окрім їх різних взаємодій з барвниками та знебарвлюючими агентами, хімічні відмінності між грампозитивними та грамнегативними клітинами мають інші наслідки для клінічної актуальності. Наприклад, фарбування за Грамом може допомогти клініцистам класифікувати бактеріальні збудники в зразку на категорії, пов'язані з конкретними властивостями. Грамнегативні бактерії, як правило, більш стійкі до певних антибіотиків, ніж грампозитивні бактерії. Про це та інших сферах застосування фарбування по Граму ми розглянемо більш докладно в наступних розділах.
Вправа\(\PageIndex{2}\)
- Поясніть роль йоду Грама в процедурі фарбування Грама.
- Поясніть роль алкоголю в процедурі фарбування по Граму.
- Якого кольору мають грампозитивні і грамнегативні клітини, відповідно, після процедури фарбування по Граму?
Клінічна спрямованість: Частина 3
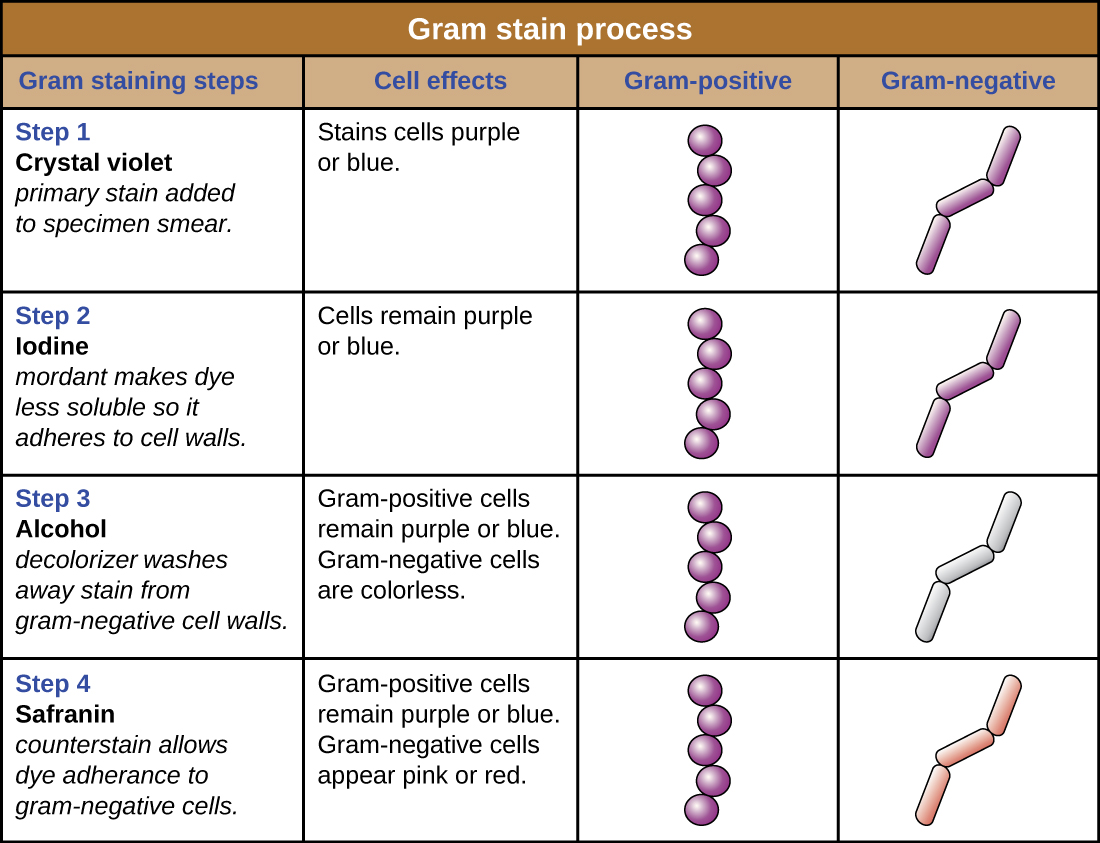
Перегляд зразка Сінді під мікроскопом темного поля надав техніку деякі важливі підказки про особу мікроба, що викликає її інфекцію. Однак для постановки остаточного діагнозу потрібна додаткова інформація. Технік вирішує зробити пляму за Грамом зразка. Ця методика зазвичай використовується в якості раннього етапу виявлення хвороботворних бактерій. Після завершення процедури фарбування за Грамом технік переглядає слайд під мікроскопом brightfield і бачить фіолетові, схожі на виноград скупчення сферичних клітин (рис.\(\PageIndex{5}\)).
Вправа\(\PageIndex{3}\)
- Чи є ці бактерії грампозитивними або грамнегативними?
- Що це показує про їх клітинних стінках?
Кислотні плями
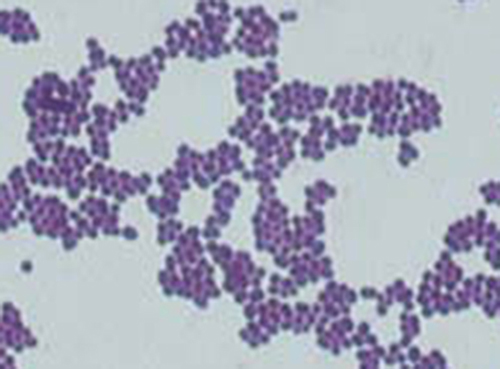
Кислотостійке фарбування - ще одна часто використовувана, диференціальна техніка фарбування, яка може бути важливим діагностичним інструментом. Кислотостійке пляма здатне диференціювати два типи грампозитивних клітин: ті, у яких в клітинних стінках є воскові міколеві кислоти, і ті, які цього не роблять. Два різних методу кислотостійкого фарбування - це техніка Ziehl-Neelsen і техніка Kinyoun. Обидва використовують карболфуксин як основну пляму. Воскоподібні кислотостійкі клітини зберігають карболфуксин навіть після нанесення знебарвлюючого агента (кислотно-спиртового розчину). Потім наноситься вторинне протистояння, метиленовий синій, який робить некислотостійкі клітини синіми.
Принципова відмінність двох методів на основі карболфуксину полягає в тому, чи використовується тепло в процесі первинного фарбування. Метод Ziehl-Neelsen використовує тепло для вливання карболфуксину в кислотостійкі клітини, тоді як метод Кінюна не використовує тепло. Обидві методики є важливими діагностичними інструментами, оскільки ряд специфічних захворювань викликається кислотостійкими бактеріями (АФБ). Якщо АФБ присутні в зразку тканини, то їх червоний або рожевий колір чітко видно на синьому тлі оточуючих клітин тканини (рис.\(\PageIndex{6}\)).
Вправа\(\PageIndex{4}\)
Чим корисні кислотостійкі плями?
Mycobacterium tuberculosis, бактерія, яка викликає туберкульоз, може бути виявлена в зразках на основі наявності кислотостійких бацил. Нерідко з зразка мокротиння пацієнта готують мазок, а потім фарбують за методикою Ziehl-Neelsen (рис.\(\PageIndex{6}\)). Якщо підтверджені кислотостійкі бактерії, їх, як правило, культивують для позитивної ідентифікації. Варіації цього підходу можуть бути використані як перший крок у визначенні наявності M. tuberculosis або інших кислотостійких бактерій, хоча зразки з інших місць в організмі (наприклад, сеча) можуть містити інші види Mycobacterium.
Альтернативним підходом для визначення наявності М. туберкульозу є імунофлюоресценція. У цій методиці мічені фторхромом антитіла зв'язуються з M. tuberculosis, якщо вони є Для перегляду мікобактерій за допомогою флуоресцентного мікроскопа можна використовувати специфічні для антитіла флуоресцентні барвники.
Фарбування капсул
Деякі бактерії та дріжджі мають захисну зовнішню структуру, яка називається капсулою. Оскільки наявність капсули безпосередньо пов'язане з вірулентністю мікроба (його здатністю викликати захворювання), здатність визначати, чи мають клітини зразка капсули, є важливим діагностичним інструментом. Капсули не вбирають більшість основних барвників, тому для фарбування капсул зазвичай використовується негативна техніка фарбування (фарбування навколо клітин). Барвник забарвлює фон, але не проникає в капсули, які виглядають як ореоли навколо кордонів клітини. Зразок не потребує термофіксації перед негативним фарбуванням.
Однією з поширених методів негативного фарбування для виявлення інкапсульованих дріжджів і бактерій є додавання декількох крапель індійської фарби або нігрозину до зразка. Інші капсульні плями також можуть бути використані для негативного фарбування інкапсульованих клітин (рис.\(\PageIndex{7}\)). Крім того, позитивні та негативні методи фарбування можна поєднувати для візуалізації капсул: позитивна пляма забарвлює тіло клітини, а негативна пляма забарвлює фон, але не капсулу, залишаючи ореол навколо кожної клітини.
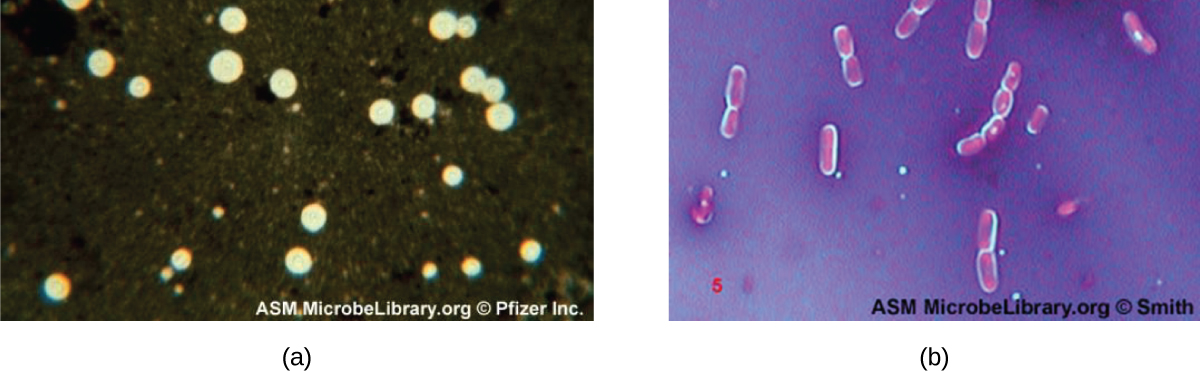
Вправа\(\PageIndex{5}\)
Як негативне фарбування допомагає нам візуалізувати капсули?
Ендоспорове фарбування
Ендоспори - це структури, що виробляються всередині певних бактеріальних клітин, які дозволяють їм виживати в суворих умовах. Одне фарбування за грамом не можна використовувати для візуалізації ендоспор, які здаються чіткими при перегляді клітин, забарвлених Грамом. Ендоспорове фарбування використовує два плями, щоб диференціювати ендоспори від решти клітини. Метод Шеффера-Фултона (найбільш часто використовувана техніка фарбування ендоспор) використовує тепло, щоб проштовхнути первинну пляму (малахітовий зелений) в ендоспору. Промивання водою знебарвлює клітку, але ендоспора зберігає зелену пляму. Потім клітина протиставляється рожевим сафраніном. Отримане зображення розкриває форму і розташування ендоспор, якщо вони присутні. Зелені ендоспори з'являться або всередині рожевих вегетативних клітин, або як окремо від рожевих клітин взагалі. Якщо ніяких ендоспор немає, то будуть видні тільки рожеві вегетативні клітини (рис.\(\PageIndex{8}\)).
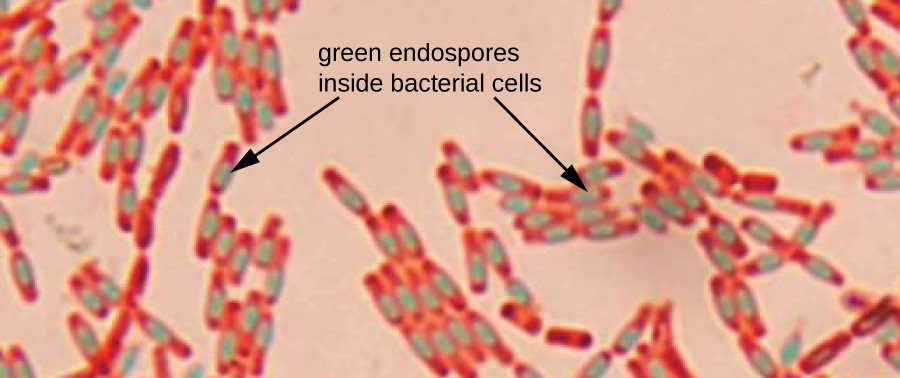
Методи фарбування ендоспор важливі для ідентифікації Bacillus і Clostridium, двох родів бактерій, що продукують ендоспору, які містять клінічно значущі види. Серед інших, B. anthracis (який викликає сибірську виразку) викликав особливий інтерес через занепокоєння тим, що його суперечки можуть бути використані як біотеррористичний агент. C. difficile є особливо важливим видом, відповідальним за типово набуту в лікарні інфекцію, відому як «C. diff».
Вправа\(\PageIndex{6}\)
Чи є ендоспорове фарбування прикладом позитивного, негативного або диференціального фарбування?
Фарбування джгутиків
Джгутики (сингулярні: джгутики) - це клітинні структури, схожі на хвіст, які використовуються для пересування деякими бактеріями, археями та еукаріотами. Оскільки вони настільки тонкі, джгутики зазвичай неможливо побачити під світловим мікроскопом без спеціалізованої техніки фарбування джгутиків. Фарбування джгутиків потовщує джгутики, спочатку застосовуючи морилку (як правило, дубильну кислоту, але іноді калієві квасці), яка покриває джгутики; потім зразок фарбують парарозаніліном (найчастіше) або основним фуксином (рис.\(\PageIndex{9}\)).
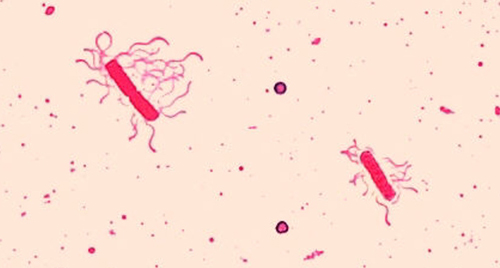
Хоча фарбування джгутиків є рідкістю в клінічних умовах, методика зазвичай використовується мікробіологами, оскільки розташування та кількість джгутиків можуть бути корисними при класифікації та ідентифікації бактерій у зразку. При використанні цієї техніки важливо поводитися з екземпляром з великою обережністю; джгутики - це делікатні структури, які легко пошкодити або стягнути, компрометуючи спроби точно знайти і підрахувати кількість джгутиків.
Підготовка зразків до електронної мікроскопії
Зразки для аналізу за допомогою ТЕА повинні мати дуже тонкі зрізи. Але клітини занадто м'які, щоб різати тонко, навіть алмазними ножами. Щоб розрізати клітини без пошкоджень, клітини повинні бути вбудовані в пластикову смолу, а потім зневоднені через ряд просочень в розчині етанолу (50%, 60%, 70% і так далі). Етанол замінює воду в клітині, а смола розчиняється в етанолі і потрапляє в клітину, де твердне. Далі тонкі зрізи вирізаються за допомогою спеціалізованого приладу під назвою ультрамікротом (рис.\(\PageIndex{12}\)). Нарешті, зразки закріплюються на дрібних мідних дротах або сітках з вуглецевого волокна і фарбуються - не кольоровими барвниками, а такими речовинами, як уранілацетат або тетроксид осмію, які містять атоми важких металів, щільні електронів.

Коли зразки готуються до перегляду за допомогою SEM, вони також повинні бути зневоднені з використанням серії етанолу. Однак вони повинні бути ще сухішими, ніж це необхідно для ТЕА. Критична точка сушіння інертним рідким вуглекислим газом під тиском використовується для витіснення води зі зразка. Після висихання зразки обприскують металом шляхом збивання атомів з паладієвої мішені, з енергетичними частинками. Розпилювальне покриття запобігає зарядженню зразків електронним пучком SEM.
Вправа\(\PageIndex{7}\)
- Чому важливо зневоднювати клітини перед тим, як досліджувати їх під електронним мікроскопом?
- Назвіть пристрій, який використовується для створення тонких зрізів зразків для електронної мікроскопії.
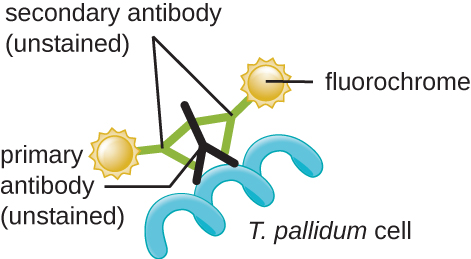
Збудником сифілісу є Treponema pallidum, гнучка спірохета (спірохета), яка може бути дуже тонкою (<0,15 мкм) і відповідати показнику заломлення середовища, що ускладнює перегляд за допомогою мікроскопії brightfield. Крім того, цей вид не був успішно культивований в лабораторії на штучному середовищі, тому діагностика залежить від успішної ідентифікації за допомогою мікроскопічних методів і серології (аналіз рідин організму, часто пошук антитіл до збудника). Оскільки фіксація та фарбування вбивають клітини, мікроскопія темного поля зазвичай використовується для спостереження за живими зразками та перегляду їх рухів. Однак можуть бути використані й інші підходи. Наприклад, клітини можуть бути потовщені частинками срібла (в ділянках тканин) і спостерігати за допомогою світлового мікроскопа. Також можна використовувати флуоресценцію або електронну мікроскопію для перегляду Трепонеми (рис.\(\PageIndex{13}\)).

У клінічних умовах для виявлення трепонеми часто використовується непряма імунофлюоресценція. Первинне, не забарвлене антитіло прикріплюється безпосередньо до поверхні збудника, а вторинні антитіла, «позначені» флуоресцентним плямою, прикріплюються до первинного антитіла. Кілька вторинних антитіл можуть приєднуватися до кожного первинного антитіла, посилюючи кількість плями, прикріпленого до кожної клітини трепонеми, полегшуючи їх виявлення (рис.\(\PageIndex{14}\)).
Підготовка та фарбування для інших мікроскопів
Зразки для флуоресценції і конфокальної мікроскопії готують аналогічно зразкам для світлової мікроскопії, за винятком того, що барвниками є флюорохроми. Плями часто розводять в рідині перед нанесенням на гірку. Деякі барвники приєднуються до антитіла для фарбування специфічних білків на конкретних типах клітин (імунофлюоресценція); інші можуть приєднуватися до молекул ДНК в процесі, який називається флуоресценцією in situ гібридизація (FISH), що призводить до фарбування клітин на основі того, чи мають вони певну послідовність ДНК.
Підготовка зразків для двофотонної мікроскопії аналогічна флуоресцентної мікроскопії, за винятком використання інфрачервоних барвників. Зразки для СТМ повинні знаходитися на дуже чистій і атомно гладкій поверхні. Вони часто мають слюду, покриту Au (111). Пари толуолу - поширений фіксатор.
Вправа\(\PageIndex{8}\)
У чому основна відмінність підготовки зразка до флуоресцентної мікроскопії від світлової мікроскопії?
Посилання на навчання
Тематичні дослідження Корнельського університету в мікроскопії пропонує низку клінічних проблем, заснованих на реальних подіях. Кожне тематичне дослідження проведе вас через клінічну проблему, використовуючи відповідні методи мікроскопії на кожному кроці.
Клінічна спрямованість: Дозвіл
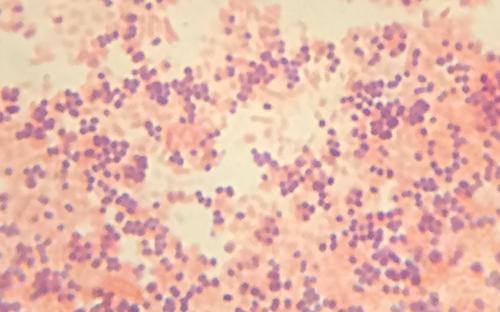
З результатів плями Грама технік тепер знає, що інфекція Сінді викликана сферичними грампозитивними бактеріями, які утворюють виноградні скупчення, що характерно для стафілококових бактерій. Після деякого додаткового тестування технік визначає, що ці бактерії є медично важливим видом, відомим як золотистий стафілокок, поширеним винуватцем ранових інфекцій. Оскільки деякі штами S. aureus стійкі до багатьох антибіотиків, шкірні інфекції можуть поширитися на інші ділянки тіла і стати серйозними, іноді навіть призводить до ампутацій або смерті, якщо не використовуються правильні антибіотики.
Після тестування декількох антибіотиків лабораторія здатна виявити той, який ефективний проти цього конкретного штаму S. aureus. Лікар Сінді швидко призначає ліки і підкреслює важливість прийому всього курсу антибіотиків, навіть якщо інфекція, як видається, проясниться до останньої запланованої дози. Це знижує ризик того, що будь-які особливо стійкі бактерії можуть вижити, спричинивши другу інфекцію або поширившись на іншу людину.
Оскільки використання антибіотиків поширилося в медицині, а також сільському господарстві, мікроби еволюціонували, щоб стати більш стійкими. Штами бактерій, таких як метицилін-резистентний S. aureus (MRSA), який розробив високий рівень стійкості до багатьох антибіотиків, є все більш тривожною проблемою, настільки, що ведуться дослідження з розробки нових і більш диверсифікованих антибіотиків.
Флуоресцентна мікроскопія може бути корисною для тестування ефективності нових антибіотиків проти стійких штамів, таких як MRSA. У тесті одного нового антибіотика, отриманого з морської бактерії, MC21-A (бромофен), дослідники використовували флуоресцентний барвник SYTOX Green для фарбування зразків MRSA. SYTOX Green часто використовується для відрізнення мертвих клітин від живих клітин, за допомогою флуоресцентної мікроскопії. Живі клітини не будуть вбирати барвник, але клітини, вбиті антибіотиком, поглинуть барвник, так як антибіотик пошкодив мембрану клітин бактерій. У цьому конкретному випадку, MRSA бактерії, які були піддані впливу MC21-A дійсно, з'являються зеленими під флуоресцентним мікроскопом, що призводить дослідників до висновку, що це ефективний антибіотик проти MRSA.
Звичайно, деякі стверджують, що розробка нових антибіотиків призведе лише до ще більш стійких до антибіотиків мікробів, так званих супербаків, які можуть породжувати епідемії до того, як будуть розроблені нові методи лікування. З цієї причини багато медичних працівників починають проявляти більше розсудливості при призначенні антибіотиків. Тоді як антибіотики колись регулярно призначалися при поширених захворюваннях без певного діагнозу, лікарі та лікарні набагато частіше проводять додаткове тестування, щоб визначити, чи необхідний і доцільний антибіотик перед призначенням.
Хворий пацієнт може розумно заперечити проти цього скупий підхід до призначення антибіотиків. Пацієнту, який просто хоче почувати себе краще якомога швидше, потенційні переваги прийому антибіотика можуть здатися переважують будь-які негайні ризики для здоров'я, які можуть виникнути, якщо антибіотик неефективний. Але в який момент ризики широкого застосування антибіотиків витісняють бажання використовувати їх в окремих випадках?
Ключові поняття та резюме
- Зразки повинні бути належним чином підготовлені до мікроскопії. Це може включати фарбування, фіксацію та/або вирізання тонких зрізів.
- При легкій мікроскопії можна використовувати найрізноманітніші техніки фарбування, включаючи фарбування по Граму, кислотостійке фарбування, фарбування капсул, фарбування ендоспором, фарбування джгутиками.
- Зразки для ТЕМ вимагають дуже тонких зрізів, тоді як зразки для SEM вимагають розпилювального покриття.
- Підготовка до флуоресцентної мікроскопії аналогічна тій, що для світлової мікроскопії, за винятком того, що використовуються флюорохроми.
