2.2: Хімічні зв'язки
- Page ID
- 8242
Те, як елементи взаємодіють один з одним, залежить від того, як влаштовані їх електрони і скільки отворів для електронів існує в крайній області, де електрони присутні в атомі. Електрони існують на енергетичних рівнях, які утворюють оболонки навколо ядра. Найближча оболонка може вмістити до двох електронів. Найближча оболонка до ядра завжди заповнюється першою, перш ніж будь-яка інша оболонка може бути заповнена. Водень має один електрон, отже, він має лише одну пляму, зайняту в межах найнижчої оболонки. Гелій має два електрони, отже, він може повністю заповнити найнижчу оболонку своїми двома електронами. Якщо ви подивитеся на таблицю Менделєєва, то побачите, що водень і гелій - єдині два елементи в першому ряду. Це тому, що вони мають лише електрони в першій оболонці. Водень і гелій - єдині два елементи, які мають найнижчу оболонку і ніяких інших оболонок.
Другий і третій енергетичні рівні можуть утримувати до восьми електронів. Вісім електронів розташовані в чотири пари, і одна позиція в кожній парі заповнюється електроном до завершення будь-яких пар.
Подивившись знову на таблицю Менделєєва (рис. 2.1.2), ви помітите, що рядків сім. Ці ряди відповідають кількості оболонок, які мають елементи в цьому рядку. Елементи в межах певного рядка мають зростаючу кількість електронів, оскільки стовпці йдуть зліва направо. Хоча кожен елемент має однакову кількість оболонок, не всі оболонки повністю заповнені електронами. Якщо подивитися на другий рядок таблиці Менделєєва, ви знайдете літій (Li), берилій (Be), бор (B), вуглець (C), азот (N), кисень (O), фтор (F) і неон (Ne). Всі вони мають електрони, які займають тільки першу і другу оболонки. Літій має лише один електрон у своїй зовнішній оболонці, берилій має два електрони, бор - три і так далі, поки вся оболонка не заповниться вісьмома електронами, як у випадку з неоном.
Не всі елементи мають достатньо електронів, щоб заповнити свої зовнішні оболонки, але атом є найбільш стабільним, коли всі позиції електронів у зовнішній оболонці заповнені. Через ці вакансії в крайніх оболонках ми бачимо утворення хімічних зв'язків або взаємодії між двома або більше однаковими або різними елементами, які призводять до утворення молекул. Для досягнення більшої стабільності атоми будуть, як правило, повністю заповнювати свої зовнішні оболонки і зв'яжуться з іншими елементами для досягнення цієї мети шляхом обміну електронами, приймаючи електрони від іншого атома або даруючи електрони іншому атому. Оскільки зовнішні оболонки елементів з низькими атомними номерами (аж до кальцію, з атомним номером 20) можуть містити вісім електронів, це називається правилом октету. Елемент може пожертвувати, приймати або ділитися електронами з іншими елементами, щоб заповнити свою зовнішню оболонку і задовольнити правило октету.
Коли атом не містить рівних чисел протонів і електронів, його називають іоном. Оскільки кількість електронів не дорівнює кількості протонів, кожен іон має чистий заряд. Позитивні іони утворюються при втраті електронів і називаються катіонами. Негативні іони утворюються при отриманні електронів і називаються аніонами.
Наприклад, натрій має лише один електрон у своїй зовнішній оболонці. Для пожертвування цього електрона натрію потрібно менше енергії, ніж для того, щоб прийняти ще сім електронів, щоб заповнити зовнішню оболонку. Якщо натрій втрачає електрон, він тепер має 11 протонів і лише 10 електронів, залишаючи його із загальним зарядом +1. Зараз його називають іоном натрію.
Атом хлору має сім електронів у зовнішній оболонці. Знову ж таки, хлор більш енергоефективний, щоб отримати один електрон, ніж втратити сім. Тому він прагне отримати електрон для створення іона з 17 протонами та 18 електронами, даючи йому чистий негативний (—1) заряд. Зараз його називають хлорид-іоном. Це рух електронів від одного елемента до іншого іменується перенесенням електронів. Як\(\PageIndex{1}\) показано на малюнку, атом натрію (Na) має лише один електрон у зовнішній оболонці, тоді як атом хлору (Cl) має сім електронів у зовнішній оболонці. Атом натрію пожертвує свій один електрон, щоб спорожнити свою оболонку, а атом хлору прийме цей електрон, щоб заповнити його оболонку, ставши хлоридом. Обидва іони тепер задовольняють правилу октету і мають повні зовнішні оболонки. Оскільки кількість електронів більше не дорівнює кількості протонів, кожен тепер є іоном і має +1 (натрій) або —1 (хлорид) заряд.
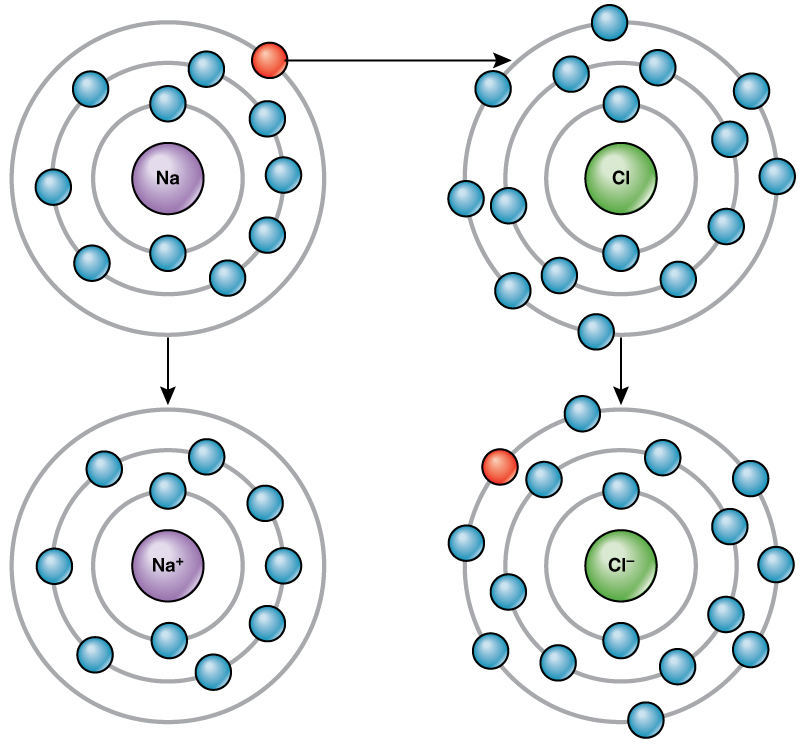
Іонні облігації
Існує чотири типи зв'язків або взаємодій: іонні, ковалентні, водневі зв'язки та взаємодії ван дер Ваальса. Іонні та ковалентні зв'язки - це сильні взаємодії, які вимагають більшого споживання енергії для розриву. Коли елемент дарує електрон зі своєї зовнішньої оболонки, як у прикладі атома натрію вище, утворюється позитивний іон (рис.\(\PageIndex{2}\)). Елемент, що приймає електрон, тепер негативно заряджений. Оскільки позитивні та негативні заряди притягуються, ці іони залишаються разом і утворюють іонний зв'язок або зв'язок між іонами. Елементи зв'язуються разом з електроном від одного елемента, залишаючись переважно з іншим елементом. Коли Na + і Cl — іони об'єднуються для отримання NaCl, електрон з атома натрію залишається з іншими сімома від атома хлору, а іони натрію і хлориду притягуються один до одного в решітці іонів з чистим нульовим зарядом.
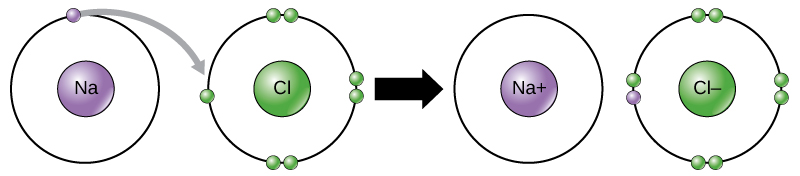
Ковалентні облігації
Інший тип міцного хімічного зв'язку між двома або більше атомами - ковалентний зв'язок. Ці зв'язки утворюються, коли електрон ділиться між двома елементами і є найсильнішою і найпоширенішою формою хімічного зв'язку в живих організмах. Ковалентні зв'язки утворюються між елементами, що складають біологічні молекули в наших клітині. На відміну від іонних зв'язків, ковалентні зв'язки не дисоціюються у воді.
Цікаво, що хіміки і біологи по-різному вимірюють міцність зв'язку. Хіміки вимірюють абсолютну міцність зв'язку (теоретичну міцність), тоді як біологів більше цікавить, як поводиться зв'язок в біологічній системі, яка зазвичай водна (на водній основі). У воді іонні зв'язки розходяться набагато легше, ніж ковалентні, тому біологи сказали б, що вони слабкіше ковалентних зв'язків. Якщо ви подивитеся в підручник з хімії, ви побачите щось інше. Це чудовий приклад того, як одна і та ж інформація може призвести до різних відповідей залежно від точки зору, з якої ви її переглядаєте.
Атоми водню та кисню, які об'єднуються, утворюючи молекули води, пов'язані між собою ковалентними зв'язками. Електрон від атома водню ділить свій час між зовнішньою оболонкою атома водню і неповною зовнішньою оболонкою атома кисню. Для повного заповнення зовнішньої оболонки атома кисню потрібні два електрони від двох атомів водню, звідси і індекс «2» в Н 2 О. Електрони діляться між атомами, розділяючи між ними свій час для «заповнення» зовнішньої оболонки кожного. Цей обмін є нижчим енергетичним станом для всіх задіяних атомів, ніж якби вони існували без їх зовнішніх оболонок, заповнених.
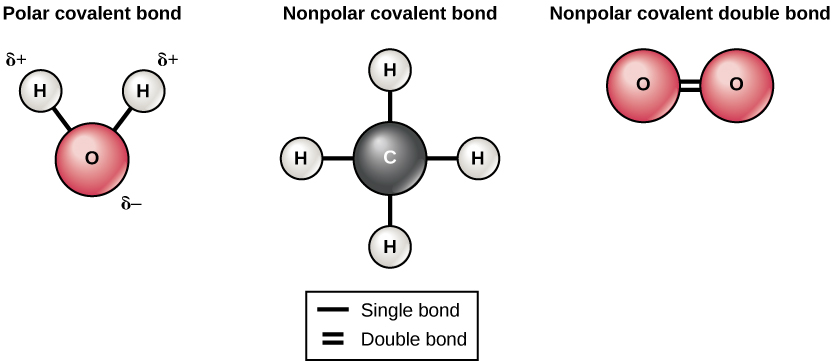
Існує два типи ковалентних зв'язків: полярні і неполярні. Неполярні ковалентні зв'язки утворюються між двома атомами одного елемента або між різними елементами, які поділяють електрони однаково. Наприклад, атом кисню може зв'язуватися з іншим атомом кисню, щоб заповнити їх зовнішні оболонки. Ця асоціація неполярна, оскільки електрони будуть рівномірно розподілені між кожним атомом кисню. Дві ковалентні зв'язки утворюються між двома атомами кисню, оскільки кисень вимагає двох спільних електронів, щоб заповнити її зовнішню оболонку. Атоми азоту утворюватимуть три ковалентні зв'язки (також звані потрійними ковалентними) між двома атомами азоту, оскільки кожному атому азоту потрібно три електрони, щоб заповнити свою зовнішню оболонку. Інший приклад неполярного ковалентного зв'язку знаходиться в молекулі метану (CH 4). Атом вуглецю має чотири електрони в своїй зовнішній оболонці і потребує ще чотирьох, щоб заповнити її. Він отримує ці чотири з чотирьох атомів водню, кожен атом забезпечує один. Всі ці елементи поділяють електрони однаково, створюючи чотири неполярні ковалентні зв'язку (рис.\(\PageIndex{3}\)).
У полярному ковалентному зв'язку електрони, що поділяються атомами, проводять більше часу ближче до одного ядра, ніж до іншого ядра. Через нерівномірного розподілу електронів між різними ядрами розвивається трохи позитивний (Δ+) або трохи негативний (δ—) заряд. Ковалентні зв'язки між атомами водню і кисню у воді є полярними ковалентними зв'язками. Спільні електрони проводять більше часу біля ядра кисню, віддаючи йому невеликий негативний заряд, ніж проводять поблизу ядер водню, віддаючи цим молекулам невеликий позитивний заряд.
водневі зв'язки
Іонні і ковалентні зв'язки - це міцні зв'язки, які вимагають значної енергії для розриву. Однак не всі зв'язки між елементами є іонними або ковалентними зв'язками. Можуть утворитися і слабші зв'язки. Це атракціони, які виникають між позитивними та негативними зарядами, які не вимагають багато енергії для розриву. Дві слабкі зв'язки, які часто трапляються, - це водневі зв'язки та взаємодії ван дер Ваальса. Ці зв'язки породжують унікальні властивості води і унікальні структури ДНК і білків.
Коли утворюються полярні ковалентні зв'язки, що містять атом водню, атом водню в цьому зв'язку має трохи позитивний заряд. Це пов'язано з тим, що спільний електрон сильніше тягнеться до іншого елемента і подалі від водневого ядра. Оскільки атом водню трохи позитивний (Δ+), він буде притягнутий до сусідніх негативних часткових зарядів (δ—). Коли це відбувається, відбувається слабка взаємодія між Δ+ зарядом атома водню однієї молекули і δ— зарядом іншої молекули. Така взаємодія називається водневим зв'язком. Цей тип зв'язку поширений; наприклад, рідка природа води обумовлена водневими зв'язками між молекулами води (рис.\(\PageIndex{4}\)). Водневі зв'язки надають воді унікальні властивості, які підтримують життя. Якби не водневий зв'язок, вода була б газом, а не рідиною кімнатної температури.
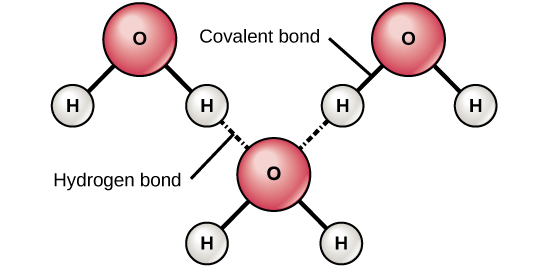
Водневі зв'язки можуть утворюватися між різними молекулами, і вони не завжди повинні включати молекулу води. Атоми водню в полярних зв'язках всередині будь-якої молекули можуть утворювати зв'язки з іншими сусідніми молекулами. Наприклад, водневі зв'язки утримують дві довгі нитки ДНК, щоб надати молекулі ДНК її характерну дволанцюгову структуру. Водневі зв'язки також відповідають за деяку тривимірну структуру білків.
ван дер Ваальса Взаємодії
Як і водневі зв'язки, взаємодії ван дер Ваальса є слабкими атракціонами або взаємодією між молекулами. Вони зустрічаються між полярними, ковалентно пов'язаними, атомами в різних молекулах. Деякі з цих слабких атракціонів викликані тимчасовими частковими зарядами, що утворюються при переміщенні електронів навколо ядра. Ці слабкі взаємодії між молекулами важливі в біологічних системах.
Запит\(\PageIndex{1}\)
ActivityЗапит\(\PageIndex{2}\)
ActivityПосилання
Якщо не зазначено інше, зображення на цій сторінці ліцензуються відповідно до CC-BY 4.0 OpenStax.
OpenStax, Концепції біології. OpenStax CNX. 22 березня 2017 року https://cnx.org/contents/s8Hh0oOc@9....cks-of-Molecul