2.3: Вода
- Page ID
- 8229

Ви коли-небудь замислювалися, чому вчені витрачають час на пошуки води на інших планетах? Це тому, що вода є важливою для життя; навіть незначні сліди її на іншій планеті можуть свідчити про те, що життя могло або існувало на цій планеті. Вода - одна з найбагатших молекул в живих клітині і найбільш критична для життя, як ми її знаємо. Приблизно 60-70 відсотків вашого тіла складається з води. Без неї життя просто не існувало б.
Вода Полярна
Атоми водню та кисню в молекулах води утворюють полярні ковалентні зв'язки. Спільні електрони проводять більше часу, пов'язаного з атомом кисню, ніж з атомами водню. Загального заряду молекули води немає, але є невеликий позитивний заряд на кожному атомі водню і невеликий негативний заряд на атомі кисню. Через ці заряди трохи позитивні атоми водню відштовхуються один від одного і утворюють унікальну форму. Кожна молекула води притягує інші молекули води через позитивні і негативні заряди в різних частинок молекули.
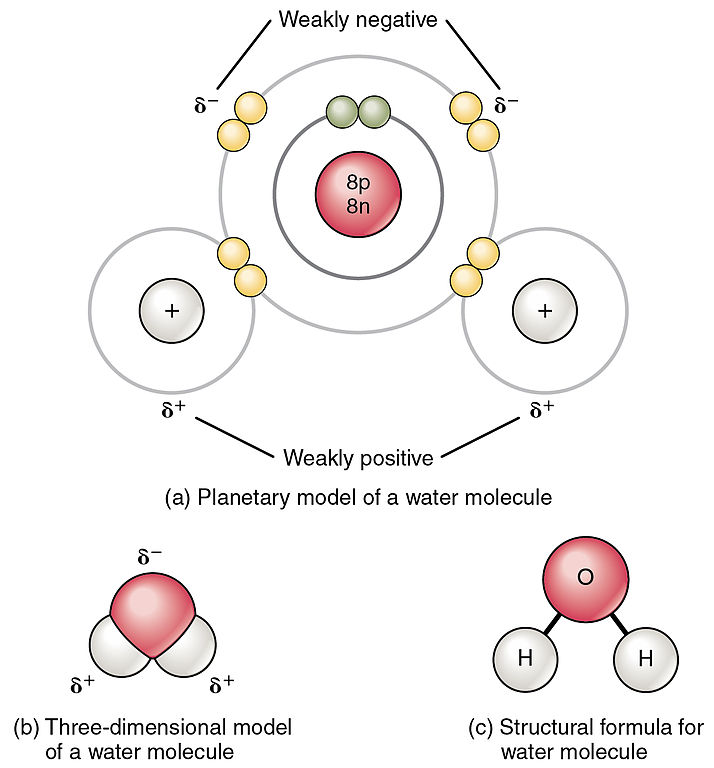
Вода також притягує інші полярні молекули (наприклад, цукри), утворюючи водневі зв'язки. Коли речовина легко утворює водневі зв'язки з водою, воно може розчинятися у воді і називається гідрофільним («водолюбний»). Водневі зв'язки не легко утворюються з неполярними речовинами, такими як масла і жири (рис.\(\PageIndex{3}\)). Ці неполярні сполуки гідрофобні («бояться води») і не розчиняються у воді.

Вода стабілізує температуру
Водневі зв'язки у воді дозволяють їй поглинати і виділяти теплову енергію повільніше, ніж багато інших речовин. Температура - це міра руху (кінетичної енергії) молекул. Зі збільшенням руху енергія стає вищою і, таким чином, температура вище. Вода поглинає багато енергії до того, як її температура підвищиться. Підвищена енергія порушує водневі зв'язки між молекулами води. Оскільки ці зв'язки можуть створюватися і порушуватися швидко, вода поглинає збільшення енергії і зміни температури лише мінімально. Це означає, що вода помірковує зміни температури всередині організмів і в їх середовищах. Оскільки енергія триває, баланс між утворенням водневих зв'язків та руйнуванням коливається у бік руйнування. Більше зв'язків розривається, ніж утворюється. Цей процес призводить до виділення окремих молекул води на поверхні рідини (наприклад, водойми, листя рослини або шкіри організму) у процесі, який називається випаровуванням. Випаровування поту, який становить 90 відсотків води, дозволяє охолоджувати організм, оскільки розрив водневих зв'язків вимагає введення енергії і забирає тепло від тіла.
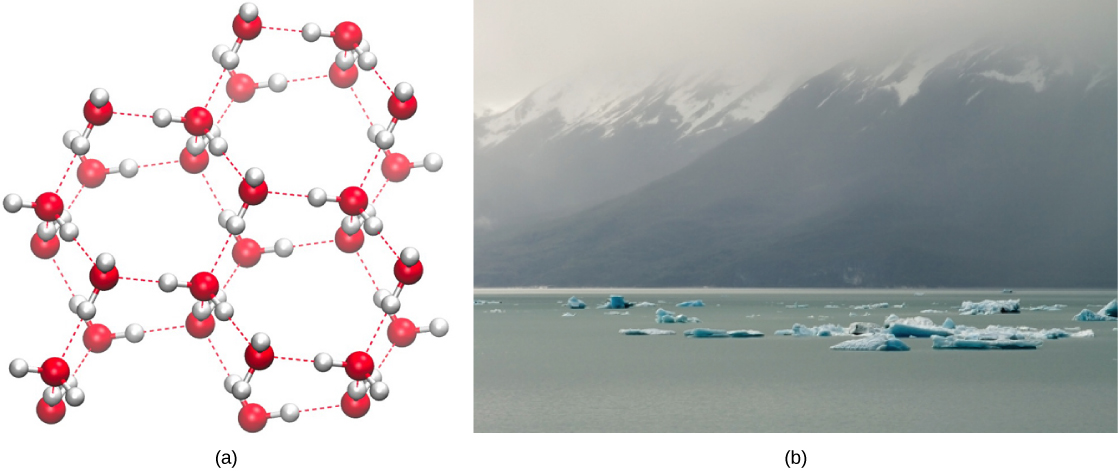
І навпаки, коли молекулярний рух зменшується і температура падає, менше енергії присутній для розриву водневих зв'язків між молекулами води. Ці зв'язки залишаються недоторканими і починають утворювати жорстку, схожу на решітку структуру (наприклад, лід) (рис\(\PageIndex{4}\). При заморожуванні лід менш щільний, ніж рідка вода (молекули знаходяться далі один від одного). Це означає, що лід плаває на поверхні водойми (рис.\(\PageIndex{4}\) Б). В озерах, ставках та океанах лід утворюватиметься на поверхні води, створюючи ізоляційний бар'єр для захисту тваринного та рослинного життя внизу від замерзання у воді. Якби цього не сталося, рослини і тварини, що живуть у воді, замерзали б в брилі льоду і не могли вільно рухатися, ускладнюючи або неможливим життя при холодних температурах.
Вода - відмінний розчинник
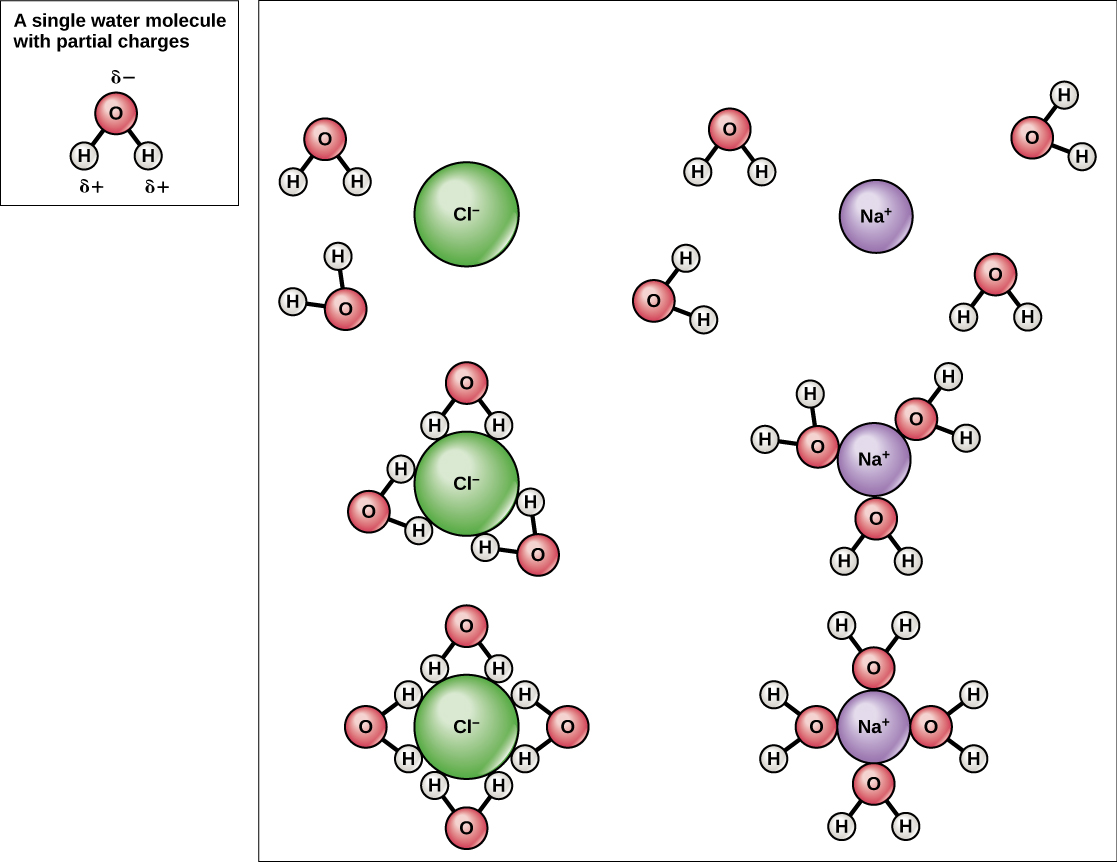
Оскільки вода полярна, з невеликими позитивними і негативними зарядами, іонні сполуки і полярні молекули можуть легко розчинятися в ній. Отже, вода називається розчинником - речовиною, здатною розчиняти іншу речовину. Заряджені частинки утворюватимуть водневі зв'язки з навколишнім шаром молекул води. Це називається сферою гідратації і служить для утримання частинок відокремлених або диспергованих у воді. У разі кухонної солі (NaCl), змішаної у воді (рис.\(\PageIndex{5}\)), іони натрію і хлориду розділяються або дисоціюють у воді, а навколо іонів утворюються сфери гідратації. Позитивно заряджений іон натрію оточений частково негативними зарядами атомів кисню в молекулах води. Негативно заряджений іон хлориду оточений частково позитивними зарядами атомів водню в молекулах води. Ці сфери гідратації також називають гідратаційними оболонками. Полярність молекули води робить її ефективним розчинником і має важливе значення в багатьох її ролей в живих системах.
Вода є згуртованою
Ви коли-небудь доливали склянку води до самого верху, а потім повільно додавали ще кілька крапель? Перш ніж вона переливається, вода фактично утворює куполоподібну форму над обідком скла. Ця вода може залишатися над склом через властивість згуртованості. У згуртованості молекули води притягуються один до одного (через водневий зв'язок), утримуючи молекули разом на межі розділу рідина-повітря (газ), хоча в склі більше немає місця. Згуртованість породжує поверхневий натяг, здатність речовини протистояти розриву при розміщенні під напругою або напругою. Коли ви опускаєте невеликий клаптик паперу на крапельку води, папір плаває поверх крапельки води, хоча предмет щільніше (важче), ніж вода. Це відбувається через поверхневого натягу, яке створюється молекулами води. Згуртованість і поверхневий натяг зберігають молекули води недоторканими, а елемент плаває зверху. Можна навіть «спливати» сталевою голкою поверх склянки води, якщо розташувати її акуратно, не порушуючи поверхневого натягу (рис.\(\PageIndex{6}\)).

Ці сили зчеплення також пов'язані з властивістю води адгезії або тяжіння між молекулами води та іншими молекулами. Це спостерігається, коли вода «піднімається» вгору по соломинці, поміщеної в склянку з водою. Ви помітите, що вода, здається, вище з боків соломи, ніж посередині. Це пояснюється тим, що молекули води притягуються до соломи і тому прилипають до неї.
Згуртовані та адгезійні сили важливі для підтримки життя. Наприклад, через цих сил вода може стікати від коренів до верхівок рослин, щоб підгодувати рослину.
Запит\(\PageIndex{1}\)
ActivityПосилання
Якщо не зазначено інше, зображення на цій сторінці ліцензуються відповідно до CC-BY 4.0 OpenStax.
OpenStax, Концепції біології. OpenStax CNX. 22 березня 2017 року https://cnx.org/contents/s8Hh0oOc@9....0BfSb7@4/Water