2.1: Атоми
- Page ID
- 8228
Атом - найменший компонент елемента, який зберігає всі хімічні властивості цього елемента. Наприклад, один атом водню має всі властивості елемента водню, наприклад, він існує як газ при кімнатній температурі, і він зв'язується з киснем для створення молекули води. Атоми водню не можна розбити на щось менше, зберігаючи при цьому властивості водню. Якби атом водню був розбитий на субатомні частинки, він більше не мав би властивостей водню.
Всі атоми містять протони, електрони і нейтрони (рис.\(\PageIndex{1}\)). Виняток становить лише водень (Н), який зроблений з одного протона і одного електрона. Протон - це позитивно заряджена частинка, яка знаходиться в ядрі (ядрі атома) атома і має масу 1 і заряд +1. Електрон - це негативно заряджена частинка, яка подорожує в просторі навколо ядра. Іншими словами, він знаходиться поза ядром. Він має мізерно малу масу і має заряд -1.
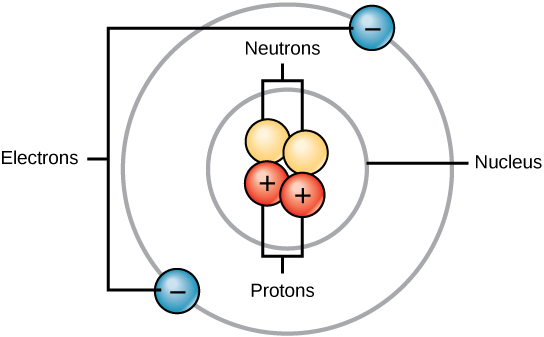
Нейтрони, як і протони, мешкають в ядрі атома. Мають масу 1 і не заряджають. Позитивний (протони) і негативний (електрони) заряди врівноважують один одного в нейтральному атомі, який має чистий нульовий заряд.
Оскільки протони та нейтрони мають масу 1, маса атома дорівнює кількості протонів і нейтронів цього атома. Кількість електронів не враховується в загальну масу, тому що їх маса настільки мала.
Запит\(\PageIndex{1}\)
ActivityНа самому базовому рівні всі організми складаються з комбінації елементів. Елемент - це речовина, атоми якого мають однакову кількість протонів. Вони містять атоми, які об'єднуються разом, утворюючи молекули. У багатоклітинних організмах, таких як тварини, молекули можуть взаємодіяти, утворюючи клітини, які об'єднуються, утворюючи тканини, що складають органи. Ці комбінації тривають до тих пір, поки не утворюються цілі багатоклітинні організми.
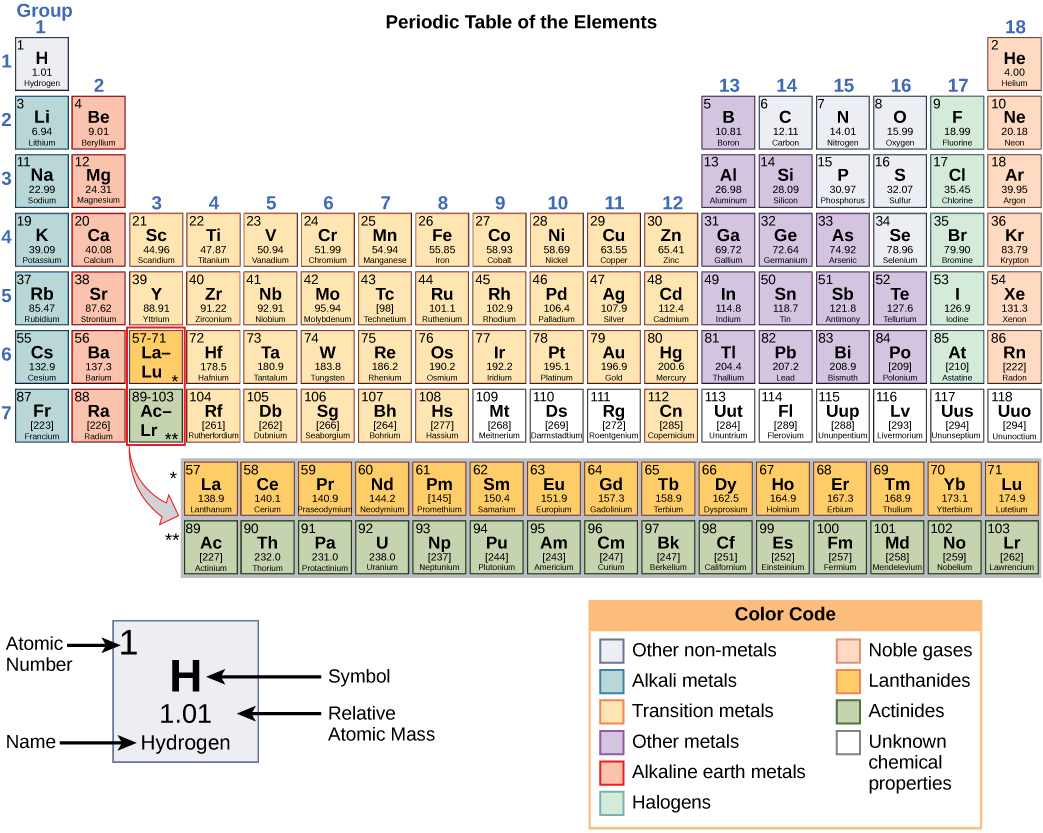
Кожен елемент має свої унікальні властивості. Кожен містить різну кількість протонів і нейтронів, що дають йому свій атомний номер і масовий номер. Атомний номер елемента дорівнює кількості протонів, які містить елемент. Масове число, або атомна маса, - це кількість протонів плюс кількість нейтронів цього елемента. Тому визначити кількість нейтронів можна, віднімаючи атомний номер з числа маси.
Ці цифри дають інформацію про елементи і про те, як вони будуть реагувати при поєднанні. Різні елементи мають різну температуру плавлення і кипіння, і знаходяться в різних станах (рідкому, твердому або газовому) при кімнатній температурі. Вони також поєднуються по-різному. Одні утворюють конкретні типи облігацій, тоді як інші - ні. Те, як вони поєднуються, базується на кількості присутніх електронів. Через цих характеристик елементи розташовані в періодичну таблицю елементів, діаграму елементів, яка включає атомний номер і відносну атомну масу кожного елемента. У таблиці Менделєєва також представлена ключова інформація про властивості елементів (рис.\(\PageIndex{2}\)) —часто позначається кольоровим кодуванням. Розташування таблиці також показує, як організовані електрони в кожному елементі і надає важливі деталі про те, як атоми будуть реагувати один з одним, утворюючи молекули.
Ізотопи - це різні форми одного і того ж елемента, які мають однакову кількість протонів, але різну кількість нейтронів. Деякі елементи, такі як вуглець, калій та уран, мають природні ізотопи. Вуглець-12, найпоширеніший ізотоп вуглецю, містить шість протонів і шість нейтронів. Тому він має масове число 12 (шість протонів і шість нейтронів) і атомний номер 6 (що робить його вуглецевим). Вуглець-14 містить шість протонів і вісім нейтронів. Тому він має масове число 14 (шість протонів і вісім нейтронів) і атомний номер 6, що означає, що це все ще елемент вуглецю. Ці дві альтернативні форми вуглецю - ізотопи. Деякі ізотопи нестабільні і втрачають протони, інші субатомні частинки або енергію для утворення більш стабільних елементів. Вони називаються радіоактивними ізотопами або радіоізотопами.
Запит\(\PageIndex{2}\)
ActivityЕволюція в дії: Вуглецеві датування
Вуглець-14 (14 С) - це природний радіоізотоп, який створюється в атмосфері космічними променями. Це безперервний процес, тому завжди створюється більше 14 С. У міру розвитку живого організму відносний рівень 14 С в його організмі дорівнює концентрації 14 С в атмосфері. Коли організм помирає, він більше не проковтує 14 С, тому співвідношення знизиться. 14 C розпадається до 14 Н шляхом процесу, який називається бета-розпадом; він виділяє енергію в цьому повільному процесі.
Приблизно через 5,730 років лише половина початкової концентрації 14 С буде перетворена в 14 Н. Час, необхідний половині початкової концентрації ізотопу для розпаду до більш стабільної форми, називається його період напіврозпаду. Оскільки період напіврозпаду 14 С тривалий, він використовується для старіння раніше живих об'єктів, таких як скам'янілості. Використовуючи відношення виявленої в об'єкті концентрації 14 С до кількості 14 С, виявленої в атмосфері, можна визначити кількість ізотопу, який ще не розпався. Виходячи з цієї кількості, вік викопного можна обчислити приблизно до 50 000 років (рис.\(\PageIndex{3}\)). Ізотопи з більш тривалим періодом напіврозпаду, такі як калій-40, використовуються для розрахунку віку старих скам'янілостей. Завдяки використанню вуглецевого датування вчені можуть реконструювати екологію та біогеографію організмів, що живуть протягом останніх 50 000 років.

Запит\(\PageIndex{3}\)
ActivityПосилання
Якщо не зазначено інше, зображення на цій сторінці ліцензуються відповідно до CC-BY 4.0 OpenStax.
OpenStax, Концепції біології. OpenStax CNX. 22 березня 2017 року https://cnx.org/contents/s8Hh0oOc@9....s-of-Molecules