4.3: Бібліотеки відображення фагів M13
- Page ID
- 7512
Мікробні системи для експериментальної молекулярної еволюції
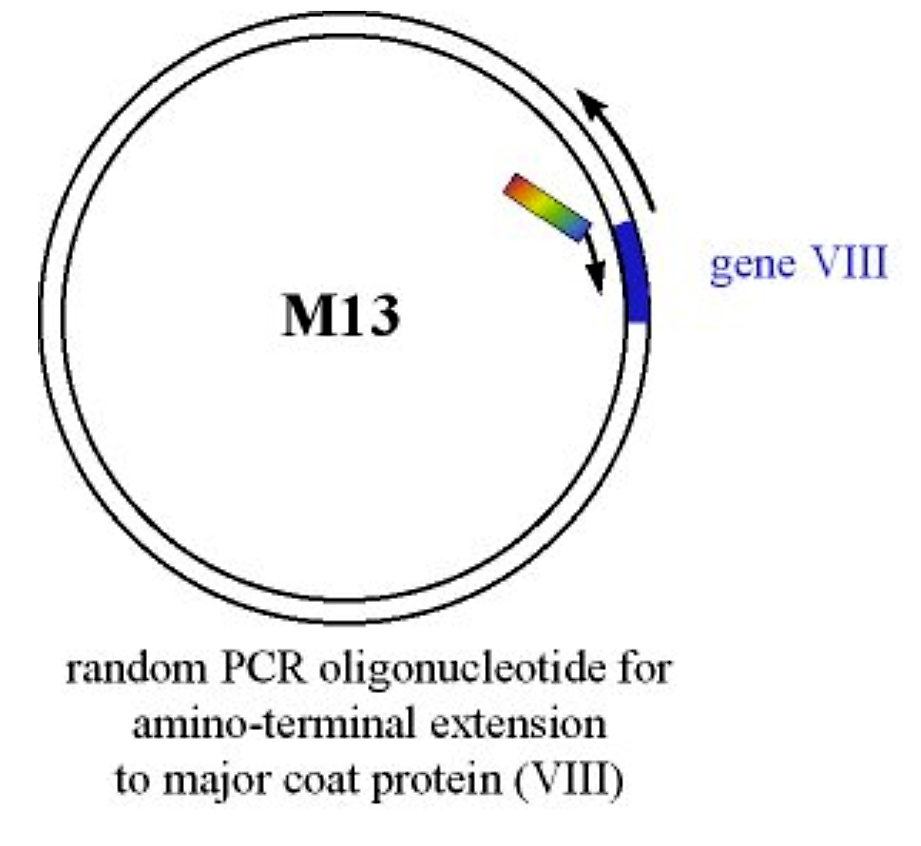
Білок або пептид вводять в аміно-термінал основного білка оболонки (ген VIII) за допомогою мутагенезу на основі ПЦР
.png)
Малюнок 4.3.1: Введення білка при гені VIII
Лінійний продукт ПЛР посилюється для регенерації інтактного циркулярного вірусного геному, білок гена VIII якого тепер має амінотермінальне розширення. Мутагенізований М13 вводять в клітини кишкової палички. Це гола ДНК (не упакована з білками вірусної оболонки), тому вона вводиться в кишкову паличку як плазміда (тобто за допомогою електропорації або використання CaCl 2 компетентних клітин E. coli).
- Екструдоване вірусне потомство буде:
- Бути дещо довшим, оскільки геном більший, але його слід упаковувати.
- Експрес мутантного гена VIII (основної оболонки) білка як частина нитчастого фагового асамблеї
.png)
Малюнок 4.3.2: Мутований потомство М13
Підбір
Аміно-термінальний пептид може мати спорідненість до специфічного ліганду, можливо, антитіла. Ми можемо використовувати цю спорідненість зв'язування для очищення мутантного фага. Ми можемо побудувати колонку хроматографії, де матриця хроматографії прикріпила до неї цікавить ліганд. Якщо ми пропустимо наш фаг через цей стовпець, мутантний фаг, що містить білок мутантного гена VIII, зв'яжеться і буде знерухомлений на колоні
.png)
Малюнок 4.3.3: Іммобілізований ліганд
- Будь-який фаг дикого типу не буде зв'язуватися, а буде проходити через стовпець
- Зв'язаний фаг може бути елюйований і використаний безпосередньо для реінфекції кишкової палички для розмноження вірусів з білком мутантного гена VIII.
Очищений білок мутантного гена VIII несе разом з ним ДНК, яка кодує для себе. Іншими словами, ми спеціально відібрали для ДНК, яка кодує для гену VIII, що цікавить (тобто мутант)
Зміна специфіки прив'язки
Припустимо, у нас до матриці прикріплений трохи інший ліганд...
.png)
Наш фаг з мутантним геном VIII білка буде не дуже добре зв'язуватися з цим іншим лігандом. Якщо ми введемо відповідні зміни амінокислот в наш мутантний ген VIII білка, ми можемо поліпшити спорідненість зв'язування (специфічність) і отримати фаг зв'язуватися з новим лігандом
.png)
- Після ПЛР та лігування це дасть бібліотеку геномів фагів, кожен з яких має потенційно різну послідовність для амінотермінального розширення білка гена VIII
- Взагалі кажучи, коли вони вводяться в кишкову паличку, ефективність, як правило, настільки низька, що щонайбільше кожна успішна трансформація призводить лише до одного геному фага на кишкову паличку.
- Таким чином, фаг потомства з нашої бібліотеки матиме лише один тип білка гена VIII на фаг (один фаг матиме білок гена VIII, для якого він код ДНК).
- Якщо ми передамо колекцію фагів потомства з нашої бібліотеки над нашим лігандним стовпчиком, то вибірково зв'яжемо ті фаги, чий мутантний ген VIII білок має спорідненість до ліганду.
.png)
Малюнок 4.3.5: Специфічна прив'яз
- Якщо ми ізолюємо зв'язаний фаг, ми можемо повторно заразити E.coli та ізолювати фаг потомства
- У цьому першому виборі ми можемо мати багато інших фагів, які можуть бути слабкими або взагалі неселективними лігандними в'яжучими речовинами. Отже, процес повторюється до тих пір, поки у нас не з'явиться бібліотека конкретних мутантів з високою спорідненістю (це іноді називають «Біо-Майнінг» або «Біо-панорамування»)
- Потім ми можемо послідовність ДНК і з'ясувати, яка послідовність (и) в гені VIII мутанта забезпечують високу специфічність зв'язування з нашим новим лігандом
практичні обмеження
- За яку довжину ДНК/білка ми можемо рандомізувати?
Приклад: випадкова розтяжка 10 амінокислот
- 20 10 можливих різних унікальних поліпептидних послідовностей. Кожна амінокислота становить 110 г/моль або 1,8 х 10 -22 г на амінокислоту. Це означало б, що повна випадкова бібліотека 10mer пептидів матиме масу 1,8 х 10 -9 г.
Приклад: випадкова розтяжка з 20 амінокислот
- 20 20 можливих різних унікальних поліпептидних послідовностей. Кожна амінокислота становить 110 г/моль або 1,8 х 10 -22 г на амінокислоту. Це означало б, що повна випадкова бібліотека 20mer пептидів матиме масу 18.9 кг!
При цьому навіть не враховується значно більша маса вірусної частинки, до складу якої вона входила б. Цей тип обчислень демонструє, що генерація бібліотек випадкових послідовностей ДНК обмежується дуже короткими відрізками приблизно півдюжини або близько того кодонових позицій.
Випадковий мутагенез
Ми могли б випадковим чином ввести всі чотири бази в кожній позиції (NNN), намагаючись синтезувати мутагенний випадковий кодон, але що це дасть нам?
| Лей, Мистецтво, Сер (6 кодонов/64) | 9,4% |
| Вал, Про, Чт, Ала, Глі (4 кодону/64) | 6,3% |
| Іль (3 кодону/64) | 4,7% |
| Фе, Тир, Гіс, Глен, Асен, Глю, Жопа, Січі (2 кодону/64) | 3,1% |
| М'ясо, Трип (1 кодон/64) | 1,6% |
| Стоп (3 кодони/64) | 4,7% |
- Таким чином, не всі амінокислоти присутні в рівних кількостях, і у нас буде 4,7% стоп-кодонів
- Ми можемо покращити це, використовуючи всі чотири основи на перших двох позиціях та рівну суміш основ G та C у третьому (коливається) положенні. Це призведе до 32 можливих кодонів та наступного розподілу амінокислот та кодонів:
| Фе, Тир, Cys, Поїздка, Його, Глен, Іль, Asn, М'ясо, Ліс, Ліс, Асп, Глю, Стоп (1 codon/32) | 3,1% |
| Глі, Вал, Ала, Pro, Thr (2 кодони/32) | 6,3% |
| Лей, Мистецтво, Сер (3 кодони/32) | 9,4% |
Ще одна загальна проблема вищевказаного методу полягає в неспецифічному зв'язуванні.
- Частково це пов'язано з великою кількістю протеїнів мутантного гена VIII (~2500) на поверхні вірусу.
- Зв'язування лігандів може бути обумовлено взаємодією двох або більше білків гена VIII, що сприяють зв'язуванню ліганду (тобто «полівалентного» зв'язування)
- При цьому виділений мутантний пептид може проявляти слабку або взагалі не зв'язуючу спорідненість.
Підхід #1 - Мутувати білок гена III замість гена VIII
- Хоча існує ~ 2500 копій гена VIII (основного білка пальто) на фаг, на фаг є 5 копій гена III (мінорний білок шерсті)
.png)
Малюнок 4.3.6: Мутуючий ген III
- Ми можемо ввести мутагенну послідовність в амінотермінал білка гена III і тим самим обмежити кількість копій на частинці фага.
- це все ще може призвести до полівалентного зв'язування
Підхід #2 - Доповнення білком гена III дикого типу під час складання фагів
- Якщо фаг M13 містить другу копію гена III, яку ми не мутуємо, то коли фаг збирається (коли він видавлюється через зовнішню мембрану) п'ять білків гена III, які він підбирає, буде сумішшю мутантного та дикого типу (приблизно в рівних кількостях). При цьому фаг потомства матиме, в середньому, 2-3 копії білка мутантного гена III
- Якщо ми зможемо збільшити експресію білка гена III дикого типу, до того моменту, коли він присутній у чотирикратному надлишку над мутантом, то фаг потомства буде, в середньому, містити 1 копію білка мутантного гена III (а зв'язування лігандів буде, за визначенням, моно-валентним)
- Ми можемо поставити сильний промотор перед геном дикого типу III
- Ми могли б розмістити ген III дикого типу поблизу одного з термінаторів (наприклад, після гена IV). Ця позиція призведе до більш високої експресії гена дикого типу через кумулятивні ефекти промоторів вище за течією.
Варіація
Експресія мутагенного білка як злиття білка зовнішньої мембрани самого E.coli
- Ми можемо приєднати нашу мутагенну послідовність до гена для білка зовнішньої мембрани (наприклад, omPT, LaMb)
- Поверхня клітини кишкової палички сама виводить мутагенний пептид
- Білки зовнішньої мембрани можуть бути присутніми на рівні 10 000 молекул і більше
- Наша колонка ліганду буде вибірково зв'язувати конкретно зв'язуючі клітини E. coli. Вони можуть бути елюйовані та культивовані, а процес повторюється для вибору мутантної послідовності з спорідненістю зв'язування.
Експресія мутагенного білка як злиття з ДНК зв'язуючим білком
- Ми можемо приєднати нашу мутагенну послідовність до гена білка, який зв'язує ДНК (наприклад, лак-репресор)
- Мутагенний лак-репресор буде закодований плазмідою, яка сама містить дві послідовності лак-операторів.
- Молекула мутантного репресора, виражена плазмідою, буде міцно зв'язуватися з областями лак-оператора на тій самій плазміді.
- Клітини лізуються (репресор залишається пов'язаним з його плазмідною ДНК), а етап зв'язування лігандів виконується для збагачення послідовностей зв'язування лігандів
- Асоційована плазмідна ДНК виділяється і перетворюється назад в кишкову паличку для ампліфікації та іншого раунду відбору
.png)
Малюнок 4.3.7: Зплавлення мутагенного білка і зв'язування білка
