1.15: SDS-СТОРІНКА
- Page ID
- 6266
Цілі навчання
Цілі:
- Підготуйте зразки білка з перетворених бактеріальних клітин і виконайте PAGE.
- Аналізуйте продукти PAGE і ідентифікуйте білки за молекулярною масою.
Результати навчання студентів:
Після закінчення цієї лабораторії студенти зможуть:
- Поясніть, як працює SDS-PAGE.
- Запустіть і проаналізуйте результати роботи SDS-СТОРІНКИ.
Вступ
Поліакриламідний гель Електрофорез
Електрофорез поліакриламідного гелю (PAGE) - це, мабуть, найпоширеніший аналітичний метод, який використовується для поділу та характеристики білків. Розчин акриламіду і бісакриламіду полімеризується. Акриламід самостійно утворює лінійні полімери. Біакриламід вводить зшивні зв'язки між поліакриламідними ланцюгами. «Розмір пор» визначається співвідношенням акриламіду до бісакриламіду та концентрацією акриламіду. Високе співвідношення бісакриламіду до акриламіду і висока концентрація акриламіду викликають низьку електрофоретичну рухливість. Полімеризація акриламідних і бісакриламідних мономерів індукується персульфатом амонію (АПС), який спонтанно розкладається з утворенням вільних радикалів. TEMED, стабілізатор вільних радикалів, як правило, включений для сприяння полімеризації.
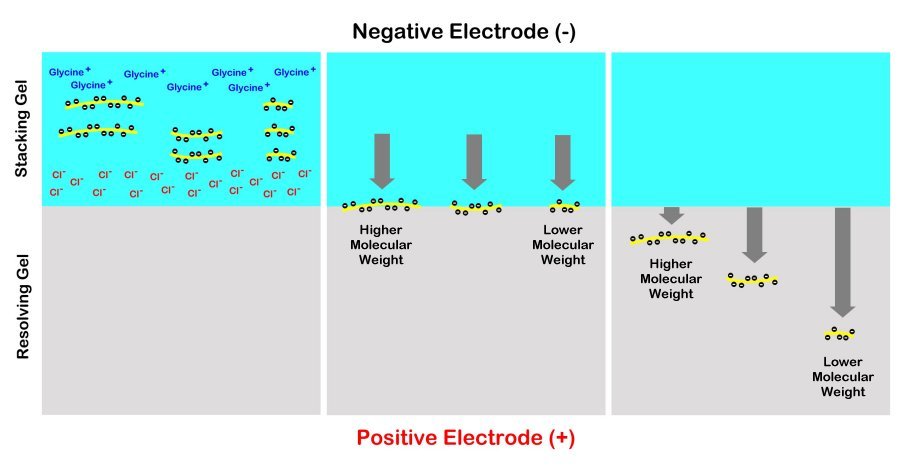
Гелі зазвичай готують з верхньою частиною гелю під лунки зразка зроблені менш щільними, ніж решта гелю нижче, що навмисно робиться щільніше. Верхню частину називають «гелем для укладання», а нижню частину називають «біговим гелем» або «розділовим гелем». Мета укладання гелю полягає в тому, щоб сконцентрувати всі білки різного розміру в компактній горизонтальній зоні, затиснувши їх між градієнтом молекул гліцину вище і хлоридних іонів нижче. Таким чином, більшість білків одночасно потраплять у більш щільний гель, перш ніж вони почнуть мігрувати вниз з різною швидкістю залежно від їх розміру. Таким чином, смуги набагато чіткіші та краще розділені для візуалізації та аналізу. Без гелю для укладання білки вироблятимуть довгий мазок через розсмоктуючий гель замість щільних чітких смуг для аналізу.
SDS-СТОРІНКА
Додецилсульфат натрію (SDS) - амфіпатичний миючий засіб. Має аніонну головну групу і ліпофільний хвіст. Він нековалентно зв'язується з білками, де приблизно одна молекула SDS притягується до кожні дві амінокислоти. SDS змушує білки денатурувати і роз'єднуватися один від одного (за винятком ковалентного зшивання) і по суті розплутуватися в лінійні молекули. Це також надає негативний заряд. При наявності СДС маскується внутрішній заряд білка. Під час SDS-PAGE всі білки мігрують до анода (позитивно зарядженого електрода). Білки, оброблені SDS, мають дуже схожі співвідношення заряду до маси і схожі форми. Під час PAGE швидкість міграції оброблених SDS білків ефективно визначається їх розгорнутою довжиною, яка пов'язана з їх молекулярною масою.

Частина I: SDS-СТОРІНКА
Матеріали
- Вертикальні камери гелевого електрофорезу та гелеві касети в зборі (Bio-Rad Mini PROTEAN)
- TRIS/гліцин/SDS працює буфер
- Блок живлення
- Біо-Рад 10% збірний поліакриламід Міні PROTEAN TGX гелі без плям (8,6 X 6,7 см)
- Керівництво по завантаженню гелю
- Мікропіпетки з наконечниками для завантаження гелю
- Протеїнові зразки
- Bio-Rad 2X Laemmli Sample Buffer (містить SDS і сахарозу або гліцерин)
і 2-меркаптоетанол (зменшує дисульфідні зв'язки, порушує білкові зшивання)
і завантажувальний барвник - Попередні стандарти молекулярної маси білка (вже підготовлені в буфері зразка)
Порядок дій
Підготовка зразків
- Обов'язково надягайте рукавички.
- Приготуйте гарячу водяну баню (100°C). Помістіть трохи води в склянку об'ємом 600 мл або більше і мікрохвильову піч або залиште на гарячій плиті, щоб кипіти. (Це може зайняти 15 хвилин або більше.)
- Поєднайте 10 мкл кожного зразка білка з 20 мкл буферного зразка Laemmli/Loading Dye в маркованих гвинтових мікроцентрифужних трубках.
- Проваріть проби не більше 5 хвилин для повної денатурації білків.
- Після закипання залиште пробірки для зразків при кімнатній температурі до готовності для завантаження на гель.
Приготування гелевої та електрофорезної камери
- Обов'язково надягайте рукавички.
- Вийміть попередньо відлитий гель з упаковки. Акуратно видаліть зелену смужку з нижньої частини гелю.
- Відкрийте два зелених бічних затискача на вертикальному вузлі гелевої касети.
- Помістіть попередньо відлитий гель на одну сторону касети і використовуйте прозору буферну дамбу з іншого боку касети. Потім акуратно закрийте зелені бічні затискачі.
- Вставте касету в вертикальну гелеву камеру, відповідну за кольором електродів (червоний і чорний) з колірними напрямними з боків камери.
- Заповніть внутрішню частину касети буфером 1X Tris Glycine SDS PAGE, поки свердловини не будуть занурені.
- Заповніть дно вертикальної гелевої камери буфером 1X Tris Glycine SDS PAGE до позначки збоку для 1 - 2 гелів.
Завантаження зразків у гель
- Помістіть жовту направляючу для завантаження гелю у верхній частині касети.
- Використовуючи наконечники для завантаження гелю, мікропіпетка 10 мкл підготовленого білка MW стандарту в першу (#1), п'яту (#5) та останню (#10) смуги
- Використовуючи гелеві завантажувальні наконечники, мікропіпеткою по 10 мкл кожної проби білка в кожну з залишилися лунок (2-4; 6-9) гелю. Зверніть увагу, який зразок знаходиться в якій смузі у вашому блокноті.
електрофорез
- Помістіть кришку на вертикальну гелеву камеру
- Вставте червоний і чорний дроти в правильні відповідні кольорові клеми на блоці живлення
- Підключіть блок живлення та увімкніть вимикач живлення
- Виберіть «Постійна напруга», а потім відрегулюйте напругу до 300 вольт
- Натисніть кнопку запуску
- Встановіть таймер на 10 хвилин
- Якщо найменша смуга протеїнового маркера пройшла вниз на 1 см від нижнього краю гелю, вимкніть харчування і зупиніть біг, інакше продовжуйте біг, поки це не станеться
- Від'єднайте блок живлення та дроти від гелевої камери
- Розберіть гелеву камеру і обережно видаліть гель
- Налийте використаний буфер у використаний буферний контейнер - Не виливайте мийку!
- Гель тепер може бути зображений на системі камери документації гелю або він повинен пройти через пляму/затримувати.
Навчальні питання
- Що таке SDS і чому він додається до зразка білка перед запуском PAGE?
- Чому білок нагрівається протягом 5 хвилин перед завантаженням в гель?
- Який електрод білок біжить в SDS-PAGE і чому?
- Чим відрізняється гель для укладання від розділового гелю?
- Враховуючи гель, вмієте аналізувати його за допомогою стандарту молекулярної ваги?
