3.3: Хімічне склеювання
- Page ID
- 5554
Коли ви думаєте про склеювання, ви можете не думати про іони. Як і більшість з нас, ви, мабуть, думаєте про зв'язок між людьми. Як і люди, молекули зв'язуються - і деякі зв'язки міцніші за інших. Важко розбити матір і дитину, або молекулу, що складається з одного кисню і двох атомів водню! Хімічний зв'язок - це сила тяжіння між атомами або іонами. Утворюються зв'язки, коли атоми поділяють або переносять валентні електрони. Валентні електрони - це електрони на зовнішньому енергетичному рівні атома, які можуть брати участь у хімічних взаємодіях. Валентні електрони є основою всіх хімічних зв'язків.

Чому облігації формуються
Щоб зрозуміти, чому утворюються хімічні зв'язки, розглянемо загальну сполуку, відому як вода, або H 2 O. Вона складається з двох атомів водню (H) і одного атома кисню (O). Як ви можете бачити на лівій стороні малюнка\(\PageIndex{2}\) нижче, кожен атом водню має лише один електрон, який також є його єдиним валентним електроном. Атом кисню має шість валентних електронів. Це електрони на зовнішньому енергетичному рівні атома кисню.

У молекулі води праворуч на малюнку\(\PageIndex{2}\) кожен атом водню розділяє пару електронів з атомом кисню. Ділившись електронами, кожен атом має електрони, доступні для заповнення його єдиного або зовнішнього енергетичного рівня. Кожен з атомів водню має пару спільних електронів, тому їх перший і єдиний енергетичний рівень повний. Атом кисню має в цілому вісім валентних електронів, тому його зовнішній енергетичний рівень повний. Повний рівень зовнішньої енергії є найбільш стійким можливим розташуванням електронів. Це пояснює, чому елементи утворюють хімічні зв'язки між собою.
Види хімічних зв'язків
Не всі хімічні зв'язки утворюються так само, як зв'язки у воді. Насправді існує чотири різних типи хімічних зв'язків, про які ми будемо обговорювати тут неполярні ковалентні, полярні ковалентні, водневі та іонні зв'язки. Кожен вид облігацій описаний нижче.
неполярні ковалентні зв'язки
Для метану (CH 4) на малюнку\(\PageIndex{3}\) атом вуглецю (з чотирма електронами у зовнішній валентній енергетичній оболонці) розділяє один електрон від кожного з чотирьох воднів. Водень має один валентний електрон у своїй першій енергетичній оболонці. Ковалентний зв'язок переважає в органічних сполуках. Насправді ваше тіло утримується разом електронами, що поділяються вуглецями та воднями! Електрони однаково діляться у всіх напрямках; тому цей тип ковалентного зв'язку називають неполярним.
Полярні ковалентні зв'язки та водневі зв'язки
Ковалентний зв'язок - це сила тяжіння, яка утримує разом два неметалевих атома, які поділяють пару електронів. Один електрон забезпечується кожним атомом, а пара електронів притягується до позитивних ядер обох атомів. Молекула води, представлена на малюнку,\(\PageIndex{4}\) містить полярні ковалентні зв'язки.
Приваблива сила між молекулами води являє собою дипольну взаємодію. Атоми водню пов'язані з високоелектронегативним атомом кисню (який також володіє двома одинокими парними наборами електронів, що робить дуже полярний зв'язок. Частково позитивний атом водню однієї молекули потім притягується до частково негативного атома кисню сусідньої молекули води, як показано на малюнку\(\PageIndex{4}\)).
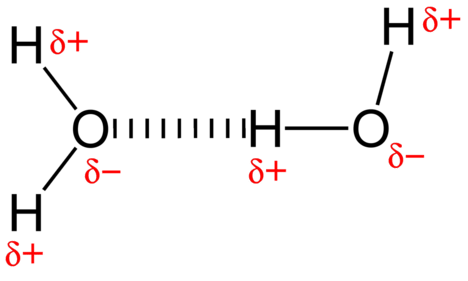
Водневий зв'язок - це міжмолекулярна і внутрішньомолекулярна сила притягання, в якій атом водню, ковалентно пов'язаний з високоелектронегативним атомом, притягується до самотній парі електронів на атомі або частково негативного атома в сусідній полярній молекулі. Водневі зв'язки також виявляються внутрішньомолекулярно в третинних і четвертинних структурах білкових і ДНК ниток.
Водневий зв'язок відбувається тільки в молекулах, де водень ковалентно пов'язаний з одним з трьох елементів: фтором, киснем або азотом. Ці три елементи настільки електронегативні, що виводять більшу частину електронної щільності в ковалентному зв'язку з воднем, залишаючи атом Н дуже електронно-дефіцитним. Атом Н майже діє як оголений протон, залишаючи його дуже притягнутим до одиноких парних електронів на сусідньому атомі.
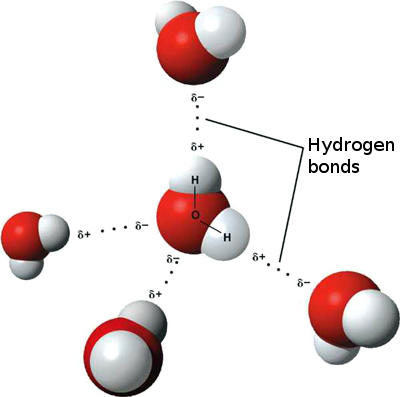
Водневе з'єднання, яке відбувається у воді, призводить до деяких незвичайних, але дуже важливих властивостей. Більшість молекулярних сполук, які мають масу, подібну до води, є газами кімнатної температури. Через міцних водневих зв'язків молекули води здатні залишатися конденсованими в рідкому стані. На малюнку\(\PageIndex{5}\) показано, як зігнута форма та два атоми водню на молекулу дозволяють кожній молекулі води мати можливість зв'язуватися водню з двома іншими молекулами.
У рідкому стані водневі зв'язки води можуть розриватися і реформуватися в міру перетікання молекул з одного місця в інше. Коли вода охолоджується, молекули починають сповільнюватися. Зрештою, коли вода замерзає до льоду, водневі зв'язки утворюють дуже специфічну мережу, показану на правій стороні малюнка\(\PageIndex{6}\). Коли вода рідка, молекули більш рухливі і не утворюють цієї жорсткої структури.

Іонні зв'язки
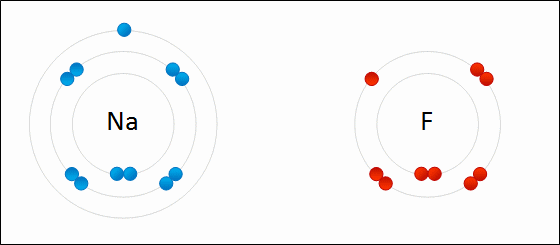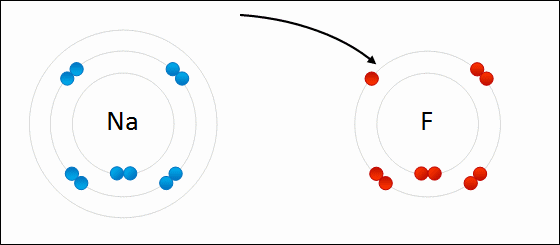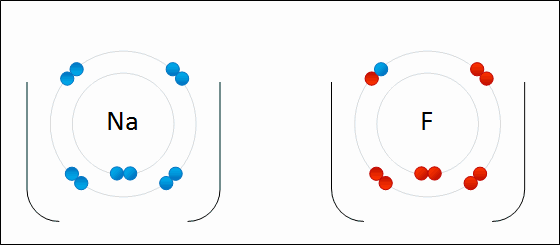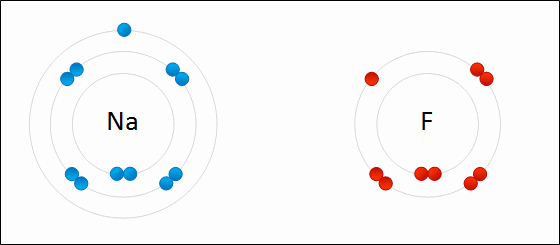
Електрони переносяться між атомами. Іон дасть один або кілька електронів іншому іону. Кухонна сіль, хлорид натрію (NaCl), є поширеним прикладом іонного з'єднання. Зверніть увагу, що натрій знаходиться в лівій частині таблиці Менделєєва і що хлор знаходиться в правій частині таблиці Менделєєва. На малюнку\(\PageIndex{7}\) атом літію дарує електрон атому фтору з утворенням іонної сполуки. Це відбувається з повним заповненням їх крайньої валентної оболонки. Перенесення електрона дає іону літію чистий заряд +1, а іону фтору чистий заряд -1. Ці іони зв'язуються, оскільки вони відчувають привабливу силу через різницю в знаках своїх зарядів.
Рецензія
- Чим ковалентний зв'язок відрізняється від іонного зв'язку?
- Чому водневий зв'язок є відносно слабким зв'язком?
- Діаграма полярності молекули води.
- Що таке хімічний зв'язок?
- Поясніть, чому атоми водню та кисню більш стабільні, коли вони утворюють зв'язки в молекулі води.
- Скільки валентних електронів має натрій? Скільки валентних електронів має хлор? Як атом хлору зв'язується з натрієм? Що таке заряд на іоні натрію? А як щодо іона хлору?
- Коли відбувається ковалентний зв'язок? Як це працює?
- Скільки валентних електронів має кисень?
Дізнатися більше
Атрибуції
- Мати і дочка від Lyd235, CC BY-SA 4.0 через Вікісховище
- Молекула води від CNX OpenStax, ліцензована CC BY 4.0 через Wikimedia Commons
- Ковалентні облігації DynaBlast, ліцензовані CC BY-SA 2.5 через Wikimedia Commons
- Водневий зв'язок у воді, суспільне надбання через Вікісховище
- 3D-модель водневих облігацій Міхала Маньяса, публічне надбання через Wikimedia Commons
- Рідка вода та лід від P99am, CC BY-SA 3.0 через Wikimedia Commons
- NaF від Wdcf, CC BY-SA 3.0 через Вікісховище
- Текст адаптований з біології людини CK-12 ліцензований CC BY-NC 3.0
