29.5: Мультиелектронні атоми
- Page ID
- 74888
цілі навчання
- Опишіть атомну будову та екранування в багатоелектронних атомах
Мультиелектронні атоми
Атоми з більш ніж одним електроном, такі як Гелій (He) і Азот (N), називаються багатоелектронними атомами. Водень - єдиний атом в таблиці Менделєєва, який має один електрон на орбіталі під земним станом.
У воднеподібних атомах (тих, у кого тільки один електрон) чиста сила на електроні така ж велика, як і електричне тяжіння від ядра. Однак, коли задіяно більше електронів, кожен електрон (в nn-оболонці) відчуває не тільки електромагнітне тяжіння від позитивного ядра, але і сили відштовхування від інших електронів в оболонках від '1' до 'n'. Це призводить до того, що чиста сила на електрони в зовнішніх електронних оболонках значно менша за величиною. Тому ці електрони не так сильно пов'язані з ядром, як електрони ближче до ядра. Це явище часто називають ефектом проникнення орбіти. Теорія екранування також пояснює, чому електрони валентної оболонки легше видаляються з атома.

Ефект екранування електронів: багатоелектронний атом з внутрішніми електронами, що екранують зовнішні електрони від позитивно зарядженого ядра
Розмір екрануючого ефекту важко точно обчислити через ефекти квантової механіки. Як наближення ефективний ядерний заряд на кожному електроні можна оцінити за допомогою:\(\mathrm{Z_{eff}=Z−σZ}_\text{eff} = \mathrm{Z} – \sigma \), де\(\mathrm{Z}\) число протонів в ядрі, а σ\ sigma - середня кількість електронів між ядром і відповідним електроном. σ\ sigma можна знайти за допомогою квантової хімії та Рівняння Шредінгера або за допомогою емпіричної формули Слейтера.
Наприклад, розглянемо катіон натрію, аніон фтору та нейтральний атом неону. Кожен має 10 електронів, а кількість невалентних електронів становить два (10 загальних електронів мінус вісім валентних електронів), але ефективний ядерний заряд змінюється, оскільки кожен має різну кількість протонів:
\[\mathrm { Z } _ { \mathrm { eff } } \mathrm { F } ^ { - } = 9 - 2 = 7 +\]
\[\mathrm { Z } _ { \mathrm { eff } } \mathrm { Ne } = 10 - 2 = 8 +\]
\[\mathrm { Z } _ { \mathrm { eff } } \mathrm { Na } ^ { + } = 11 - 2 = 9 +\]
Як наслідок, катіон натрію має найбільший ефективний ядерний заряд і, отже, найменший атомний радіус.
Періодична таблиця
Періодична таблиця - це розташування хімічних елементів відповідно до їх електронних конфігурацій та повторюваних хімічних властивостей.
цілі навчання
- Поясніть, як елементи розташовані в Періодичній таблиці.
Періодична таблиця являє собою табличне відображення хімічних елементів, організоване на основі їх атомних номерів, електронних конфігурацій і повторюваних хімічних властивостей. Елементи представлені відповідно до їх атомними номерами (кількістю протонів) у зростаючому порядку. Стандартна форма столу містить вісімнадцять на сім сітку або основний корпус елементів, розташованих над меншим подвійним рядом елементів. Таблицю також можна деконструювати на чотири прямокутні блоки: s-блок зліва, p-блок праворуч, d-блок посередині та f-блок нижче цього. Рядки таблиці називаються періодами. Колони s-, d- і p-блоків називаються групами, деякі з яких мають такі назви, як галогени або благородні гази.
Оскільки за визначенням періодична таблиця містить повторювані тенденції, будь-яка така таблиця може бути використана для отримання взаємозв'язків між властивостями елементів та прогнозування властивостей нових елементів, які ще не були виявлені або синтезовані. В результаті таблиця Менделєєва, в стандартній формі або якомусь іншому варіанті, забезпечує корисну основу для аналізу хімічної поведінки. Такі таблиці широко використовуються в хімії та інших науках.

Періодична таблиця елементів: стандартна форма таблиці Менделєєва, де кольори представляють різні категорії елементів
Специфіка Періодичної таблиці
Всі версії таблиці Менделєєва включають тільки хімічні елементи, а не суміші, сполуки або субатомні частинки. Кожен хімічний елемент має унікальний атомний номер, що представляє кількість протонів в його ядрі. Більшість елементів мають різну кількість нейтронів серед різних атомів: ці варіанти іменуються ізотопами. Наприклад, вуглець має три природні ізотопи. Всі його атоми мають шість протонів і більшість мають шість нейтронів, але близько одного відсотка мають сім нейтронів, а дуже мала частка має вісім нейтронів. Ізотопи ніколи не поділяються в таблиці Менделєєва. Вони завжди згруповані разом під одним елементом. Елементи без стабільних ізотопів мають атомні маси своїх найбільш стабільних ізотопів, перерахованих у дужках.
Всі елементи від атомних номерів '1' (водень) до '118' (ununoctium) були виявлені або синтезовані. З них елементи через каліфорнію існують природним шляхом; решта синтезувалися лише в лабораторіях. Переслідується виробництво елементів за межами ununoctium. Питання про те, як періодичну таблицю може знадобитися змінити для розміщення будь-яких таких доповнень, є предметом постійної дискусії. Численні синтетичні радіонукліди природних елементів також були виготовлені в лабораторіях.
Хоча прекурсори існують, Дмитру Менделєєву взагалі приписують публікацію першої широко визнаної таблиці Менделєєва в 1869 році. Він розробив свою таблицю, щоб проілюструвати періодичні тенденції у властивостях елементів, відомих на той час. Менделєєв також передбачив деякі властивості тодішніх невідомих елементів, які повинні були заповнити прогалини в таблиці. Більшість його прогнозів виявилися правильними, коли згодом були виявлені розглянуті елементи. Менделєєва періодична таблиця з тих пір була розширена і вдосконалена з відкриттям або синтезом більш нових елементів і розробкою нових теоретичних моделей для пояснення хімічної поведінки.

Менделєєва 1869 р. Періодична таблиця: Менделєєва 1869 р. Менделєєва представляє періоди вертикально і групи по горизонталі.

Дмитро Менделєєв: Дмитро Менделєєв відомий тим, що публікує широко визнану таблицю Менделєєва.
Конфігурації електронів
Електронна конфігурація - це розподіл електронів атома або молекули на атомних або молекулярних орбіталах.
цілі навчання
- Поясніть значення електронних конфігурацій
Електронна конфігурація - це розподіл електронів атома або молекули на атомних або молекулярних орбіталах. Електронні конфігурації описують електрони як кожен, що рухається незалежно в орбіталі, в середньому полі, створеному всіма іншими орбіталями.
В атомах електрони заповнюють атомні орбіталі за принципом Ауфбау (показано на), заявленому як: максимум два електрони вводяться на орбіталі в порядку збільшення орбітальної енергії - орбіталі найнижчої енергії заповнюються до того, як електрони розміщуються на орбіталі вищої енергії. Як приклад, електронна конфігурація атома неону становить 1s 2 2s 2 2p 6 або [He] 2s 2 2p 6, як показано на схемі. У молекулах ситуація ускладнюється, так як кожна молекула має різну орбітальну структуру. Молекулярні орбіталі маркуються відповідно до їх симетрії, а не атомних орбітальних міток, що використовуються для атомів та одноатомних іонів: отже, електронна конфігурація двоатомної молекули кисню, O 2, становить 1σ g 2 1σ u 2 2σ g 2 2σ у 2 1π у 4 3σ г 2 1π г 2.

Електронна конфігурація атома неону: Електронна конфігурація атома неону, що показує лише зовнішню електронну оболонку.
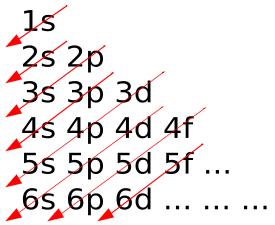
Принцип Ауфбау: У принципі Ауфбау, коли електрони додаються до атомів, вони спочатку додаються до найнижчих орбіталів.
Згідно із законами квантової механіки, для систем, що мають тільки один електрон, енергія пов'язана з кожною конфігурацією електронів і при певних умовах електрони здатні переходити з однієї конфігурації в іншу шляхом випромінювання або поглинання кванта енергії, у вигляді фотона.
Для атомів або молекул з більш ніж одним електроном рух електронів корелює і така картина вже не точна. Для точного опису будь-якої багатоелектронної системи потрібна нескінченна кількість електронних конфігурацій, і жодна енергія не може бути пов'язана з однією єдиною конфігурацією. Однак в електронній хвильовій функції зазвичай переважає дуже мала кількість конфігурацій, і тому поняття електронної конфігурації залишається важливим для багатоелектронних систем.
Електронна конфігурація багатоатомних молекул може змінюватися без поглинання або випромінювання фотона через вібронічні зв'язки.
Знання електронної конфігурації різних атомів корисно в розумінні структури періодичної таблиці елементів. Зовнішню електронну оболонку часто називають валентною оболонкою і (до першого наближення) визначає хімічні властивості. Слід пам'ятати, що подібності в хімічних властивостях були помічені більш ніж за століття до появи ідеї електронної конфігурації. Поняття електронної конфігурації також корисно для опису хімічних зв'язків, які утримують атоми разом. У сипучих матеріалах ця ж ідея допомагає пояснити своєрідні властивості лазерів і напівпровідників.
Ключові моменти
- Водень - єдиний атом в таблиці Менделєєва, який має один електрон на орбіталі під земним станом.
- У багатоелектронних атомах чиста сила на електрони в зовнішніх оболонках зменшується за рахунок екранування.
- Ефективний ядерний заряд на кожному електроні можна наблизити так: zeff=z−σzeff=Z−σ, де ZZ - кількість протонів в ядрі, а σ - середня кількість електронів між ядром і відповідним електроном.
- Періодична таблиця забезпечує корисну основу для аналізу хімічної поведінки елементів.
- Періодична таблиця включає тільки хімічні елементи, при цьому кожному хімічному елементу присвоюється унікальний атомний номер, що представляє кількість протонів в його ядрі.
- Дмитру Менделєєву приписують видання першої широко визнаної таблиці Менделєєва в 1869 році.
- Електрони заповнюють атомні орбіталі за принципом Ауфбау в атомах.
- Для систем, що мають лише один електрон, енергія пов'язана з кожною конфігурацією електронів, і електрони здатні переходити від однієї конфігурації до іншої шляхом випромінювання або поглинання кванта енергії, у вигляді фотона.
- Для атомів або молекул з більш ніж одним електроном потрібна нескінченна кількість електронних конфігурацій для точного опису будь-якої багатоелектронної системи, і жодна енергія не може бути пов'язана з однією єдиною конфігурацією.
Ключові умови
- воднеподібні: мають єдиний електрон
- електронна оболонка: Колективні стани всіх електронів в атомі, що мають однакове основне квантове число (візуалізується як орбіта, по якій рухаються електрони).
- валентна оболонка: зовнішня оболонка електронів в атомі; ці електрони беруть участь у зв'язку з іншими атомами
- Періодична таблиця: Таблична діаграма хімічних елементів відповідно до їх атомних номерів, щоб елементи з подібними властивостями знаходилися в одному стовпці.
- елемент: Будь-яка з найпростіших хімічних речовин, яка не може бути розкладена в хімічній реакції або будь-якими хімічними засобами і складається з атомів, які мають однакову кількість протонів.
- атомний номер: число, рівне кількості протонів в атомі, що визначає його хімічні властивості. Символ: Z
- атомна орбітальна: квантова механічна поведінка електрона в атомі, що описує ймовірність конкретного положення та енергії електрона.
ЛІЦЕНЗІЇ ТА АВТОРСТВА
CC ЛІЦЕНЗОВАНИЙ КОНТЕНТ, РАНІШЕ ДІЛИВСЯ
- Курація та доопрацювання. Надано: Boundless.com. Ліцензія: CC BY-SA: Із Зазначенням Авторства
CC ЛІЦЕНЗОВАНИЙ ВМІСТ, СПЕЦИФІЧНА АТРИБУЦІЯ
- електронна оболонка. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/electron_shell. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Ефективний ядерний заряд. Надано: Вікіпедія. Розташований за адресою: uk.wikipedia.org/wiki/effective_nuclear_charge. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Екранування електронів. Надано: Вікіпедія. Розташований за адресою: uk.wikipedia.org/wiki/Електрон_екранування. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- воднеподібний. Надано: Вікісловник. Розташований за адресою: en.wiktionary.org/wiki/воднеподібний. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- валентна оболонка. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/valence_shell. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Надано: Вікімедіа. Знаходиться за адресою: http://upload.wikimedia.org/Wikipedia/commons/thumb/b/b3/Effective_Nuclear_Charge.svg/350px-Effective_Nuclear_Charge.svg.png. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- атомний номер. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/atomic_number. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Періодична таблиця. Надано: Вікіпедія. Розташовано за адресою: uk.wikipedia.org/wiki/Періодична таблиця. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- елемент. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/елемент. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- періодична таблиця. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/periodic_table. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Надано: Вікімедіа. Знаходиться за адресою: http://upload.wikimedia.org/Wikipedia/commons/thumb/b/b3/Effective_Nuclear_Charge.svg/350px-Effective_Nuclear_Charge.svg.png. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Надано: Вікімедіа. Знаходиться за адресою: http://upload.wikimedia.org/Wikipedia/commons/thumb/8/84/Periodic_table.svg/790px-Periodic_table.svg.png. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Надано: Вікімедіа. Знаходиться за адресою: http://upload.wikimedia.org/Wikipedia/commons/thumb/b/b3/Medeleeff_by_repin.jpg/482px-Medeleeff_by_repin.jpg. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Надано: Вікімедіа. Знаходиться за адресою: http://upload.wikimedia.org/Wikipedia/commons/thumb/b/bb/Mendeleev's_1869_periodic_table.png/487px-Mendeleev's_1869_periodic_table.png. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Електронна конфігурація. Надано: Вікіпедія. Розташований за адресою: uk.wikipedia.org/wiki/Electronic_configuration. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Конфігурація електронів. Надано: Вікіпедія. Розташований за адресою: uk.wikipedia.org/wiki/Electron_Configuration. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- електронна оболонка. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/electron_shell. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- атомна орбітальна. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/atomic_orbital. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Надано: Вікімедіа. Знаходиться за адресою: http://upload.wikimedia.org/Wikipedia/commons/thumb/b/b3/Effective_Nuclear_Charge.svg/350px-Effective_Nuclear_Charge.svg.png. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Надано: Вікімедіа. Знаходиться за адресою: http://upload.wikimedia.org/Wikipedia/commons/thumb/8/84/Periodic_table.svg/790px-Periodic_table.svg.png. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Надано: Вікімедіа. Знаходиться за адресою: http://upload.wikimedia.org/Wikipedia/commons/thumb/b/b3/Medeleeff_by_repin.jpg/482px-Medeleeff_by_repin.jpg. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Надано: Вікімедіа. Знаходиться за адресою: http://upload.wikimedia.org/Wikipedia/commons/thumb/b/bb/Mendeleev's_1869_periodic_table.png/487px-Mendeleev's_1869_periodic_table.png. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Принцип Ауфбау. Надано: Вікіпедія. Розташований за адресою: uk.wikipedia.org/wiki/AUFBAU_Principe. Ліцензія: CC BY: Зазначення авторства
- Надано: Вікімедіа. Розташований за адресою: upload.wikimedia.org/Вікіпедія/Вікісховище/Thumb/3/3E/Електрон_shell_010_neon_no_label.svg/600px-електрон_shell_010_no_label.svg.png. Ліцензія: CC BY-SA: Із Зазначенням Авторства