14.2: Перший закон термодинаміки
- Page ID
- 74797
цілі навчання
- Поясніть, як чиста передача тепла та чиста робота, виконана в системі, відносяться до першого закону термодинаміки
Перший закон термодинаміки є версією закону збереження енергії, спеціалізованого для термодинамічних систем. Його зазвичай формулюють, заявляючи, що зміна внутрішньої енергії замкнутої системи дорівнює кількості тепла, що подається в систему, за вирахуванням обсягу роботи, виконаної системою над її оточенням. Закон збереження енергії можна констатувати так: енергія ізольованої системи постійна.
Перший закон термодинаміки: У цьому відео я продовжую свою серію навчальних відеороликів з теплофізики та термодинаміки. Він розміщений на рівні бакалаврату, і хоча він в основному спрямований на фізику спеціальностей, він повинен бути корисним для тих, хто приймає перший курс з термодинаміки, таких як інженери тощо.
Якщо нас цікавить, як тепловіддача перетворюється в роботу, то важливий принцип збереження енергії. Перший закон термодинаміки застосовує принцип збереження енергії до систем, де теплопередача і виконання роботи є методами передачі енергії в систему і з неї. У формі рівняння перший закон термодинаміки

Внутрішня енергія: Перший закон термодинаміки - це принцип збереження енергії, заявлений для системи, де тепло і робота є методами передачі енергії для системи в тепловій рівновазі. Q являє собою чисту тепловіддачу - це сума всіх теплообмінів в систему і з неї. Q позитивний для чистої тепловіддачі в систему. W - загальна робота, виконана на системі та її допомогою. W позитивний, коли система виконує більше роботи, ніж на ній. Зміна внутрішньої енергії системи, ΔU, пов'язане з теплом і роботою за першим законом термодинаміки,\(\mathrm{ΔU=Q−W}\).
\[\mathrm{ΔU=Q−W.}\]
Тут ΔU - зміна внутрішньої енергії U системи, Q - чисте тепло, що передається в систему, а W - чиста робота, виконана системою. Використовуємо такі умовні знаки: якщо Q позитивний, то відбувається чиста тепловіддача в систему; якщо W позитивний, то є чиста робота, виконана системою. Так позитивний Q додає енергії системі, а позитивний W забирає енергію з системи. Таким чином\(\mathrm{ΔU=Q−W}\). Відзначимо також, що якщо тепловіддача в систему відбувається більше, ніж виконана робота, різниця зберігається у вигляді внутрішньої енергії. Теплові двигуни є хорошим прикладом цього - передача тепла в них відбувається, щоб вони могли працювати.
Постійний тиск і об'єм
Ізобарний процес - це той, в якому газ працює при постійному тиску, тоді як ізохорний процес - це той, в якому обсяг підтримується постійним.
цілі навчання
- Контрастні ізобарні та ізохорні процеси
Згідно з першим законом термодинаміки, тепло, що передається системі, може бути або перетворено у внутрішню енергію, або використовуватися для роботи з навколишнім середовищем. Процес, в якому газ працює над своїм середовищем при постійному тиску, називається ізобаричним процесом, тоді як той, в якому обсяг підтримується постійним, називається ізохорним процесом.
Ізобарний процес (постійний тиск)
Ізобарний процес відбувається при постійному тиску. Оскільки тиск постійний, сила, що чиниться, постійна і виконана робота задається як PΔV. Прикладом може бути наявність рухомого поршня в циліндрі, так що тиск всередині циліндра завжди знаходиться під атмосферним тиском, хоча він ізольований від атмосфери. Іншими словами, система динамічно пов'язана, рухомою межею, з резервуаром постійного тиску. Якщо газ повинен розширюватися при постійному тиску, тепло повинно передаватися в систему з певною швидкістю. Цей процес називається ізобаричним розширенням.

Рис. 1: Ізобаричне розширення газу вимагає передачі тепла під час розширення, щоб підтримувати постійний тиск. Так як тиск постійний, то виконана робота - PΔV.
Ізохорний процес (постійний обсяг)
Ізохорний процес - це той, при якому обсяг утримується постійним, а це означає, що робота, виконана системою, буде дорівнює нулю. Звідси випливає, що для простої системи двох вимірів будь-яка теплова енергія, що передається системі зовні, буде поглинатися як внутрішня енергія. Ізохорний процес також відомий як ізометричний процес або ізооб'ємний процес. Прикладом може бути розміщення закритої жерстяної банки, що містить лише повітря, у вогонь. До першого наближення балончик не буде розширюватися, і єдиною зміною буде те, що газ набирає внутрішню енергію, про що свідчить його підвищення температури і тиску. Математично
\[\mathrm{ΔQ=ΔU.}\]
Можна сказати, що система динамічно ізольована, жорсткою межею, від навколишнього середовища.
Ізотермічні процеси
Ізотермічний процес - це зміна термодинамічної системи, при якій температура залишається постійною.
цілі навчання
- Визначте типові системи, в яких відбувається ізотермічний процес
Ізотермічний процес - це зміна системи, при якій температура залишається постійною:\(\mathrm{ΔT = 0}\). Зазвичай це відбувається, коли система контактує із зовнішнім тепловим резервуаром (тепловою ванною), і зміна відбувається досить повільно, щоб система постійно підлаштовувалася до температури резервуара за допомогою теплообміну. На відміну від цього, адіабатичний процес - це те, де система не обмінюється теплом зі своїм оточенням (\(\mathrm{Q = 0}\)). (Див. Наш атом на «Адіабатичному процесі «.) Іншими словами, в ізотермічному процесі значення,\(\mathrm{ΔT = 0}\) але\(\mathrm{Q ≠ 0}\), в той час як в адіабатичному процесі,\(\mathrm{ΔT ≠ 0}\) але\(\mathrm{Q = 0}\).
Ідеальний газ в ізотермічному процесі
Для ідеалу добуток тиску і обсягу (\(\mathrm{PV}\)) є постійною, якщо газ зберігається в ізотермічних умовах. (Це історично називається законом Бойла.) Однак випадки, коли продукт\(\mathrm{PV}\) є експоненціальним терміном, не відповідає. Значення константи дорівнює\(\mathrm{nRT}\), де n - число молів присутнього газу, а R - ідеальна газова константа. Іншими словами,\(\mathrm{PV = nRT}\) застосовується ідеальний закон про газ. Це означає, що
\[\mathrm{P=\dfrac{nRT}{V}=\dfrac{constant}{V}}\]
тримає.
Розрахунок робіт
У термодинаміці робота, яка бере участь при переході газу зі стану А в стан В, просто
\[\mathrm{W_{A→B}=∫_{V_A}^{V_B}P \; dV.}\]
Для ізотермічного, оборотного процесу цей інтеграл дорівнює площі під відповідною ізотермою тиску-об'єму і позначається синім кольором для ідеального газу. Знову ж таки,\(\mathrm{P =\frac{nRT}{V}}\) застосовується і з постійним Т (оскільки це ізотермічний процес), ми маємо

Робота, виконана газом під час розширення: синя область являє собою «роботу», виконану газом під час розширення для цієї ізотермічної зміни.
\[\mathrm{W_{A→B}=nRT∫_{V_A}^{V_B}\dfrac{1}{V}dV=nRT \ln \dfrac{V_B}{V_A}.}\]
Також варто відзначити, що для багатьох систем, якщо температура тримається постійною, внутрішня енергія системи також постійна, і так ΔU=0ΔU=0. З першого закону термодинаміки випливає, що Q=−WQ=−W для цього самого ізотермічного процесу.
адіабатичні процеси
Адіабатичний процес - це будь-який процес, що відбувається без посилення або втрати тепла всередині системи.
цілі навчання
- Оцініть середовища, в яких зазвичай відбуваються ізотермічні процеси
Ізотермічний процес - це зміна системи, при якій температура залишається постійною:\(\mathrm{ΔT = 0}\). Зазвичай це відбувається, коли система контактує із зовнішнім тепловим резервуаром (тепловою ванною), і зміна відбувається досить повільно, щоб система постійно підлаштовувалася до температури резервуара за допомогою теплообміну. На відміну від цього, адіабатичний процес - це те, де система не обмінюється теплом зі своїм оточенням (\(\mathrm{Q = 0}\)). (Див. Наш атом на «Адіабатичному процесі «.) Іншими словами, в ізотермічному процесі значення,\(\mathrm{ΔT = 0}\) але\(\mathrm{Q ≠ 0}\), в той час як в адіабатичному процесі,\(\mathrm{ΔT ≠ 0}\) але\(\mathrm{Q = 0}\).
Ідеальний газ в ізотермічному процесі
Для ідеалу добуток тиску і обсягу (PV) є постійною, якщо газ зберігається в ізотермічних умовах. (Це історично називається законом Бойла.) Однак випадки, коли продукт PV є експоненціальним терміном, не відповідає. Значення константи дорівнює\(\mathrm{nRT}\), де n - число молів присутнього газу, а R - ідеальна газова константа. Іншими словами,\(\mathrm{PV = nRT}\) застосовується ідеальний закон про газ. Це означає, що
\[\mathrm{P=\dfrac{nRT}{V}=\dfrac{constant}{V}}\]
тримає. Сімейство кривих, породжених цим рівнянням, показано в. Кожна крива називається ізотермою.

Ізотерми ідеального газу: Кілька ізотерм ідеального газу на фотоелектричній діаграмі.
Розрахунок робіт
У термодинаміці робота, яка бере участь при переході газу зі стану А в стан В, просто
\[\mathrm{W_{A→B}=∫_{V_A}^{V_B} P \; dV.}\]
Для ізотермічного, оборотного процесу цей інтеграл дорівнює площі під відповідною ізотермою тиску-об'єму і позначається синім кольором для ідеального газу. Знову ж таки, P = nRT/V застосовується і з T постійним (оскільки це ізотермічний процес), ми маємо

Робота, виконана газом під час розширення: синя область являє собою «роботу», виконану газом під час розширення для цієї ізотермічної зміни.
\[\mathrm{W_{A→B}=nRT∫_{V_A}^{V_B}\dfrac{1}{V} \; dV=nRT \ln \dfrac{V_B}{V_A}.}\]
Також варто відзначити, що для багатьох систем, якщо температура тримається постійною, внутрішня енергія системи також постійна, і так\(\mathrm{ΔU=0}\). З першого закону термодинаміки випливає, що\(\mathrm{Q=−W}\) для цього ж ізотермічний процес.
Метаболізм людини
1-й закон термодинаміки пояснює обмін речовин людини: перетворення їжі в енергію, яка використовується організмом для здійснення діяльності.
цілі навчання
- Контрастний катаболізм і анаболізм щодо енергії
Метаболізм у людини - це перетворення їжі в енергію, яка потім використовується організмом для здійснення діяльності. Це приклад першого закону термодинаміки в дії. Розглядаючи тіло як систему, що цікавить, ми можемо використовувати перший закон для вивчення теплопередачі, виконання роботи та внутрішньої енергії в діяльності, починаючи від сну і закінчуючи важкими фізичними вправами. Наприклад, одним з основних факторів такої діяльності є температура тіла - зазвичай підтримується постійною тепловіддачею в навколишнє середовище, що означає, що Q є негативним (тобто наше тіло втрачає тепло). Іншим фактором є те, що організм зазвичай працює над зовнішнім світом, а це означає, що W позитивний. Таким чином, в таких ситуаціях організм втрачає внутрішню енергію, так як\(\mathrm{ΔU=Q−W}\) є негативною.
Харчування
Тепер розглянемо наслідки прийому їжі. Організм метаболізує всю їжу, яку ми споживаємо. Харчування збільшує внутрішню енергію організму за рахунок додавання хімічного потенціалу енергії. По суті, метаболізм використовує процес окислення, при якому виділяється хімічна потенційна енергія їжі. Це означає, що введення їжі відбувається у формі роботи. Харчова енергія повідомляється в спеціальному блоці, відомому як калорійність. Ця енергія вимірюється спалюванням їжі в калориметрі, саме так визначаються одиниці.
катаболізм і анаболізм
Catabolism - це шлях, який розщеплює молекули на менші одиниці і виробляє енергію. Анаболізм - це нарощування молекул з менших одиниць. Анаболізм використовує енергію, вироблену катаболічної розщеплення вашої їжі, щоб створити молекули, більш корисні для вашого тіла.
Внутрішня енергія
Наше тіло втрачає внутрішню енергію, і є три місця, де ця внутрішня енергія може піти - на теплообмін, на роботу і накопичений жир (крихітна частка також йде на ремонт і зростання клітин). Як показано на рис. 1, теплопередача і виконання роботи забирають внутрішню енергію з організму, а потім їжа відкладає її назад. Якщо ви їсте саме потрібну кількість їжі, то ваша середня внутрішня енергія залишається постійною. Що б ви не втратили в теплопередачі і виконуючи роботу, замінюється їжею, так що, в довгостроковій перспективі, ΔU = 0. Якщо ви багаторазово переїдаєте, то ΔU завжди позитивний, і ваше тіло зберігає цю додаткову внутрішню енергію як жир. Зворотне вірно, якщо ви їсте занадто мало. Якщо ΔU негативний протягом декількох днів, то організм метаболізує власний жир, щоб підтримувати температуру тіла і робити роботу, яка забирає енергію з організму. Цей процес полягає в тому, як дієта призводить до втрати ваги.
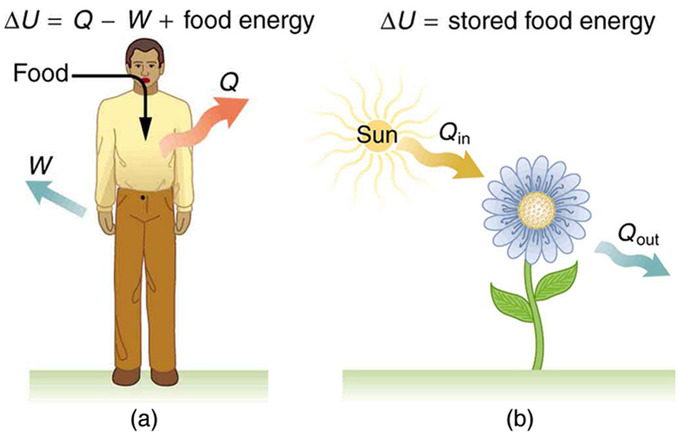
Метаболізм: (а) Перший закон термодинаміки, застосований до метаболізму. Тепло, що передається з організму (Q) і виконана організмом робота (W) виводять внутрішню енергію, в той час як прийом їжі замінює її. (Прийом їжі може розглядатися як робота, виконана на тілі.) (b) Рослини перетворюють частину променистого теплообміну на сонячному світлі в накопичену хімічну енергію, процес, який називається фотосинтезом.
Метаболізм
Життя не завжди таке просте, як знає будь-який дієтолог. Організм зберігає жир або метаболізує його тільки в тому випадку, якщо споживання енергії змінюється протягом декількох днів. Після того, як ви були на основній дієті, наступний є менш успішним, тому що ваше тіло змінює спосіб реагування на низьке споживання енергії. Ваша основна швидкість метаболізму - це швидкість, з якою їжа перетворюється в теплообмін і робота, виконана в той час як організм знаходиться в повному спокої. Організм регулює свою основну швидкість метаболізму, щоб компенсувати (частково) переїдання або недоїдання. Організм зменшить швидкість метаболізму, а не усунути власний жир, щоб замінити втрачене споживання їжі. Ви станете легше охолодженим і відчуєте себе менш енергійними в результаті зниження швидкості метаболізму, і ви не будете втрачати вагу так швидко, як раніше. Вправа допомагає при втраті ваги, тому що він виробляє як тепловіддачу від вашого тіла і роботи, і підвищує швидкість метаболізму, навіть коли ви перебуваєте в стані спокою.
Незворотність
Організм дає нам відмінну вказівку на те, що багато термодинамічні процеси є незворотними. Незворотний процес може йти в одному напрямку, але не в зворотному напрямку, при заданому наборі умов. Наприклад, хоча жир в організмі може бути перетворений для роботи та отримання теплопередачі, робота, виконана на тілі та передача тепла в нього, не можуть бути перетворені на жирові відкладення. В іншому випадку ми могли б пропустити обід, засмагаючи себе або йшовши вниз по сходах. Ще одним прикладом незворотного термодинамічного процесу є фотосинтез. Цей процес є надходженням однієї форми енергії - світла - рослинами та її перетворення в хімічну потенційну енергію. Обидва застосування першого закону термодинаміки проілюстровані в. Однією з великих переваг таких законів збереження є те, що вони точно описують початкову і кінцеву точки складних процесів (таких як метаболізм і фотосинтез) без урахування ускладнень між ними.
Ключові моменти
- Перший закон термодинаміки - це варіант закону збереження енергії, спеціалізований для термодинамічних систем.
- У формі рівняння перший закон термодинаміки є\(\mathrm{ΔU=Q−W}\).
- Теплові двигуни є хорошим прикладом застосування 1-го закону; тепловіддача в них відбувається, щоб вони могли виконувати роботу.
- Ізобарний процес відбувається при постійному тиску. Оскільки тиск постійний, сила, що чиниться, постійна і виконана робота дається як\(\mathrm{PΔV}\).
- Ізобарне розширення газу вимагає тепловіддачі, щоб підтримувати постійний тиск.
- Ізохорний процес - це той, при якому обсяг утримується постійним, а це означає, що робота, виконана системою, буде дорівнює нулю. Єдиною зміною буде те, що газ отримує внутрішню енергію.
- Для ідеального газу добуток тиску та обсягу (PV) є постійною, якщо газ зберігається в ізотермічних умовах.
- Для ідеального газу робота, пов'язана з переходом газу зі стану А в стан В через ізотермічний процес, дається як\(\mathrm{W_{A→B}=nRT \ln \frac{V_B}{V_A}}\).
- Для багатьох систем, якщо температура тримається постійною, внутрішня енергія системи також постійна. Звідси випливає, що\(\mathrm{Q =-W}\) в даному випадку.
- Адіабатичні процеси можуть виникати, якщо контейнер системи має теплоізольовані стінки або процес відбувається в вкрай короткий час.
- Для адіабатично розширюється ідеального одноатомного газу, який працює на навколишнє середовище (W позитивний), внутрішня енергія газу повинна зменшуватися.
- У певному сенсі ізотермічний процес можна розглядати як протилежну крайність адіабатичного процесу. В ізотермічних процесах теплообмін відбувається досить повільно, щоб температура системи залишалася постійною.
- Обмін речовин людини - складний процес. 1-й закон термодинаміки описує початкову і кінцеву точки цих процесів.
- Наше тіло втрачає внутрішню енергію. Є три місця, куди може йти ця внутрішня енергія—на теплообмін, на роботу і накопичений жир.
- Наш організм є хорошим прикладом незворотних процесів. Незважаючи на те, що жир може бути перетворений для роботи та отримання теплопередачі, робота, виконана на тілі та передача тепла в нього, не можуть бути перетворені на жир.
Ключові умови
- внутрішня енергія: Сума всієї енергії, присутньої в системі, включаючи кінетичну та потенційну енергію; еквівалентно, енергія, необхідна для створення системи, виключаючи енергію, необхідну для витіснення її оточення.
- тепло: енергія, що передається від одного тіла до іншого тепловими взаємодіями
- закон збереження енергії: Закон про те, що загальна кількість енергії в будь-якій ізольованій системі залишається постійною і не може бути створена або знищена, хоча вона може змінювати форми.
- внутрішня енергія: Сума всієї енергії, присутньої в системі, включаючи кінетичну та потенційну енергію; еквівалентно, енергія, необхідна для створення системи, виключаючи енергію, необхідну для витіснення її оточення.
- оборотний: Здатний повернутися в початковий стан без споживання вільної енергії і збільшення ентропії.
- ідеальний газ: гіпотетичний газ, молекули якого не виявляють взаємодії і зазнають пружного зіткнення один з одним і зі стінками контейнера.
- Закон Бойла: Спостереження, що тиск ідеального газу обернено пропорційно його об'єму при постійній температурі.
- ідеальний газ: гіпотетичний газ, молекули якого не виявляють взаємодії і зазнають пружного зіткнення один з одним і зі стінками контейнера.
- метаболізм: Повний набір хімічних реакцій, що відбуваються в живих клітині.
- окислення: реакція, при якій атоми елемента втрачають електрони і валентність елемента збільшується.
- калорійність: Енергія, необхідна для підвищення температури 1 кілограма води на 1 кельвін. Це еквівалентно 1000 (малих) калорій.
ЛІЦЕНЗІЇ ТА АВТОРСТВА
CC ЛІЦЕНЗОВАНИЙ КОНТЕНТ, РАНІШЕ ДІЛИВСЯ
- Курація та доопрацювання. Надано: Boundless.com. Ліцензія: CC BY-SA: Із Зазначенням Авторства
CC ЛІЦЕНЗОВАНИЙ ВМІСТ, СПЕЦИФІЧНА АТРИБУЦІЯ
- OpenStax College, Перший закон термодинаміки. 17 вересня 2013 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42232/latest/. Ліцензія: CC BY: Зазначення авторства
- Перший закон термодинаміки. Надано: Вікіпедія. Розташований за адресою: en.wikipedia.org/wiki/First_l... термодинаміка. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- тепло. Надано: Вікіпедія. Розташовано за адресою: uk.wikipedia.org/wiki/Heat. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Безмежний. Надано: Безмежне навчання. Розташований за адресою: www.boundless.com//physics/de... внутрішня енергія. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- закон збереження енергії. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/law_of... tion_of_energy. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Перший закон термодинаміки. Знаходиться за адресою: http://www.youtube.com/watch?v=Ih1NJ0aQI6s. Ліцензія: Суспільне надбання: Немає відомих авторських прав. Умови ліцензії: Стандартна ліцензія YouTube
- OpenStax College, Перший закон термодинаміки. 1 жовтня 2012 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42232/latest/. Ліцензія: CC BY: Зазначення авторства
- Термодинамічний процес. Надано: Вікіпедія. Знаходиться за адресою: uk.wikipedia.org/wiki/Thermodynamic_process. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- OpenStax College, Перший закон термодинаміки та деякі прості процеси. 17 вересня 2013 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42233/latest/. Ліцензія: CC BY: Зазначення авторства
- Безмежний. Надано: Безмежне навчання. Розташований за адресою: www.boundless.com//physics/de... внутрішня енергія. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Перший закон термодинаміки. Знаходиться за адресою: http://www.youtube.com/watch?v=Ih1NJ0aQI6s. Ліцензія: Суспільне надбання: Немає відомих авторських прав. Умови ліцензії: Стандартна ліцензія YouTube
- OpenStax College, Перший закон термодинаміки. 1 жовтня 2012 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42232/latest/. Ліцензія: CC BY: Зазначення авторства
- OpenStax College, Перший закон термодинаміки та деякі прості процеси. 4 лютого 2013 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42233/latest/. Ліцензія: CC BY: Зазначення авторства
- ідеальний газ. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/ideal_gas. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Ізотермічний процес. Надано: Вікіпедія. Розташовано за адресою: uk.wikipedia.org/wiki/Ізотермальний_процес. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- оборотний. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/оборотний. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Закон Бойла. Надано: Вікісловник. Розташоване за адресою: uk.wiktionary.org/wiki/Boyle's_law. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Перший закон термодинаміки. Знаходиться за адресою: http://www.youtube.com/watch?v=Ih1NJ0aQI6s. Ліцензія: Суспільне надбання: Немає відомих авторських прав. Умови ліцензії: Стандартна ліцензія YouTube
- OpenStax College, Перший закон термодинаміки. 1 жовтня 2012 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42232/latest/. Ліцензія: CC BY: Зазначення авторства
- OpenStax College, Перший закон термодинаміки та деякі прості процеси. 4 лютого 2013 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42233/latest/. Ліцензія: CC BY: Зазначення авторства
- Ізотермічний процес. Надано: Вікіпедія. Розташовано за адресою: uk.wikipedia.org/wiki/Ізотермальний_процес. Ліцензія: CC BY: Зазначення авторства
- ідеальний газ. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/ideal_gas. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Закон Бойла. Надано: Вікісловник. Розташоване за адресою: uk.wiktionary.org/wiki/Boyle's_law. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Ізотермічний процес. Надано: Вікіпедія. Розташовано за адресою: uk.wikipedia.org/wiki/Ізотермальний_процес. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- оборотний. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/оборотний. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Перший закон термодинаміки. Знаходиться за адресою: http://www.youtube.com/watch?v=Ih1NJ0aQI6s. Ліцензія: Суспільне надбання: Немає відомих авторських прав. Умови ліцензії: Стандартна ліцензія YouTube
- OpenStax College, Перший закон термодинаміки. 1 жовтня 2012 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42232/latest/. Ліцензія: CC BY: Зазначення авторства
- OpenStax College, Перший закон термодинаміки та деякі прості процеси. 4 лютого 2013 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42233/latest/. Ліцензія: CC BY: Зазначення авторства
- Ізотермічний процес. Надано: Вікіпедія. Розташовано за адресою: uk.wikipedia.org/wiki/Ізотермальний_процес. Ліцензія: CC BY: Зазначення авторства
- Ізотермічний процес. Надано: Вікіпедія. Розташовано за адресою: uk.wikipedia.org/wiki/Ізотермальний_процес. Ліцензія: CC BY: Зазначення авторства
- Ізотермічний процес. Надано: Вікіпедія. Розташовано за адресою: uk.wikipedia.org/wiki/Ізотермальний_процес. Ліцензія: CC BY: Зазначення авторства
- OpenStax College, Перший закон термодинаміки. 17 вересня 2013 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42232/latest/. Ліцензія: CC BY: Зазначення авторства
- метаболізм. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/метаболізм. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- калорійність. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/калорія. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- окислення. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/окислення. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Перший закон термодинаміки. Знаходиться за адресою: http://www.youtube.com/watch?v=Ih1NJ0aQI6s. Ліцензія: Суспільне надбання: Немає відомих авторських прав. Умови ліцензії: Стандартна ліцензія YouTube
- OpenStax College, Перший закон термодинаміки. 1 жовтня 2012 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42232/latest/. Ліцензія: CC BY: Зазначення авторства
- OpenStax College, Перший закон термодинаміки та деякі прості процеси. 4 лютого 2013 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42233/latest/. Ліцензія: CC BY: Зазначення авторства
- Ізотермічний процес. Надано: Вікіпедія. Розташовано за адресою: uk.wikipedia.org/wiki/Ізотермальний_процес. Ліцензія: CC BY: Зазначення авторства
- Ізотермічний процес. Надано: Вікіпедія. Розташовано за адресою: uk.wikipedia.org/wiki/Ізотермальний_процес. Ліцензія: CC BY: Зазначення авторства
- Ізотермічний процес. Надано: Вікіпедія. Розташовано за адресою: uk.wikipedia.org/wiki/Ізотермальний_процес. Ліцензія: CC BY: Зазначення авторства
- OpenStax College, Перший закон термодинаміки. 12 лютого 2013 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42232/latest/. Ліцензія: CC BY: Зазначення авторства
