12.6: Фазові зміни
- Page ID
- 74975
навчальні цілі
- Охарактеризуйте поведінку середовища під час фазового переходу
Фаза термодинамічної системи і стани речовини мають рівномірні фізичні властивості. Під час фазового переходу даного середовища певні властивості середовища змінюються, часто переривчастими, в результаті якогось зовнішнього стану, наприклад температури або тиску. Наприклад, рідина може стати газом при нагріванні до температури кипіння, в результаті чого різка зміна обсягу. Вимірювання зовнішніх умов, при яких відбувається перетворення, називається фазовим переходом. Цей термін найчастіше використовується для опису переходів між твердим, рідким і газоподібним станами речовини і, в рідкісних випадках, плазмою.
Як приклад, якщо ви кип'ятіть воду, вона ніколи не переходить вище 100 градусів Цельсія. Тільки після того, як він повністю випарується, він стане гарячішим. Це пов'язано з тим, що як тільки вода досягає температури кипіння, додаткова енергія використовується для зміни стану речовини і збільшення потенційної енергії замість кінетичної енергії. Навпаки відбувається, коли вода замерзає. Щоб закип'ятити або розтопити одну моль речовини, потрібно певна кількість енергії. Ці кількості енергії є молярною теплотою випаровування та молярною теплотою плавлення. Якщо таку кількість енергії додати до моль цієї речовини при температурі кипіння або замерзання, вся вона розтане або закипить, але температура не зміниться.
Температура зростає лінійно з нагріванням, аж до температури плавлення. Але додане тепло не змінює температуру; ця теплова енергія замість цього використовується для розриву міжмолекулярних зв'язків та перетворення льоду у воду. У цей момент виникає суміш як льоду, так і води. Після того, як весь лід буде розтанув, температура знову піднімається лінійно з додаванням тепла. При температурі кипіння температура більше не підвищується з додаванням тепла, оскільки енергія знову використовується для розриву міжмолекулярних зв'язків. Після того, як вся вода буде кип'ячена до пари, температура продовжуватиме лінійно зростати з додаванням тепла.
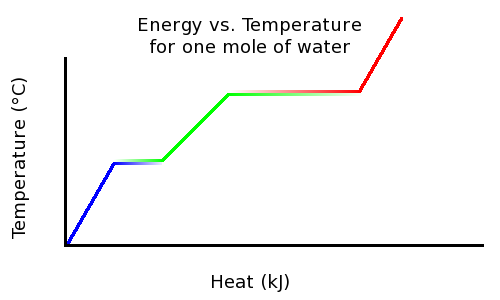
Температура проти тепла: Цей графік показує температуру льоду при додаванні тепла.
Графіки тиску в порівнянні з температурами дають значне уявлення про теплові властивості речовин. На цих графіках є чітко визначені області, які відповідають різним фазам речовини, тому графіки PT називаються фазовими діаграмами. За допомогою графіка, якщо ви знаєте тиск і температуру, можна визначити фазу води. Тверді лінії - межі між фазами - вказують на температури та тиск, при яких фази співіснують (тобто вони існують разом у співвідношеннях, залежно від тиску та температури). Наприклад, температура кипіння води становить 100º С при 1,00 атм. При підвищенні тиску температура кипіння стабільно підвищується до 374º С при тиску в 218 атм. Скороварка (або навіть критий горщик) приготує їжу швидше, оскільки вода може існувати як рідина при температурі більше 100° C без всякого кипіння. Крива закінчується в точці, яка називається критичною точкою, тому що при більш високих температурах рідка фаза не існує ні при якому тиску. Критична температура кисню становить -118ºC, тому кисень не може бути зріджений вище цієї температури.
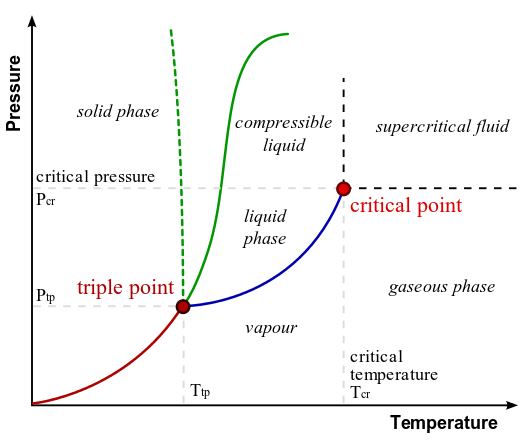
Фазова діаграма води: У цій типовій фазовій діаграмі води зелені лінії позначають температуру замерзання, а синя лінія позначає температуру кипіння, показуючи, як вони змінюються залежно від тиску. Пунктирна лінія ілюструє аномальну поведінку води. Зверніть увагу, що вода змінює стани виходячи з тиску і температури.
Вологість, випаровування та кипіння
Кількість водяної пари в повітрі є результатом випаровування або кипіння, поки не буде досягнуто рівноваги.
навчальні цілі
- Поясніть, чому вода закипає при 100° C
Огляд
Термін відносна вологість означає, скільки водяної пари знаходиться в повітрі в порівнянні з максимально можливим. При його максимумі, що позначається як насичення, відносна вологість становить 100%, а випаровування гальмується. Кількість водяної пари, яку може утримувати повітря, залежить від його температури. Наприклад, відносна вологість підвищується ввечері, так як температура повітря знижується, іноді досягаючи точки роси. При температурі точки роси відносна вологість становить 100%, і туман може виникнути внаслідок конденсації крапель води, якщо вони досить малі, щоб залишатися в суспензії. І навпаки, якщо хтось хотів щось висушити, ефективніше продувати над ним гаряче повітря, а не холодне, оскільки, крім усього іншого, гаряче повітря може утримувати більше водяної пари.
Випаровування
Здатність повітря утримувати водяну пару заснована на тиску пари води. Рідка і тверда фази постійно виділяють пар, оскільки деякі молекули мають досить високі швидкості, щоб увійти в газову фазу, процес, який називається випаровуванням; див. (а). Щоб молекули випаровувалися, вони повинні розташовуватися біля поверхні, рухатися в належному напрямку і мати достатню кінетичну енергію для подолання міжмолекулярних сил рідкої фази. Коли лише невелика частка молекул відповідає цим критеріям, швидкість випаровування низька. Оскільки кінетична енергія молекули пропорційна її температурі, випаровування протікає швидше при більш високих температурах.
Якщо над ємністю розміщена кришка, як у (b), випаровування триває, збільшуючи тиск, поки не накопичиться достатня пара для конденсації, щоб збалансувати випаровування. Тоді рівновага була досягнута, і тиск пари дорівнює парціальному тиску води в ємності. Тиск пари збільшується з температурою, оскільки молекулярні швидкості вищі з підвищенням температури.
Коли молекули, що швидше рухаються, інші молекули мають нижчу середню кінетичну енергію, а температура рідини знижується. Це явище ще називають випарним охолодженням. Саме тому випаровується піт охолоджує організм людини. Випаровування також має тенденцію протікати швидше з більш високими витратами між газоподібною та рідкою фазою та в рідинях з більш високим тиском пари. Наприклад, білизна на лінії одягу буде сохнути (шляхом випаровування) швидше в вітряний день, ніж в нерухомий день.
Застосування для кип'ятіння води
Чому вода кипить при 100ºC? Тиск пари води при 100ºC становить 1,01 × 10 5 Па, або 1,00 атм. Таким чином, він може безмежно випаровуватися при цій температурі і тиску. Але чому при закипанні утворюються бульбашки? Це пояснюється тим, що вода зазвичай містить значну кількість розчиненого повітря та інших домішок, які спостерігаються у вигляді невеликих бульбашок повітря в склянці води. Якщо бульбашка починається на дні контейнера при 20ºC, він містить водяну пару (близько 2,30%). Тиск всередині міхура фіксується на рівні 1,00 атм (ми ігноруємо незначний тиск, що чиниться водою навколо нього). При підвищенні температури кількість повітря в бульбашці залишається колишнім, але водяна пара збільшується; міхур розширюється, щоб зберегти тиск на рівні 1,00 атм. При 100ºC водяна пара надходить в міхур безперервно, оскільки парціальний тиск води дорівнює 1,00 атм в рівновазі. Однак він не може досягти цього тиску, оскільки міхур також містить повітря, а загальний тиск становить 1,00 атм. Бульбашка збільшується в розмірах і тим самим збільшує плавучу силу. Бульбашка відривається і швидко піднімається на поверхню, в результаті чого відбувається закипання. (Див.)
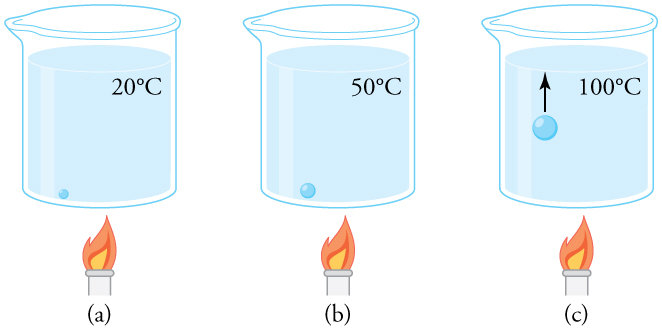
Крупний план процесу кипіння: (а) Повітряний міхур у воді починає насичуватися водяною парою при 20ºC. (b) При підвищенні температури водяна пара потрапляє в міхур, оскільки його тиск пари збільшується. Бульбашка розширюється, щоб зберегти свій тиск на рівні 1,00 атм. (c) При 100ºC водяна пара постійно потрапляє в міхур, оскільки тиск пари води перевищує парціальний тиск у бульбашці, який повинен бути менше 1,00 атм. Бульбашка росте і піднімається на поверхню.
Ключові моменти
- Цей термін найчастіше використовується для опису переходів між твердим, рідким і газоподібним станами речовини і, в рідкісних випадках, плазмою.
- Як тільки вода досягає температури кипіння, додаткова енергія використовується для зміни стану речовини і збільшення потенційної енергії замість кінетичної енергії.
- Графіки тиску в порівнянні з температурами, приклад фазової діаграми, дають значне уявлення про теплові властивості речовин.
- Відносна вологість - це частка водяної пари в газі в порівнянні зі значенням насичення.
- Оскільки кінетична енергія молекули пропорційна її температурі, випаровування протікає швидше при більш високих температурах.
- Тиск пари збільшується з температурою, оскільки молекулярні швидкості вищі з підвищенням температури.
- Вода закипає при 100 °С, оскільки тиск пари перевищує атмосферний тиск при цій температурі.
Ключові умови
- міжмолекулярні: від однієї молекули до іншої; між молекулами
- плазма: стан речовини, що складається з частково іонізованого газу
- термодинамічні: пов'язані з перетворенням тепла в інші форми енергії.
- рівновага: Стан тіла в спокої або в рівномірному русі, результуюча всіх сил на яке дорівнює нулю.
- Тиск пари: Тиск, який чинить пара, або парціальний тиск, якщо він змішується з іншими газами.
- вологість: Кількість водяної пари в повітрі.
ЛІЦЕНЗІЇ ТА АВТОРСТВА
CC ЛІЦЕНЗОВАНИЙ КОНТЕНТ, РАНІШЕ ДІЛИВСЯ
- Курація та доопрацювання. Надано: Boundless.com. Ліцензія: CC BY-SA: Із Зазначенням Авторства
CC ЛІЦЕНЗОВАНИЙ ВМІСТ, СПЕЦИФІЧНА АТРИБУЦІЯ
- Загальна хімія/фазові зміни. Надано: Вікіпідручники. Знаходиться за адресою: uk.wikibooks.org/wiki/General_chemistry/Phase_changes. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Коледж OpenStax, фазові зміни. 17 вересня 2013 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42218/latest/. Ліцензія: CC BY: Зазначення авторства
- міжмолекулярний. Надано: Вікісловник. Знаходиться за адресою: http://en.wiktionary.org/wiki/intermolecular. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- термодинамічний. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/термодинамічний. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- плазма. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/plasma. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Діаграма стану. Надано: Вікіпедія. Розташовано за адресою: uk.wikipedia.org/wiki/Phase_diagram. Ліцензія: Суспільне надбання: Немає відомих авторських прав
- Діаграма фазового тепла. Надано: Вікіпідручники. Розташований за адресою: uk.wikibooks.org/wiki/Файл:Phase_heat_digarm.png. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Коледж OpenStax, Коледж фізики. 17 вересня 2013 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42219/latest/?collection=col11406/1.7. Ліцензія: CC BY: Зазначення авторства
- Коледж OpenStax, фазові зміни. 17 вересня 2013 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42218/latest/#import-auto-id2387893. Ліцензія: CC BY: Зазначення авторства
- Випаровування. Надано: Вікіпедія. Розташований за адресою: uk.wikipedia.org/wiki/Випаровування. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Коледж OpenStax, Коледж фізики. 17 вересня 2013 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42219/latest/?collection=col11406/1.7. Ліцензія: CC BY: Зазначення авторства
- Випаровування. Надано: Вікіпедія. Розташований за адресою: uk.wikipedia.org/wiki/Випаровування. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- вологість. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/вологість. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- рівновага. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/рівновага. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- тиск пари. Надано: Вікісловник. Розташований за адресою: uk.wiktionary.org/wiki/vapor_pressure. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Діаграма стану. Надано: Вікіпедія. Розташовано за адресою: uk.wikipedia.org/wiki/Phase_diagram. Ліцензія: Суспільне надбання: Немає відомих авторських прав
- Діаграма фазового тепла. Надано: Вікіпідручники. Розташований за адресою: uk.wikibooks.org/wiki/Файл:Phase_heat_digarm.png. Ліцензія: CC BY-SA: Із Зазначенням Авторства
- Коледж OpenStax, Коледж фізики. 3 листопада 2012 року. Надається: OpenSTAX CNX. Знаходиться за адресою: http://cnx.org/content/m42219/latest/?collection=col11406/1.7. Ліцензія: CC BY: Зазначення авторства
