10.4: Властивості рідин
- Page ID
- 22472
- Визначте тиск пари рідин.
- Поясніть походження як поверхневого натягу, так і капілярної дії.
Є деякі властивості, якими володіють всі рідини, в тому числі і вода. Всі рідини мають певну частину частинок з достатньою енергією, щоб увійти в газову фазу, і якщо ці частинки знаходяться на поверхні рідини, то роблять це (рис.\(\PageIndex{1}\)). Освіта газу з рідини при температурах нижче температури кипіння називається випаровуванням. При цих температурах матеріал у газовій фазі називається парою, а не газом; термін газ зарезервований для коли газова фаза є стабільною фазою.
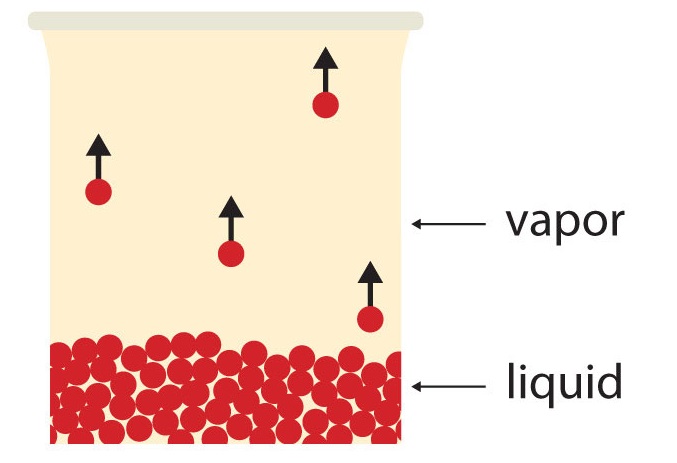
Якщо наявний обсяг досить великий, з часом вся рідина стане парою. Але якщо наявного обсягу буде недостатньо, з часом частина частинок пари знову увійде в рідку фазу (рис.\(\PageIndex{2}\) Рівновага). У якийсь момент кількість частинок, що входять в парову фазу, дорівнюватиме кількості частинок, що виходять з парової фази, тому чистої зміни кількості пари в системі не відбувається. Ми говоримо, що система знаходиться в рівновазі. Парціальний тиск пари при рівновазі називається тиском пари рідини.
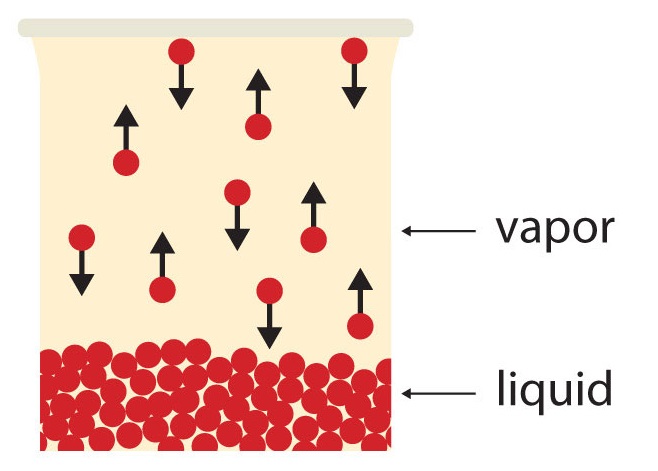
Зрозумійте, що рідина не перестала випаровуватися. Зворотний процес - конденсація - відбувається так само швидко, як і випаровування, тому немає чистої зміни кількості пари в системі. Термін динамічна рівновага являє собою ситуацію, в якій процес все ще відбувається, але протилежний процес також відбувається з тією ж швидкістю, так що в системі немає чистих змін.
Тиск пари для речовини залежить від температури речовини; зі збільшенням температури зростає і тиск пари. Малюнок\(\PageIndex{3}\) - Графіки тиску пари проти температури для декількох рідин - це графік тиску пари проти температури для декількох рідин. Визначивши тиск пари, ми також можемо перевизначити температуру кипіння рідини: температуру, при якій тиск пари рідини дорівнює навколишньому тиску навколишнього середовища. Нормальним тиском пари, значить, є температура, при якій тиск пари дорівнює 760 торр, або рівно 1 атм. Таким чином, точки кипіння змінюються залежно від навколишнього тиску, факт, який може мати великі наслідки для приготування їжі на нижчих або вищих, ніж зазвичай, висотах. Атмосферний тиск значно змінюється в залежності від висоти.
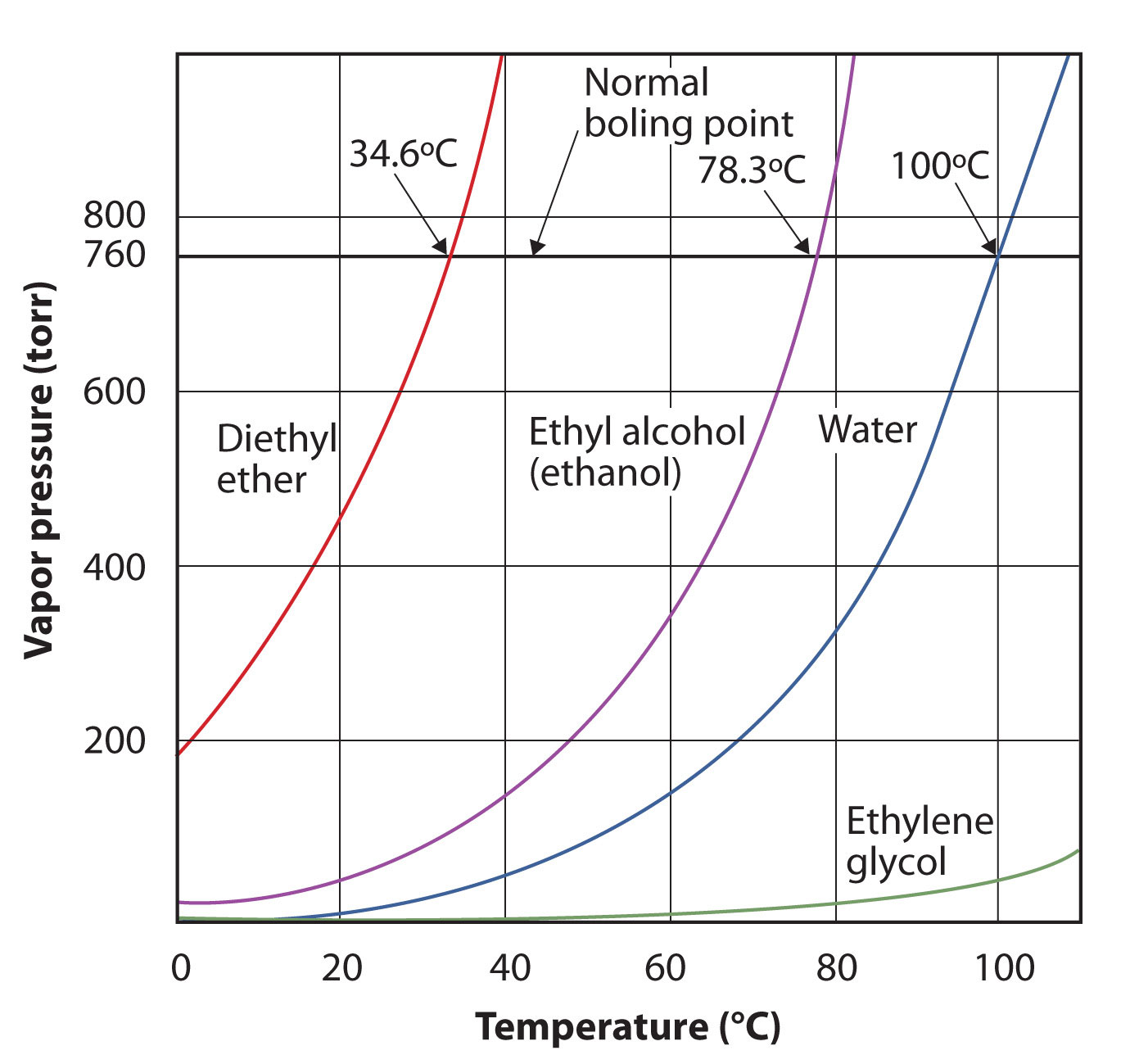
Використовуйте рисунок,\(\PageIndex{3}\) щоб оцінити температуру кипіння води в 500 торр, що є приблизним атмосферним тиском на вершині Евересту.
Рішення
Дивіться супровідну цифру. П'ятсот торр знаходиться між 400 і 600, тому ми продовжимо лінію з цієї точки на осі у поперек кривої для води, а потім опускаємо її вниз до осі х, щоб прочитати відповідну температуру. Схоже, що точка на кривій тиску водяної пари відповідає температурі близько 90° C, тому ми робимо висновок, що температура кипіння води при 500 торр становить 90° C.
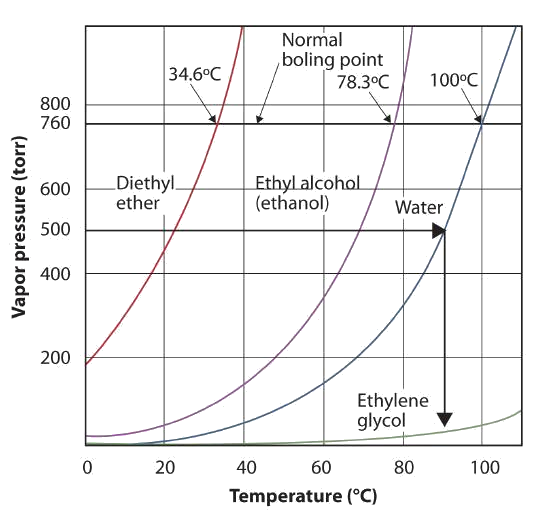
Правильно прочитавши графік, можна оцінити температуру кипіння рідини при різних температурах.
Використовуйте рисунок\(\PageIndex{3}\) для оцінки температури кипіння етанолу при 400 торр.
- Відповідь
-
близько 65° C
Крива тиску пари для води не дорівнює рівному нулю при температурі плавлення 0° C, навіть лід має тиск пари - тому він з часом підвищується. Однак тиск пари твердих речовин, як правило, набагато нижчий, ніж у рідин. При −1° C тиск пари льоду становить 4,2 торр. При температурі морозильної камери 0° F (−17° C) тиск пари льоду становить лише 1,0 торр; так звані глибокі морозильні камери можуть опуститися до −23° C, де тиск пари льоду становить лише 0,6 торр.
Всі рідини мають і деякі інші властивості. Поверхневий натяг - це ефект, викликаний дисбалансом сил на атомах на поверхні рідини, як показано на малюнку\(\PageIndex{4}\). Синя частинка в основній масі рідини відчуває міжмолекулярні сили з усього навколо, як ілюструють стрілки. Однак жовта частинка на поверхні не відчуває над нею ніяких сил, оскільки над нею немає частинок. Це призводить до дисбалансу сил, званого поверхневим натягом.

Поверхневий натяг відповідає за кілька відомих видів поведінки рідин, включаючи воду. Рідини з високим поверхневим натягом мають тенденцію до згортання, коли вони присутні в невеликих кількостях (рис.\(\PageIndex{5}\)).

Поверхневий натяг змушує рідини утворювати сфери у вільному падінні або нульовій гравітації. Поверхневий натяг також відповідає за те, що дрібні комахи можуть «гуляти» по воді. Через поверхневий натяг потрібна енергія, щоб розірвати поверхню рідини, і якщо предмет (наприклад, комаха) досить легкий, не вистачає сили через силу тяжіння для того, щоб об'єкт прорвався через поверхню, тому об'єкт залишається зверху води (рис.\(\PageIndex{6}\)). Акуратно зроблене це явище також можна проілюструвати тонким лезом бритви або скріпкою.

Той факт, що дрібні крапельки води згортаються на поверхні, не означає, що вода - або будь-яка інша рідина - не взаємодіє з іншими речовинами. Іноді тяжіння може бути дуже сильним. Адгезія - це тенденція речовини до взаємодії з іншими речовинами через міжмолекулярних сил, тоді як згуртованість - це тенденція речовини до взаємодії з собою. Якщо сили зчеплення всередині рідини сильніші, ніж сили адгезії між рідиною та іншою речовиною, то рідина має тенденцію утримуватися; вона буде посилюватися. Однак якщо сили адгезії між рідиною та іншою речовиною сильніші за сили зчеплення, то рідина буде розтікатися по іншій речовині, намагаючись максимально розширити інтерфейс між іншою речовиною і рідиною. Кажуть, що рідина змочує іншу речовину.
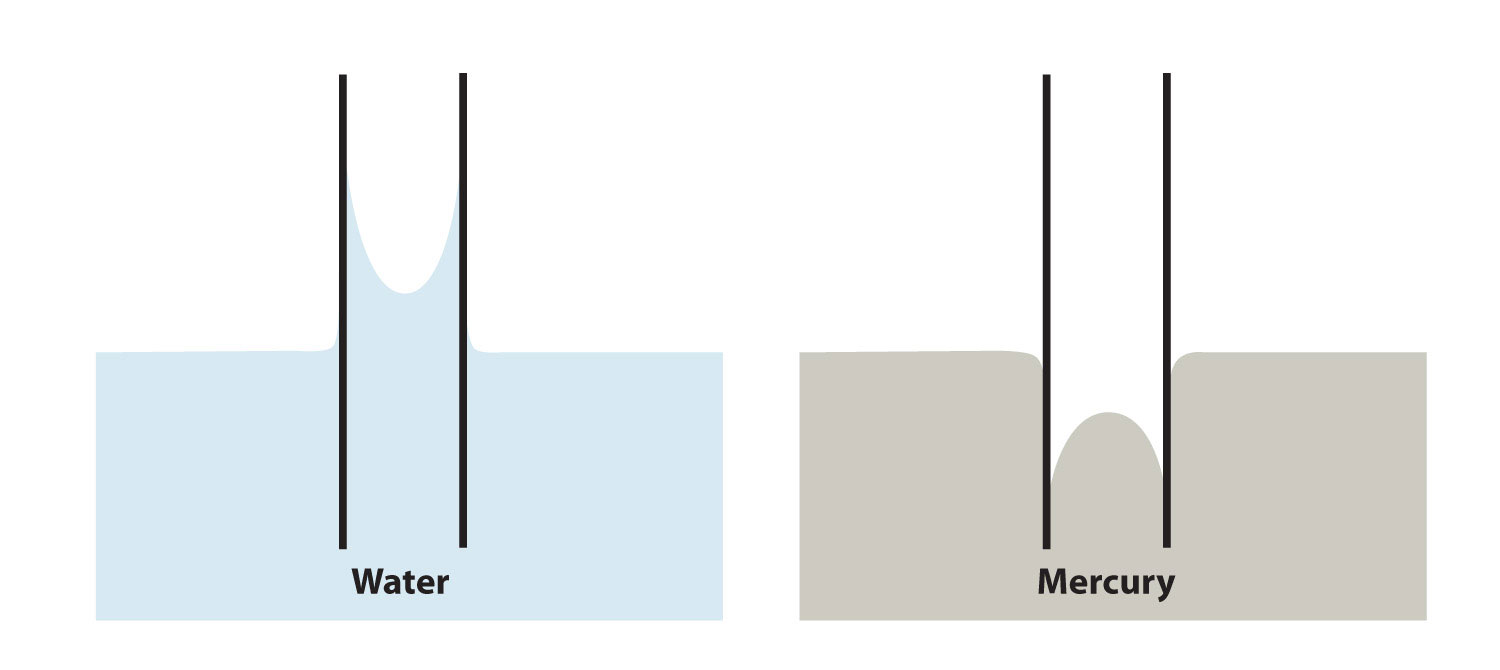
Адгезія і згуртованість важливі і для інших явищ. Зокрема, якщо сили адгезії сильні, то при введенні рідини в трубку невеликого діаметру іншої речовини рідина буде рухатися вгору або вниз в трубці, як би ігноруючи гравітацію. Оскільки крихітні трубочки називаються капілярами, це явище називається капілярною дією. Наприклад, один тип капілярної дії, капілярний підйом, спостерігається, коли вода або рідини на водній основі піднімаються вгору в тонких скляних трубках (як капіляри, які іноді використовуються в аналізах крові), утворюючи вигнуту вгору поверхню, яка називається меніском. Капілярна дія також відповідає за ефект «вологого», який рушники і губки використовують для сушіння вологих предметів; матування волокон утворює крихітні капіляри, які мають хорошу адгезію з водою. Бавовна є хорошим матеріалом для цього; поліестер та інші синтетичні тканини не проявляють подібної капілярної дії, тому ви рідко знайдете рушники для ванни з віскози. Аналогічний ефект спостерігається з рідким паливом або розплавленим воском і їх гнітами. Вважається, що капілярна дія принаймні частково відповідає за транспортування води від коренів до верхівок дерев, навіть високих.
З іншого боку, деякі рідини мають сильніші сили зчеплення, ніж сили адгезії. У цьому випадку при наявності капіляра рідина витісняється з його поверхні; це приклад типу капілярної дії, званого капілярним депресією. При цьому меніск вигинається вниз. Ртуть має дуже сильні сили зчеплення; при поміщенні капіляра в басейн ртуті поверхню ртутної рідини пригнічується (рис.\(\PageIndex{7}\)).
Відповідальним автовласникам рекомендується регулярно восковувати свої автомобілі. Окрім того, що автомобіль виглядає приємніше, він також допомагає захистити поверхню, особливо якщо поверхня металева. Чому?
Відповідь пов'язана зі зчепленням і адгезією (і, в меншій мірі, іржею). Вода є важливим фактором іржавіння заліза, іноді широко застосовується у зовнішніх кузовах автомобілів. Утримання води подалі від металу - один із способів мінімізувати іржавіння. У цьому допомагає шар фарби. Однак брудна або подряпана фарба може притягувати воду, а сили клею дозволять воді змочувати поверхню, максимізуючи її контакт з металом і сприяючи іржі.

Віск складається з довгих молекул вуглеводнів, які погано взаємодіють з водою. (Вуглеводні - це сполуки з атомами C і H; докладніше про вуглеводні див. Розділ 16). Тобто тонкий шар воску не буде змочуватися водою. Свіжовощений автомобіль має низькі сили зчеплення з водою, тому вода намивається на поверхню, як наслідок її зчеплення і поверхневого натягу. Це мінімізує контакт води з металом, тим самим мінімізуючи іржу.
Резюме
- Всі рідини випаровуються.
- Якщо обсяг обмежений, випаровування з часом досягає динамічної рівноваги, і підтримується постійний тиск пари.
- Всі рідини відчувають поверхневий натяг, дисбаланс сил на поверхні рідини.
- Всі рідини відчувають капілярну дію, демонструючи або капілярний підйом, або капілярне депресію в присутності інших речовин.
