1.1: Вступ - Статистична фізика та термодинаміка
- Page ID
- 76775
Статистична фізика (альтернативно називається «статистична механіка») та термодинаміка - це два різних, але пов'язаних підходи до однієї мети: приблизний опис «внутрішніх» 2 властивостей великих фізичних систем, зокрема тих, що складаються з\(N >> 1\) ідентичні частинки — або інші компоненти. Традиційним прикладом такої системи є порція газу в масштабі людини, з\(N\) кількістю атомів/молекул 3 порядку числа Авогадро\(N_A \sim 10^{23}\) (див. Розділ 4 нижче).
Мотивація статистичного підходу до таких систем проста: навіть якби закони, що регулюють динаміку кожної частинки і їх взаємодій, були точно відомі, і ми мали в своєму розпорядженні нескінченні обчислювальні ресурси, обчислення точної еволюції системи в часі було б неможливо, при хоча б тому, що абсолютно нездійсненно виміряти точний початковий стан кожної складової — у класичному випадку початкове положення і швидкість кожної частинки. Ситуацію ще більше посилюють явища хаосу і турбулентності, 4 і квантово-механічної невизначеності, які не дозволяють точно обчислити кінцеві положення і швидкості частинок складових, навіть якщо їх початковий стан відомий з найкращою точністю. В результаті в більшості ситуацій можуть бути зроблені тільки статистичні прогнози про поведінку таких систем, при цьому теорія ймовірностей стає основним інструментом математичного арсеналу.
Однак статистичний підхід не такий поганий, як може здатися. Дійсно, практично само собою зрозуміло, що будь-яка вимірювана макроскопічна змінна, що характеризує стаціонарну систему\(N >> 1\) частинок в цілому (подумайте, наприклад, про стаціонарний тиск\(P\) газу, що міститься в фіксованому обсязі\(V\)) практично постійна в часі. Дійсно, як ми побачимо нижче, окрім певних екзотичних винятків, відносна величина коливань — або в часі, або серед багатьох макроскопічно схожих систем — такої змінної є порядком\(1/N^{1/2}\), а для\(N \sim N_A\) вкрай мала. Як результат, середні значення відповідних макроскопічних змінних можуть досить добре характеризувати стан системи — задовільно майже для всіх практичних цілей. Розрахунок зв'язків між такими середніми значеннями - єдине завдання термодинаміки і основне завдання статистичної фізики. (Коливання можуть бути важливими, але через їх малість, в більшості випадків їх аналіз може базуватися на збурювальних підходах — див. Розділ 5.)
Тепер давайте швидко розглянемо типові макроскопічні змінні, з якими повинна працювати статистична фізика та термодинаміка. Оскільки я вже згадував тиск\(P\) і обсяг\(V\), дозвольте мені почати з цієї знаменитої пари змінних. Перш за все, зверніть увагу, що volume - це велика змінна, тобто змінна, значення якої для системи, що складається з декількох невзаємодіючих частин, є сумою таких її частин. З іншого боку, тиск є прикладом інтенсивної змінної, значення якої однакове для різних частин системи - якщо вони знаходяться в рівновазі. Щоб зрозуміти чому\(P\) і\(V\) сформувати природну пару змінних, розглянемо класичну майданчик термодинаміки, порцію газу, що міститься в циліндрі, закриту рухомим поршнем площі\(A\) (рис.\(\PageIndex{1}\)).
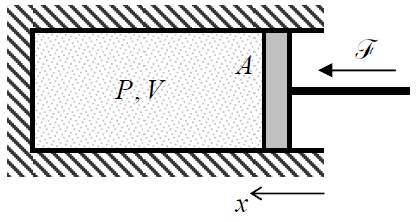
Нехтуючи тертям між стінками і поршнем, і припускаючи, що воно\(P\) рухається настільки повільно, що тиск практично однаково для всіх частин обсягу в будь-який момент, елементарна робота зовнішньої сили\(\mathscr{F} = PA\), стискаючи газ, при невеликому переміщенні поршня \(dx = –dV/A\), є
Робота на газі:
\[\boxed{d\mathscr{W} = \mathscr{F}dx = \left(\frac{\mathscr{F}}{A}\right) (Adx) = -PdV.} \label{1}\]
Звичайно, останній вираз є більш загальним, ніж модель\(\PageIndex{1}\), показана на малюнку, і не залежить від конкретної форми поверхні системи. 5 (Зверніть увагу, що в позначеннях Equation (\ ref {1}), які будуть використовуватися через курс, елементарна робота, виконана газом на зовнішній системі дорівнює\(–d\mathscr{W}\).)
З точки зору аналітичної механіки 6\(V\) і\((–P)\) є лише однією з безлічі можливих канонічних пар узагальнених координат\(q_j\) і узагальнених сил\(\mathscr{F}_j\), чиї продукти\(d\mathscr{W}_j = \mathscr{F}_jdq_j\) дають самостійний внесок в сумарну роботу навколишнього середовища на аналізується система. Наприклад, читач, знайомий з основами електростатики, знає, що якщо просторовий розподіл\( \pmb{\mathscr{E}}\mathbf{(r)}\) зовнішнього електричного поля не залежить від електричної поляризації\(\pmb{\mathscr{P}} \mathbf{(r)}\) розміщеної в поле діелектричної середовища, її елементарна робота на середовищі становить
\[d \mathscr{W}=\int \pmb{\mathscr{E}}(\mathbf{r}) \cdot d \pmb{\mathscr{P}}(\mathbf{r}) d^{3} r \equiv \int \sum_{j=1}^{3} \mathscr{E}_{j}(\mathbf{r}) d \mathscr{P}_{j}(\mathbf{r}) d^{3} r . \label{2a}\]
\[d \mathscr{W}=\sum_{k} d \mathscr{W}_{k}, \quad \text{ with } d \mathscr{W}_{k}=\pmb{\mathscr{E}} \left(\mathbf{r}_{k}\right) \cdot d \pmb{\mathcal{p}}_{k} .\label{2b}\]
\[\begin{align} d \mathscr{W}=\mu_{0} \int \pmb{\mathscr{H}}(\mathbf{r}) \cdot d \pmb{\mathscr{M}}(\mathbf{r}) d^{3} r \equiv \mu_{0} \int \sum_{j=1}^{3} \mathscr{H}_{j}(\mathbf{r}) d \mathscr{M}_{j}(\mathbf{r}) d^{3} r, \label{3a} \\ d \mathscr{W}=\sum_{k} d \mathscr{W}_{k}, \quad \text{ with } d \mathscr{W}_{k}=\mu_{0} \pmb{\mathscr{H}} \left(\mathbf{r}_{k}\right) \cdot d \pmb{\mathcal{m}}_{k} \label{3b}. \end{align} \]
де\(\pmb{\mathscr{M}}\) і\(\pmb{\mathcal{m}}\) є векторами, відповідно, намагніченості середовища і магнітного моменту одного диполя. Формули (\ ref {2a} -\ ref {2b}) і (\ ref {3a} -\ ref {3b}) показують, що роль узагальнених координат можуть грати декартові компоненти векторів\(\pmb{\mathscr{P}}\) (або\(\pmb{\mathcal{p}}\)) і\(\pmb{\mathscr{M}}\) (або\(\pmb{\mathcal{m}}\)), причому складові електричного та магнітного полів відіграють роль відповідних генералізовані сили. Цей список може бути поширений на інші взаємодії (такі як гравітація, поверхневий натяг у рідинях тощо). Слідуючи традиції, я буду використовувати\(\{–P, V \}\) пару майже у всіх формулах нижче, але читач повинен пам'ятати, що всі вони дійсні для будь-якої іншої пари\(\{\mathscr{F}_j, q_j\}\). 9
Знову ж таки, конкретні відносини між змінними кожної пари, перерахованої вище, можуть залежати від статистичних властивостей аналізованої системи, але їх визначення не засновані на статистиці. Ситуація дуже різна для дуже конкретної пари змінних, температури\(T\) та ентропії\(S\), хоча ці «сестринські змінні» беруть участь у багатьох формулах термодинаміки точно так, ніби вони були лише ще однією канонічною парою\(\{\mathscr{F}_j, q_j\}\). Однак саме існування цих двох понять обумовлено статистикою. А саме температура\(T\) - це інтенсивна змінна, яка характеризує ступінь термічного «перемішування» компонентів системи. Навпаки, ентропія\(S\) - це велика змінна, яка в більшості випадків ухиляється від безпосереднього сприйняття людськими органами почуттів; це якісний показник розладу системи, тобто ступеня нашого незнання про її точний мікроскопічний стан. 10
Причина появи\(\{T, S\}\) пари змінних у формулах термодинаміки та статистичної механіки полягає в тому, що статистичний підхід до великих систем частинок приносить якісно нові результати, особливо поняття незворотної еволюції часу колективної ( макроскопічні) змінні, що описують систему. З одного боку, незворотність виглядає абсолютно природно при таких явищах, як дифузія чорнильної краплі в склянці води. Спочатку молекули чорнила розташовуються в певній невеликій частині обсягу системи, тобто в деякій мірі впорядковані, тоді як на пізніх стадіях дифузії положення кожної молекули в склі по суті випадкове. Однак, як друга думка, незворотність є досить дивною, враховуючи, що закони, що регулюють рух компонентів системи, є часово-оборотними - такими як закони Ньютона або основні закони квантової механіки. 11 Дійсно, якби на пізній стадії процесу дифузії ми змінили швидкості всіх молекул точно і одночасно, молекули чорнила знову зібралися б (на мить) у вихідну пляму. 12 Проблема полягає в тому, що отримання інформації, необхідної для точного розвороту швидкості, неможливо. Цей приклад показує глибокий зв'язок між статистичною механікою та теорією інформації.
Якісне обговорення дилеми оборотності-незворотності вимагає чіткого визначення основного поняття статистичної механіки (та й взагалі теорії ймовірностей), статистичного ансамблю, і хотілося б відкласти його до початку глави 2. Зокрема, в цьому розділі ми побачимо, що основним законом незворотної поведінки є збільшення ентропії\(S\) в будь-якій замкнутій системі. Таким чином, статистична механіка, не кидаючи виклику «мікроскопічним» законам, що регулюють еволюцію компонентів системи, вводить поверх них деякі нові «макроскопічні» закони, іскромно пов'язані з еволюцією інформації, тобто ступенем нашого пізнання мікроскопічного стану система.
На завершення цього короткого обговорення змінних, дозвольте мені згадати, що, як і у всіх галузях фізики, дуже особливу роль у статистичній механіці відіграє енергія\(E\). Щоб підкреслити прихильність нехтувати рухом системи в цілому в цій підгалузі фізики,\(E\) розглянуту в термодинаміці її часто називають внутрішньою енергією, хоча саме для стислості я пропущу цей прикметник в більшості випадків. Найпростішим прикладом такого\(E\) є сума кінетичних енергій молекул в розбавленому газі при їх тепловому русі, але в цілому внутрішня енергія також включає в себе не тільки окремі енергії компонентів системи, але і їх взаємодії між собою. Окрім кількох «патологічних» випадків дуже далеких взаємодій, ці взаємодії можуть розглядатися як локальні; у цьому випадку внутрішня енергія пропорційна\(N\), тобто є великою змінною. Як буде показано нижче, інші великі змінні з розмірністю енергії часто також дуже корисні, включаючи вільну енергію (Гельмгольца)\(F\), енергію Гіббса\(G\), ентальпію\(H\) та великий потенціал\(\Omega\). (Збірна назва таких змінних - термодинамічні потенціали.)
Тепер ми готові до короткого обговорення взаємозв'язку між статистичною фізикою і термодинамікою. Хоча завданням статистичної фізики є обчислення макроскопічних змінних, розглянутих вище 13 для різних мікроскопічних моделей системи, основна роль термодинаміки полягає у виведенні деяких загальних зв'язків між середніми значеннями макроскопічних змінних (також званих термодинамічні змінні), які не залежать від конкретних моделей. Дивно, але здійснити такий подвиг можна, використовуючи лише кілька або очевидних, або дуже правдоподібних загальних припущень (іноді їх називають законами термодинаміки), які знаходять своє доказ в статистичній фізиці. 14 Такі загальні співвідношення дозволяють істотно скоротити кількість розрахунків, які нам доводиться робити в статистичній фізиці: в більшості випадків досить обчислити зі статистики всього одну-дві змінні, а потім використовувати загальні термодинамічні відносини, щоб отримати всі інші властивості інтерес. Таким чином, термодинаміка, іноді сприймається як феноменологія, заслуговує на всяку повагу не тільки як корисний теоретичний інструмент, але і як дисципліна, більш загальна, ніж будь-яка конкретна статистична модель. Саме тому балансу цієї глави присвячений короткий огляд термодинаміки.
