16.4: Закон держав-кореспондентів
- Page ID
- 26956
ван дер Ваальс припускав, що всі реальні гази у відповідних станах повинні вести себе аналогічно. Відповідний стан, який вирішив використовувати ван дер Ваальс, називається відновленим станом, яке засноване на відхиленні умов речовини від власних критичних умов. Ми можемо визначити зменшені кількості:
\[P_r = \dfrac{P}{P_c} \nonumber \]
\[V_r= \dfrac{V}{V_c} \nonumber \]
\[T_r= \dfrac{T}{T_c} \nonumber \]
Шляхом підстановки в рівняння ван дер Ваальса знаходимо:
\[ \left( P_r + \dfrac{3}{\bar{V}_r^2} \right) \left( \bar{V}_r - \dfrac{1}{3} \right) = \dfrac{8}{3} T_r \label{vdw} \]
А значить, критичні параметри для газу можуть бути виражені термінами\(a\) і\(b\) параметрами:
\[V_c=3b \nonumber \]
\[P_c=\dfrac{a}{27b^2} \nonumber \]
і:
\[T_c=\dfrac{8a}{27b R} \nonumber \]
Формування рівняння стану ван де Ваала за критичними параметрами в Рівнянні\(\ref{vdw}\) є універсальним рівнянням для всіх газів. Хоча фактичний тиск і обсяги можуть відрізнятися, два гази, як кажуть, знаходяться у відповідних станах, якщо їх знижений тиск, об'єм і температура однакові. Це говорить про те, що поведінка всіх газів (і рідин!!) майже однаковий, за винятком коефіцієнта масштабування, який пов'язаний з критичною точкою речовини. Значення стисливості (\(Z\)) 3/8 в критичній точці для рівняння ван дер Ваальса насправді не так добре узгоджується з вимірюванням. Ось чому більш складні вирази Redlich-Kwong і Peng-Robertson краще, хоча ідея однакова. Отже, все, що потрібно знати, щоб описати поведінку будь-якої рідини, є її критичною точкою. Наприклад, аргон поводиться приблизно так само при 300 К, як етан при 600 К, оскільки ці температури відповідають подвійним відповідним критичним температурам (150,72 К і 305,4 К відповідно)\(T_r=2.0\).
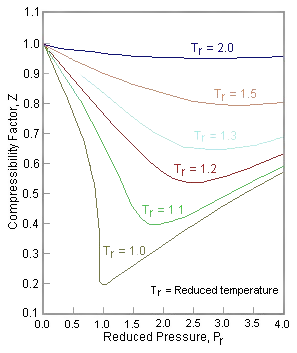
Ми можемо переписати універсальний вираз стисливості\(Z\) за допомогою зменшених змінних і побудувати\(Z\) виміряні значення проти зниженого тиску\(P_r\) (див. Рис. Template:index). Як бачите, дуже різні гази/рідини, такі як азот і вода, можуть збігатися, якщо їх властивості побудовані відносно там критичних точок, а не в абсолютному вираженні. коефіцієнт стисливості\(Z\) can also be cast into the form of corresponding states showing that \(Z\) also can be expressed as a universal function of \(V_r\) and \(T_r\) or any other two reduced quantities:
\[Z=\dfrac{\bar{V}_r}{\bar{V}_r–\dfrac{1}{3}} – \dfrac{9}{8\bar{V}_r T_r} \nonumber \]
Ван дер Ваальс не зупинився на цьому. Далі він описував першопричину конденсації газів у рідини при більш низьких температурах: привабливі взаємодії між молекулами.