13.1: Електромагнітний спектр
- Page ID
- 26891
Важливим аспектом вивчення фізичної хімії є можливість розпізнавати взаємодію молекул з навколишнім середовищем. Молекулярна спектроскопія забезпечує чітке зображення того, як двоатомні та багатоатомні молекули взаємодіють, дивлячись на частоту, довжину хвилі, номер хвилі, енергію та молекулярний процес. Ми також зможемо побачити властивості поглинання молекул в різних регіонах з електромагнітного спектра.
Електромагнітне випромінювання
Електромагнітне випромінювання - світло - це форма енергії, поведінка якої описується властивостями як хвиль, так і частинок. Деякі властивості електромагнітного випромінювання, такі як його заломлення при переході від одного середовища до іншого, найкраще пояснюються описом світла як хвилі. Інші властивості, такі як поглинання та випромінювання, краще описуються шляхом обробки світла як частинки. Точна природа електромагнітного випромінювання залишається незрозумілою, як це було з часів розвитку квантової механіки в першій чверті 20-го століття. Тим не менш, подвійні моделі поведінки хвиль і частинок дають корисний опис електромагнітного випромінювання.
Електромагнітне випромінювання складається з коливальних електричних і магнітних полів, які поширюються через простір по лінійному шляху і з постійною швидкістю. У вакуумі електромагнітне випромінювання рухається зі швидкістю світла\(c\), яка є\(2.997 92 \times 10^8\, m/s}\). Коли електромагнітне випромінювання рухається через середовище, відмінне від вакууму\(v\), його швидкість, менше швидкості світла у вакуумі. Різниця між\(v\) і\(c\) досить мала (< 0,1%), що швидкість світла до трьох значущих цифр\(3.00 \times 10^8\, m/s\), є досить точною для більшості цілей.
Коливання в електричному і магнітному полах перпендикулярні один одному, і напрямку поширення хвилі. На малюнку Template:index показано приклад плоскополяризованого електромагнітного випромінювання, що складається з одного коливального електричного поля і одного коливального магнітного поля.
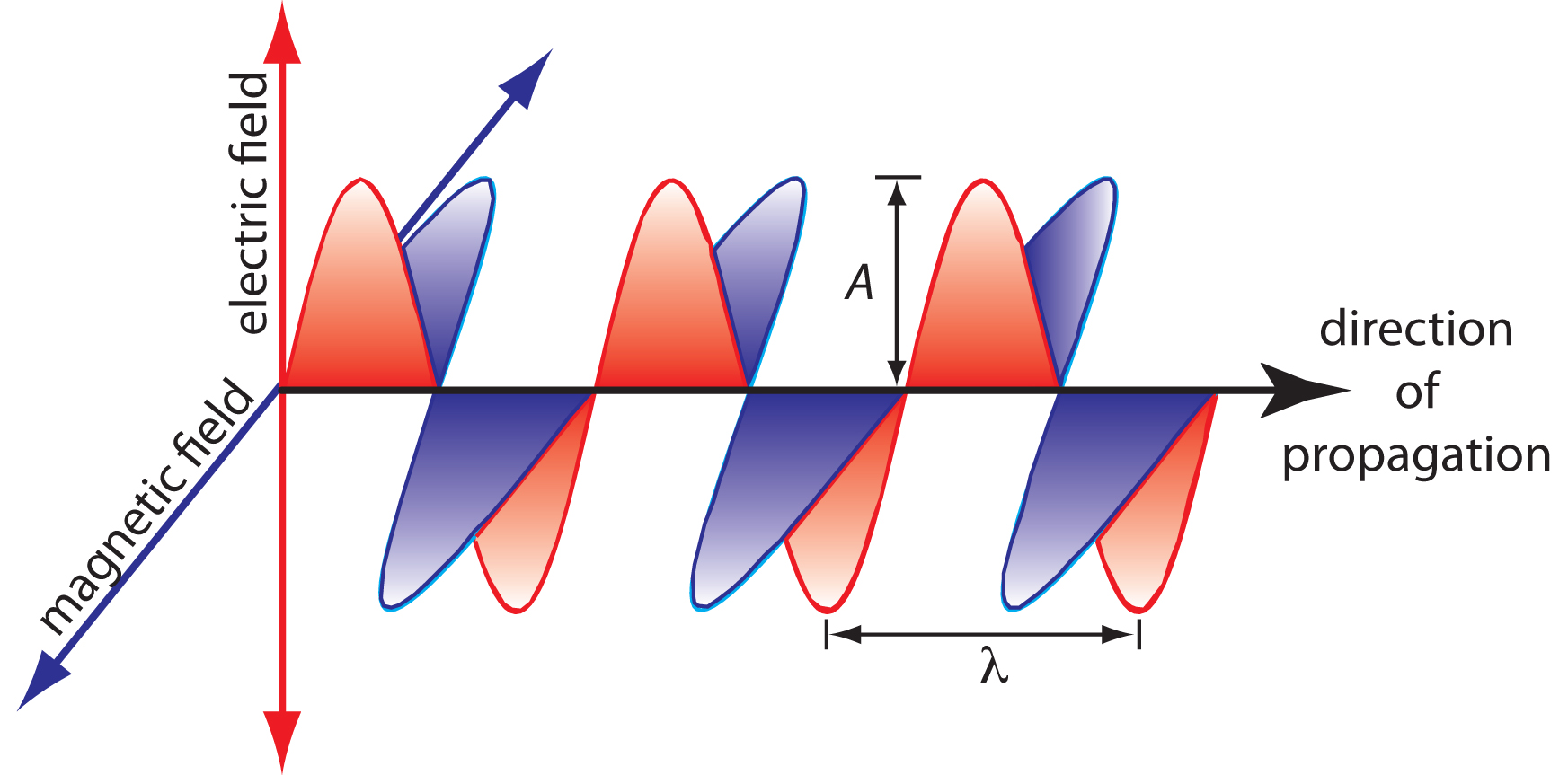
Електромагнітна хвиля характеризується декількома основними властивостями, включаючи її швидкість, амплітуду, частоту, фазовий кут, поляризацію та напрямок поширення. 2 Наприклад, амплітуда коливального електричного поля в будь-якій точці вздовж поширюється хвилі дорівнює
\[A_\ce{t} = A_\ce{e}\sin(2πνt + \phi) \nonumber \]
де\(A_t\) величина електричного поля в часі\(t\),\(A_e\) максимальна амплітуда електричного поля,\(\nu\) частота хвилі - кількість коливань в електричному полі за одиницю часу - і\(\phi\) є фазовим кутом, який доводиться на те, що не\(A_t\) потрібно мати значення нуля при\(t = 0\). Ідентичне рівняння для магнітного поля
\[A_\ce{t} =A_\ce{m}\sin(2πνt + \phi) \nonumber \]
де\(A_m\) - максимальна амплітуда магнітного поля.
Частота і довжина хвилі електромагнітного випромінювання змінюються на багато порядків. Для зручності ми розділимо електромагнітне випромінювання на різні області - електромагнітний спектр - виходячи з типу атомного або молекулярного переходу, що спричиняє поглинання або випромінювання фотонів (рис. Template:index). Межі між областями електромагнітного спектра не жорсткі, і можливе перекриття між спектральними областями.
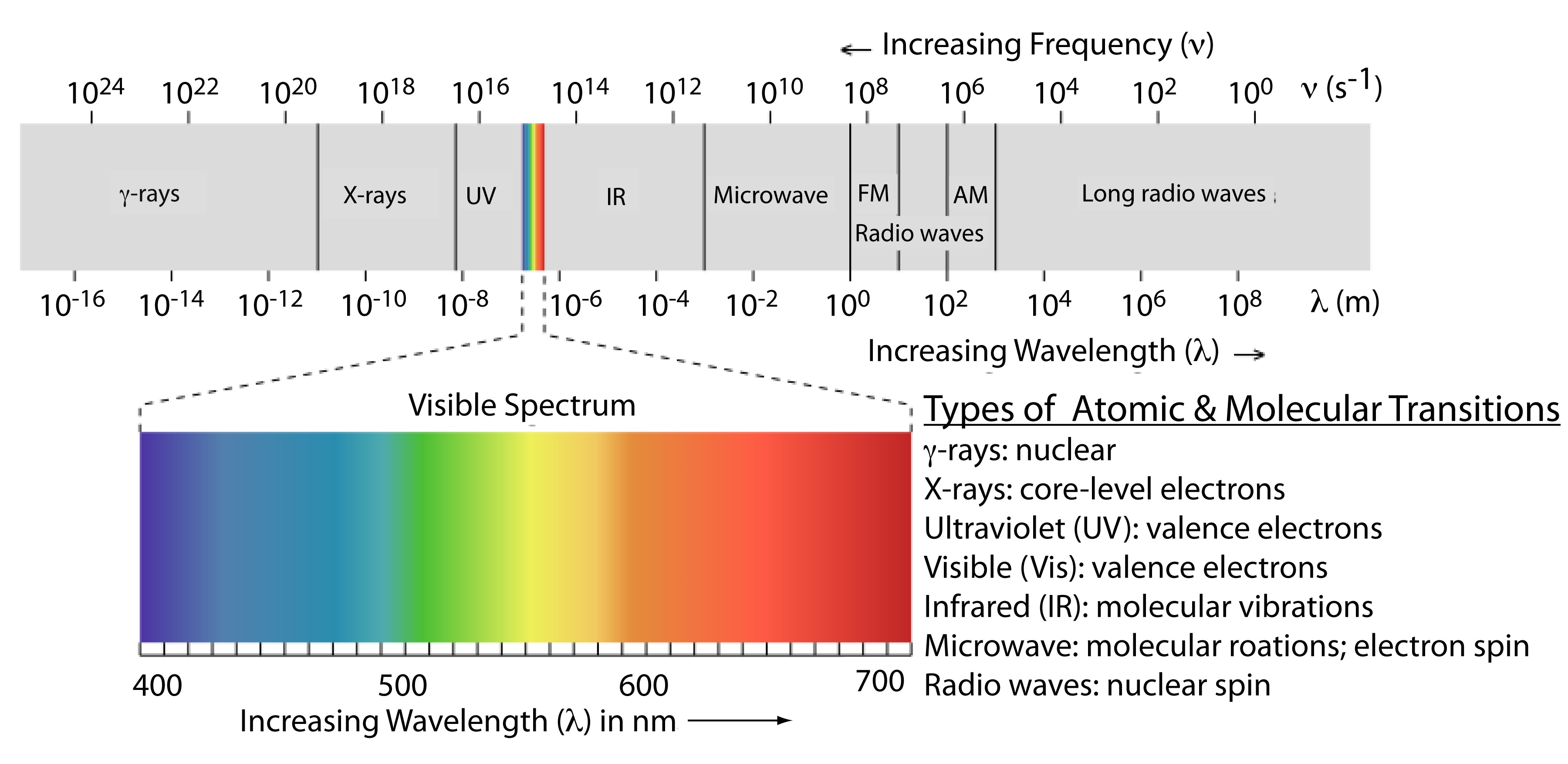
Інші підрозділи
Інші властивості також корисні для характеристики хвильової поведінки електромагнітного випромінювання. Довжина хвилі λ визначається як відстань між послідовними максимумами (Рисунок Template:index). Для ультрафіолетового і видимого електромагнітного випромінювання довжина хвилі зазвичай виражається в нанометрах (1 нм = 10 —9 м), а для інфрачервоного випромінювання - в мікрон (1 мкм = 10 —6 м). Зв'язок між довжиною хвилі і частотою становить
\[λ = \dfrac{c}{ν} \nonumber \]
Ще однією одиницею корисної одиниці є хвильовийчисло\(\tilde{ν}\), яке є зворотним довжині хвилі.
\[\tilde{ν} = \dfrac{1}{λ} \nonumber \]
Хвильові числа часто використовуються для характеристики інфрачервоного випромінювання, причому одиниці наведені в см -1.
У 1817 році Йозеф Фраунгофер вивчав спектр сонячного випромінювання, спостерігаючи суцільний спектр з численними темними лініями. Фраунгофер позначив найбільш помітні з темних ліній літерами. У 1859 році Густав Кірхгофф показав, що лінія D в сонячному спектрі обумовлена поглинанням сонячного випромінювання атомами натрію. Довжина хвилі лінії натрію D становить 589 нм. Які частоти і хвильового числа для цього рядка?
Рішення
Частота і хвильовий номер лінії натрію D є
\[ν = \dfrac{c}{λ} = \mathrm{\dfrac{3.00×10^8\: m/s}{589×10^{−9}\: m} = 5.09×10^{14}\: s^{−1}} \nonumber \]
\[\tilde{ν} = \dfrac{1}{λ} = \mathrm{\dfrac{1}{589×10^{−9}\: m} × \dfrac{1\: m}{100\: cm} = 1.70×10^4\: cm^{−1}} \nonumber \]
Іншою історично важливою серією спектральних ліній є серія Бальмера емісійних ліній утворюють водень. Одна з ліній має довжину хвилі 656,3 нм. Які частоти і хвильового числа для цього рядка?
Вище ми визначили кілька характерних властивостей електромагнітного випромінювання, включаючи його енергію, швидкість, амплітуду, частоту, фазовий кут, поляризацію та напрямок поширення. Спектроскопічне вимірювання можливо тільки в тому випадку, якщо взаємодія фотона зі зразком призводить до зміни одного або декількох з цих характерних властивостей. Спектроскопію можна розділити на два широкі класи методик. В одному класі методик відбувається передача енергії між фотоном і зразком. Таблиця Template:index містить список кількох репрезентативних прикладів.
| Тип передачі енергії | Область електромагнітного спектра | Спектроскопічна техніка |
|---|---|---|
| поглинання | γ -промінь | Спектроскопія Моссбауера |
| Рентген | Рентгенівська спектроскопія | |
| УФ/Віс |
UV/Vis спектроскопія атомно-абсорбційна спектро |
|
| ІР |
інфрачервона спектроскопія Раманова спектроскопія |
|
| Мікрохвильова піч | мікрохвильова спектроскопія | |
| Радіохвиля |
електронно-спінова резонансна спектроскопія ядерно-магнітно-резонансна спектроскопія |
|
| емісія (теплове збудження) | УФ/Віс | атомно-емісійна спектро |
| фотолюмінесценція | Рентген | Рентген флуоресценція |
| УФ/Віс |
флуоресцентна спектроскопія фосфоресцентна спектроскопія атомна флуоресцентна спектроскопія |
|
| хемілюмінесценція | УФ/Віс | хемілюмінесцентна спектроскопія |
Електромагнітний спектр забезпечує чітку інформацію про молекули, якщо це обертальні переходи, коливальні переходи або електронні переходи. Молекулу або набір молекул можна зчитувати шляхом поглинання мікрохвильового випромінювання, яке забезпечує переходи між рівнями обертальної енергії. Крім того, якщо молекули поглинають інфрачервоне випромінювання, то переходи між коливальними рівнями слідують переходи між обертальними рівнями енергії. Нарешті, коли молекули поглинають видиме і ультрафіолетове випромінювання дає переходи між електронними енергетичними рівнями, слідують одночасні переходи між вібраційним і обертальним рівнями
Коли задано енергетичний рівень молекул разом з довжиною хвилі, ми можемо легко визначити частоту молекул, де вони потрапляють в області електромагнітного спектра:
\[\Delta E=E_u-E_l=h \nu \nonumber \]
Вищевказане рівняння описує зміну енергії між верхнім станом і нижнім станом енергії.
- Частота падає між 10 9 - 10 11, що знаходиться в мікрохвильовому діапазоні корелює з обертанням багатоатомних молекул.
- Частота падає між 10 11 - 10 13, що знаходиться в далекому інфрачервоному діапазоні корелює з обертанням малих молекул.
- Частота падає між 10 13 - 10 14, що в інфрачервоному діапазоні корелює з коливаннями гнучких зв'язків.
- Частота падає між 10 14 - 10 16, що знаходиться у видимому і ультрафіолетовому діапазоні корелює з електронними переходами.
Потужна техніка з'ясування частоти молекул може допомогти нам визначити довжину зв'язку, температуру, розподіл ймовірностей, як ви дізнаєтеся пізніше від ступеня свободи і як процес проходить в конкретній реакції.