9.8: Молекулярно-орбітальна теорія не передбачає стабільну двоатомну молекулу гелію
- Page ID
- 26882
- Використання порядку зв'язку як метрики для існування молекул
Замовлення облігацій
У електронних структурах Льюїса кількість електронних пар, що тримають два атоми разом, називалося порядком зв'язків. В рамках молекулярно-орбітального підходу порядок зв'язку визначається як половина чистого числа зв'язкових електронів:
\[ \text{bond order}=\dfrac{\text{number of bonding electrons} - \text{number of antibonding electrons}}{2} \label{9.8.1} \]
Щоб обчислити порядок зв'язку\(H_2\), ми знаємо, що\(σ_{1s}\) (склеювання) молекулярна орбіталь містить два електрони, тоді як\( \sigma _{1s}^{\star } \) (антизв'язуюча) молекулярна орбіталь порожня. Отже, порядок\(H_2\) облігацій
\[ \text{bond order}=\dfrac{2-0}{2}=1 \label{9.8.2} \]
Цей результат відповідає одиночному ковалентному зв'язку; подвійні і потрійні зв'язки містять відповідно чотири або шість електронів і відповідають зв'язковим порядкам 2 і 3.
Ми можемо використовувати діаграми енергетичного рівня для опису зв'язку в інших парах атомів та іонів, де n = 1, наприклад, іон H 2 +, іон He 2 + та молекула He 2. Знову ж таки, ми спочатку заповнюємо молекулярні орбіталі з низькою енергією, будучи впевненими, що не порушуватимемо принцип Паулі або Правила Гунда.

\(\PageIndex{1a}\)На малюнку показана діаграма енергетичного рівня для іона H 2 +, який містить два протони і тільки один електрон. Одиночний електрон займає\(σ_{1s}\) склеювальну молекулярну орбіталь, надаючи (σ 1 с) 1 електронну конфігурацію. Кількість електронів в орбіталі позначається верхнім індексом. У цьому випадку порядок зв'язку є (через Equation\ ref {9.8.1})
\[\text{bond order}=\dfrac{1-0}{2}=1/2 \nonumber \]
Оскільки порядок зв'язку більше нуля, іон H 2 + повинен бути більш стабільним, ніж ізольований атом H та протон. Тому ми можемо використовувати молекулярну орбітальну діаграму рівня енергії та розрахунковий порядок зв'язку для прогнозування відносної стабільності таких видів, як H 2 +. При порядку зв'язку всього 1/2 зв'язок в Н 2 + повинна бути слабкішою, ніж в молекулі Н 2, а зв'язок H—H повинна бути довшою. Як показано в таблиці Template:index, ці прогнози узгоджуються з експериментальними даними.
| види | Конфігурація електрона | Замовлення облігацій | Довжина облігації (pm) | Енергія зв'язку (кДж/моль) |
|---|---|---|---|---|
| Н 2 + | \((σ_{1s})^1\) | 1/2 | 106 | 269 |
| Н 2 | \((σ_{1s})^2\) | 1 | 74 | 436 |
| Він 2 + | \( \left (\sigma _{1s} \right )^{2}\left (\sigma _{1s}^{\star } \right )^{1} \) | 1/2 | 108 | 251 |
| Він 2 | \( \left (\sigma _{1s} \right )^{2}\left (\sigma _{1s}^{\star } \right )^{2} \) | 0 | 5 500 | \(4.6 \times 10^{−5}\) |
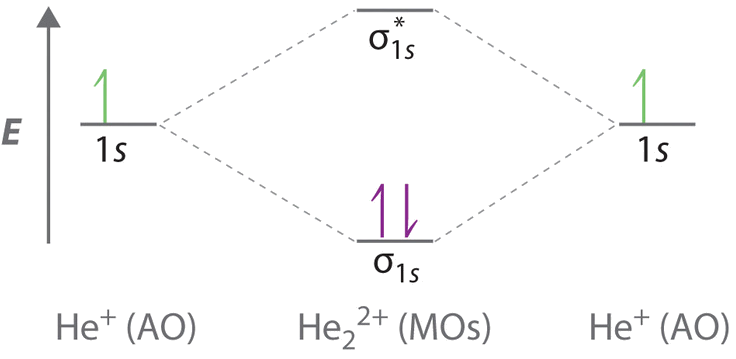
Малюнок\(\PageIndex{1b}\) являє собою молекулярну орбітальну діаграму енергетичного рівня для\(\ce{He_2^{2+}}\). Цей іон має в цілому три валентні електрони. Оскільки перші два електрони повністю заповнюють\(σ_{1s}\) молекулярну орбіталь, принцип Паулі стверджує, що третій електрон повинен знаходитися в\( \sigma _{1s}^{\star} \) антизв'язуючій орбіталі, надаючи\( \left (\sigma _{1s} \right )^{2}\left (\sigma _{1s}^{\star } \right )^{1} \) електронну конфігурацію. Ця електронна конфігурація дає порядок зв'язку (через Equation\ ref {9.8.1})
\[\text{bond order}=\dfrac{2-1}{2}=1/2 \nonumber \]
Як і у випадку з H 2 +, іон Він 2 + повинен бути стабільним, але зв'язок Він - Він повинен бути слабкішим і довшим, ніж у H 2. Насправді іон He 2 + може бути отриманий, і його властивості узгоджуються з нашими прогнозами (Таблиця Template:index).
Використовуйте молекулярні орбітальні діаграми енергетичного рівня для прогнозування порядку зв'язку та стабільності\(\ce{He_2^{2+}}\) іона.
Дано: хімічні види
Запитано: молекулярна орбітальна діаграма енергетичного рівня, порядок зв'язку та стабільність
Стратегія:
- Об'єднайте дві валентні атомні орбіталі Він для отримання склеювання та антизв'язуючих молекулярних орбіталів. Намалюйте молекулярну орбітальну діаграму енергетичного рівня для системи.
- Визначте загальну кількість валентних електронів в іоні He 2 2 +. Заповніть молекулярні орбіталі на діаграмі енергетичного рівня, починаючи з орбіти, з найменшою енергією. Обов'язково дотримуйтесь принципу Паулі та правила Гунда, роблячи це.
- Обчисліть порядок облігацій і передбачити, чи є вид стабільним.
Рішення:
Атомні орбіталі Two He 1 s об'єднуються, щоб дати дві молекулярні орбіталі:\(σ_{1s}\) зв'язкову орбіталь з меншою енергією, ніж атомні орбіталі, і\( \sigma _{1s}^{\star } \) антизв'язуючу орбіталь при більш високій енергії. Зв'язок будь-якої двоатомної молекули з двома атомами He можна описати за допомогою наступної молекулярно-орбітальної діаграми:
B Іон He 2 2 + має лише два валентних електрона (по два від кожного атома Він мінус два для заряду +2). Ми також можемо розглядати He 2 2+ як утворений з двох іонів He +, кожен з яких має єдиний валентний електрон в атомній орбіталі 1 с. Тепер ми можемо заповнити молекулярну орбітальну діаграму:
Два електрони займають молекулярну орбіталь з найменшою енергією, яка є орбітальною зв'язкою (\(σ_{1s}\)), що дає (σ 1 с) 2 електронну конфігурацію. Щоб уникнути порушення принципу Паулі, спини електрона повинні бути парними.
C Отже, порядок зв'язку є (через Рівняння\ ref {9.8.1})
\[ \dfrac{2-0}{2} =1 \nonumber \]
Тому передбачається, що він 2 2 + містить єдиний зв'язок Він - Він. При цьому він повинен бути стійким видом.
Використовуйте молекулярну орбітальну діаграму енергетичного рівня для прогнозування валентно-електронної конфігурації та порядку зв'язку\(\ce{H_2^{2−}}\) іона. Це стійкий вид?
- Відповідь
-
\(\ce{H_2^{2−}}\)має валентну електронну конфігурацію\( \left (\sigma _{1s} \right )^{2}\left (\sigma _{1s}^{\star } \right )^{2} \) з порядком зв'язку 0. Тому прогнозується, що він буде нестабільним.
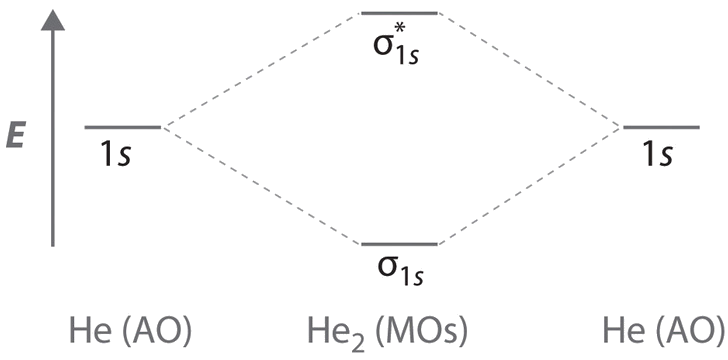
Гелієвий димер
Нарешті, ми досліджуємо молекулу He 2, утворену з двох атомів He з конфігураціями електронів 1 s 2. Малюнок\(\PageIndex{1c}\) - молекулярна орбітальна діаграма енергетичного рівня для He 2. При загальній кількості чотирьох валентних електронів як\( \sigma _{1s} \) зв'язкові, так і\( \sigma _{1s}^{\star } \) антитілінгові орбіталі повинні містити два електрони. Це дає\( \left (\sigma _{1s} \right )^{2}\left (\sigma _{1s}^{\star } \right )^{1} \) електронну конфігурацію з прогнозованим порядком зв'язку (через Equation\ ref {9.8.1})
\[\text{bond order}= \dfrac{2 − 2}{2} = 0 \label{heliumdimer} \]
що вказує на те, що\(He_2\) молекула не має чистого ковалентного зв'язку і не є стабільним видом.
Здатність відстежувати порядок зв'язку до міцності зв'язку обумовлена тим, що різниця в енергії між антисклеювальної\( \sigma _{1s}^{\star } \) молекулярною орбіталлю і вихідною\(1s\) атомною орбіталлю більше, ніж різниця енергій між склеювальної\( \sigma _{1s} \) молекулярною орбіталлю і\(1s\) атомні орбіталі. Це було отримано раніше, коли енергія стабілізації (\(\Delta E_{+}\))\( \sigma _{1s} \) молекулярної орбіти менше, ніж енергія дестабілізації (\(\Delta E_{-}\))\( \sigma _{1s}^{\star } \) молекулярної орбіти проти зв'язку:
\[ \begin{align} \Delta E_{\pm} &= E_{\pm} - E_H \\[4pt] &= \dfrac {e^2}{4\pi \epsilon _0 R} + \dfrac {J \pm K}{1 \pm S} \label {10.31} \end{align} \]
Отже, антизв'язуюча\( \sigma _{1s}^{\star }\) молекулярна орбіталь більш дестабілізована щодо атомних орбіталів, ніж склеювання\( \sigma _{1s} \) молекулярної орбіталі стабілізується щодо\(1s\) атомних орбіталів (\(E_H\).
Той факт, що різниця енергії MO проти зв'язку більша, ніж різниця енергії\( \sigma _{1s} \) молекулярної орбіти зв'язку, є справжньою причиною того, що димер гелію не передбачається існувати з ковалентним зв'язком. З чотирьох валентних електронів у гелієвому димері два заповнить склеювання\( \sigma _{1s}\) молекулярної орбіталі, а два інших заповнить\( \sigma _{1s}^{\star }\) молекулярну орбіталь проти склеювання. Два електрони в\( \sigma _{1s} \) молекулярній орбіталі зв'язку досягнуть певної стабілізації щодо\(1s\) атомних орбіталів, але два електрони в антизв'язкової\( \sigma _{1s}^{\star } \) молекулярній орбіталі досягнуть більшої дестабілізації щодо їх положення на атомних орбіталах. Чистий результат - менш стабільна молекула, ніж якби електрони залишилися на відповідних\(1s\) атомних орбіталах.
Електрони в антизв'язуючих орбіталах скасовують (і перевищують) стабілізацію, що виникає внаслідок електронів на орбіталах зв'язку. Отже, будь-яка система, яка має рівну кількість електронів зв'язку та антизв'язуючих, матиме порядок зв'язку 0, і прогнозується, що вона нестабільна і тому не буде існувати в природі (принаймні, як ковалентно зв'язуючий комплекс).
Виходячи з молекулярної орбітальної теорії, розглянутої вище,\(\ce{He_2}\) молекула не повинна існувати, оскільки між атомами гелію не утворюється ковалентний зв'язок (Equation\ ref {heliumdimer}). Однак молекулярний орбітальний опис вище нехтує силою ван дер Ваальса, яка існує між атомами, про що свідчить існування рідкого гелію (при 4 К). Тож «молекула», що складається з двох атомів гелію, пов'язаних силою ван дер Ваальса, може існувати цією привабливою силою - і це так.
Молекула димеру гелію, пов'язана силами Ван дер Ваальса, була вперше запропонована Джоном Кларком Слейтером в 1928 році і спостерігалася в 1993 році джентрі та колегами. Цікаво,\(\ce{He_2}\) що найбільша відома молекула двох атомів, перебуваючи в її основному стані з надзвичайно великою довжиною зв'язку з поділом близько 5200 пм. Енергія зв'язування тільки\(4.6 \times 10^{−5}\, kJ/mol\), тому\(\ce{He-He}\) зв'язок в 5000 разів слабкіше ковалентного зв'язку в молекулі водню (Таблиця Template:index).
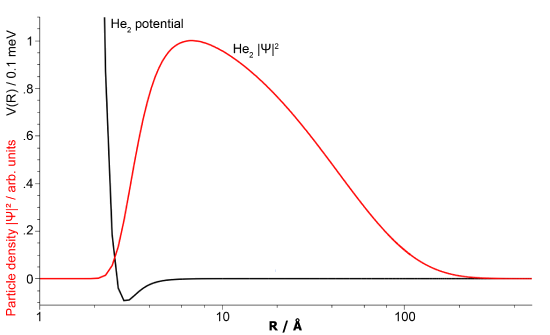
Висновок
Зниження енергії, спричинене зв'язковою орбіталлю (конструктивна інтерференція атомних орбіталів), скасовується збільшенням енергії, викликаної антизв'язковою орбіталлю (руйнівна інтерференція атомних орбіталів), тому енергетично не сприятливо для атомів гелію перебувати в такій близькості, тому якщо така ситуація виникне, вони швидко розлучаться, оскільки немає сили тримати їх там.