9.7: Молекулярні орбіталі можна впорядкувати відповідно до їх енергій
- Page ID
- 26903
Метод LCAO-MO, який ми використовували для H 2 +, може бути якісно застосований до гомоядерних двоатомних молекул, щоб забезпечити додаткове розуміння хімічного зв'язку. Більш кількісний підхід також корисний, особливо для більш складних ситуацій, таких як гетероядерні двоатомні молекули та багатоатомні молекули. Коли два атоми знаходяться досить близько, щоб їх валентні орбіталі значно перекривалися, заповнені внутрішні електронні оболонки значною мірою не збурені; отже, вони часто ігноруються при побудові молекулярних орбіталів. Це означає, що ми можемо зосередити свою увагу на молекулярних орбіталах, отриманих від валентних атомних орбіталів.
Молекулярні орбіталі, утворені з ns орбіталів
Діаграми молекулярних орбіталів, відформатовані для видів дигідрогену, аналогічні діаграмам будь-якої гомоядерної двоатомної молекули з двома однаковими атомами лужних металів (наприклад, Li 2 та Cs 2) показані в частині (a) на рисунку Template:index, де M являє собою атом металу. Для опису валентних електронних молекулярних орбіталей цих видів важливі лише два енергетичні рівні: a σ ns зв'язування молекулярної орбіталі та a σ * ns антизв'язуючої молекулярної орбіталі. Оскільки кожен лужний метал (М) має конфігурацію валентних електронів ns 1, молекула M 2 має два валентних електрони, які заповнюють орбітальну зв'язок σ ns. В результаті прогнозується порядок зв'язку 1 для всіх гоядерних двоатомних видів, утворених з лужних металів (Li 2, Na 2, K 2, Rb 2 та Cs 2). Загальні риси цих діаграм М 2 ідентичні діаграмі для молекули Н 2. Експериментально всі виявляються стабільними в газовій фазі, а деякі навіть стабільні в розчині.
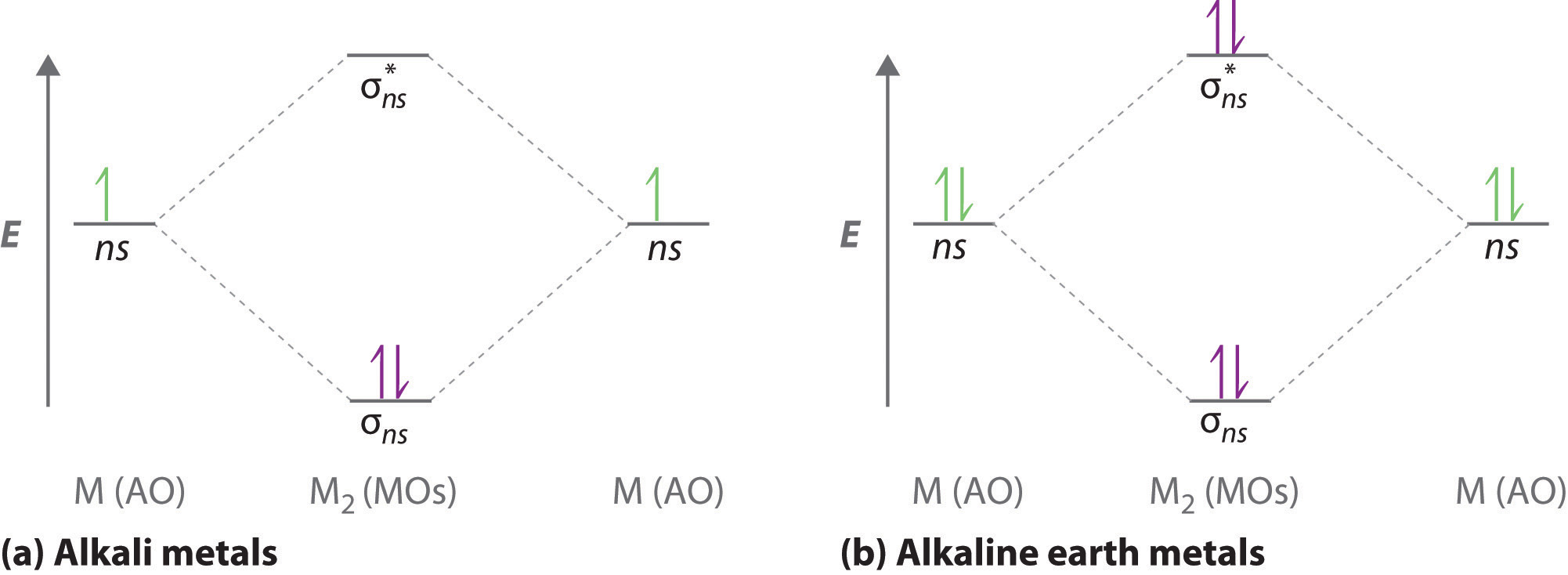
Аналогічно молекулярні орбітальні діаграми для гоядерних двоатомних сполук лужноземельних металів (наприклад, Be 2), в яких кожен атом металу має ns 2 валентну електронну конфігурацію, нагадують діаграму молекули He 2. Як показано на малюнку\(\PageIndex{1b}\), це дійсно так. Всі гомоядерні лужноземельні двоатомні молекули мають чотири валентних електронів, які заповнюють як орбіталь зв'язку σ ns, так і орбітальну антитілінг σ ns* і дають порядок зв'язку 0. Таким чином, Be 2, Mg 2, Ca 2, Sr 2 та Ba 2, як очікується, будуть нестабільними, відповідно до експериментальних даних. Однак у твердому стані всі лужні метали та лужноземельні метали існують як розширені решітки, що утримуються металевим зв'язком. При низьких температурах,\(Be_2\) витримується.
Використовуйте якісну молекулярну орбітальну діаграму енергетичного рівня для прогнозування валентної електронної конфігурації, порядку зв'язку та ймовірного існування іона Na 2 −.
Дано: хімічні види
Запитано: молекулярна орбітальна діаграма енергетичного рівня, валентна електронна конфігурація, порядок зв'язку та стабільність
Стратегія
- Об'єднайте дві атомні орбіталі валентності натрію для отримання склеювання та антизв'язуючих молекулярних орбіталів. Намалюйте молекулярну орбітальну діаграму енергетичного рівня для цієї системи.
- Визначте загальну кількість валентних електронів в іоні Na 2 −. Заповніть молекулярні орбіталі на діаграмі енергетичного рівня, починаючи з орбіти, з найменшою енергією. Обов'язково дотримуйтесь принципу Паулі та правила Гунда, роблячи це.
- Обчисліть порядок облігацій і передбачте, чи є вид стабільним.
Рішення
А Оскільки натрій має [Ne] 3 s 1 електронну конфігурацію, молекулярно-орбітальна діаграма енергетичного рівня якісно ідентична діаграмі взаємодії двох атомних орбіталей 1 с.
B Іон Na 2 − має загалом три валентні електрони (по одному від кожного атома Na і по одному для негативного заряду), в результаті чого утворюється заповнена молекулярна орбіталь σ 3 с, наполовину заповнена σ 3 с* і\( \left ( \sigma _{3s} \right )^{2}\left ( \sigma _{3s}^{\star } \right )^{1} \) електронну конфігурацію.
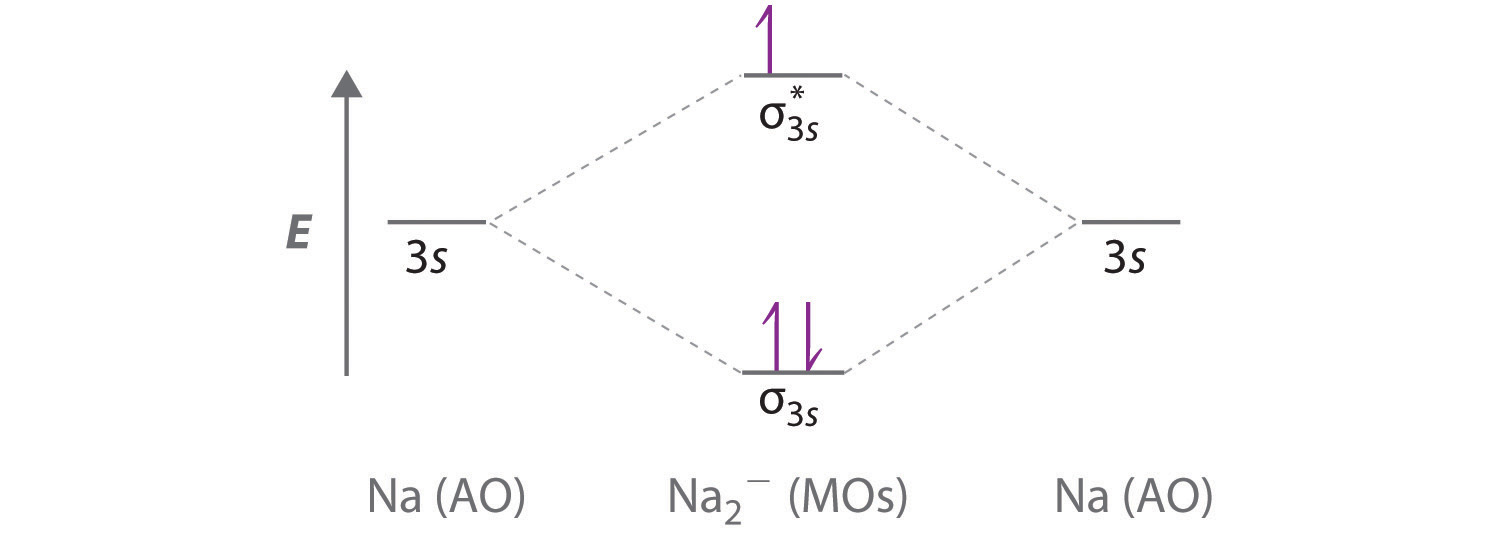
C Порядок зв'язку дорівнює (2-1) ÷ 2=1/2 При порядку дробового зв'язку ми прогнозуємо, що іон Na 2 − існує, але є високореактивним.
Використовуйте якісну молекулярну орбітальну діаграму енергетичного рівня для прогнозування валентної електронної конфігурації, порядку зв'язку та ймовірного існування іона Ca 2 +.
- Відповідь
-
Ca 2 + має\( \left ( \sigma _{4s} \right )^{2}\left ( \sigma _{4s}^{\star } \right )^{1} \) електронну конфігурацію і порядок зв'язку 1/2 і повинен існувати.
Молекулярні орбіталі, утворені з n p орбіталей
Атомні орбіталі, крім ns орбіталів, також можуть взаємодіяти, утворюючи молекулярні орбіталі. Оскільки окремі орбіталі p, d та f не сферично симетричні, нам потрібно визначити систему координат, щоб ми знали, які частки взаємодіють у тривимірному просторі. Нагадаємо, що для кожної підоболонки np, наприклад, існують np x, np y і np z орбіталі. Всі мають однакову енергію і тому вироджені, але мають різну просторову орієнтацію.
\[ \sigma _{np_{z}}=np_{z}\left ( A \right )-np_{z}\left ( B \right ) \label{9.7.1} \]
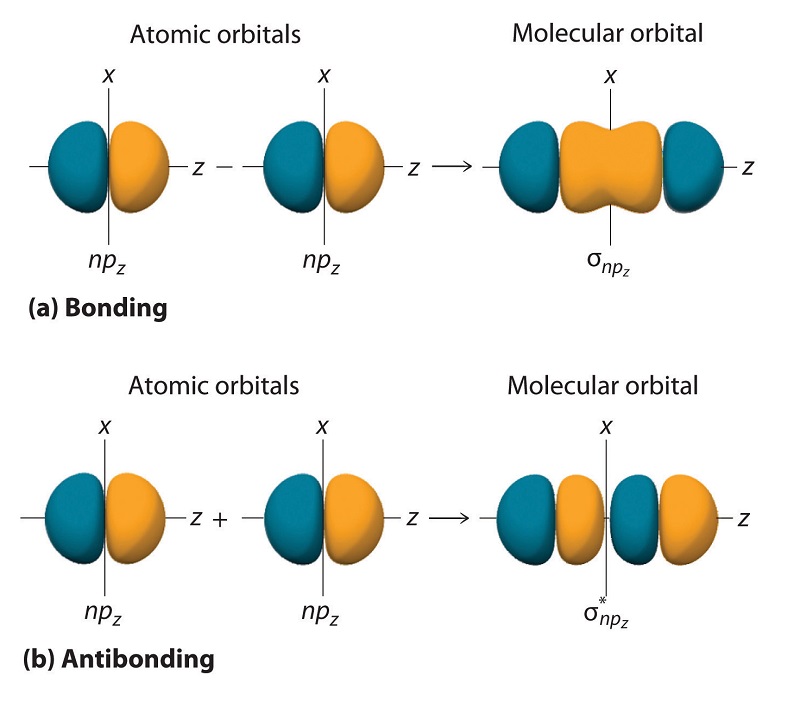
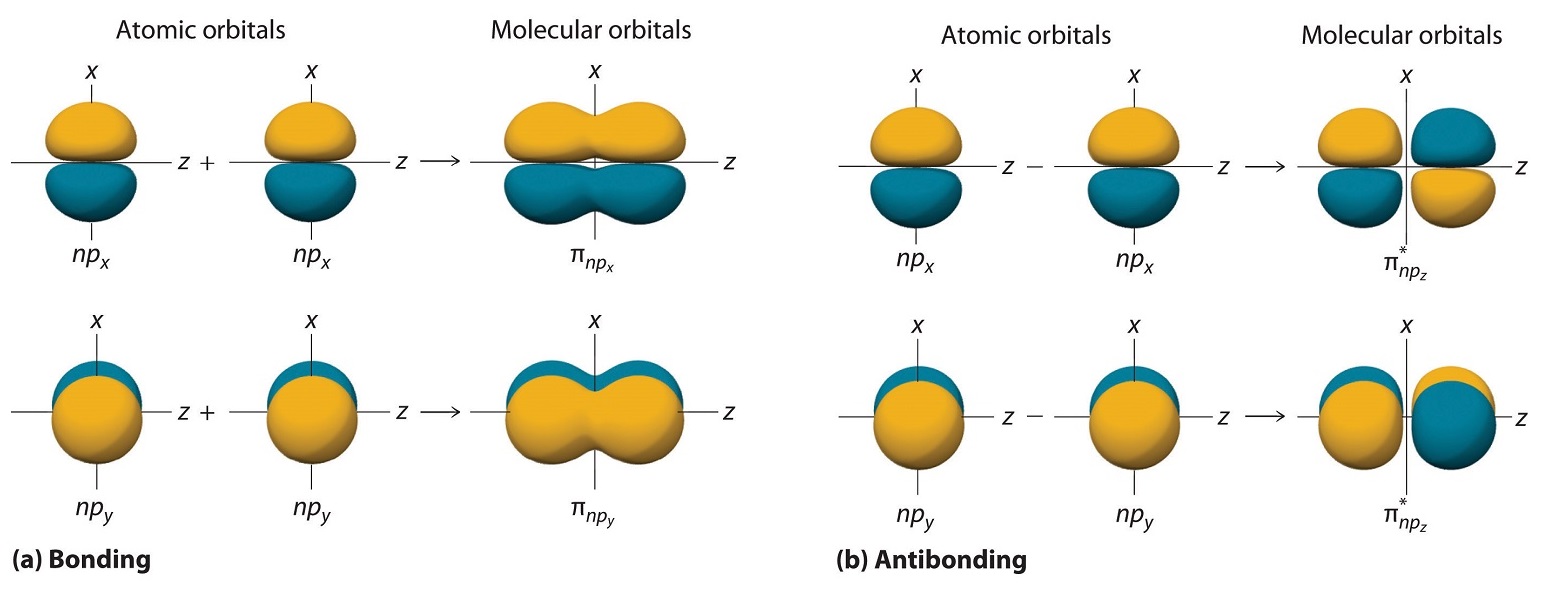
Так само, як і у випадку з ns орбіталями, ми можемо формувати молекулярні орбіталі з np орбіталів, беручи їх математичну суму та різницю. Коли дві позитивні частки з відповідною просторовою орієнтацією перекриваються, як показано для двох атомних орбіталів np z в частині (a) на рисунку Template:index, математична різниця їх хвильових функцій призводить до конструктивна інтерференція, яка, в свою чергу, збільшує щільність імовірності електронів між двома атомами. Отже, різниця відповідає молекулярній орбіталі, яка називається\( \sigma _{np_{z}} \) склеювальною молекулярною орбіталлю, оскільки, як і з орбіталями σ, розглянутими раніше, вона симетрична щодо міжядерної осі (в даному випадку - вісь z):
\[ \sigma _{np_{z}}=np_{z}\left ( A \right )-np_{z}\left ( B \right ) \label{9.7.2} \]
Інша можлива комбінація двох орбіталів np z - математична сума:
\[ \sigma _{np_{z}}=np_{z}\left ( A \right )+np_{z}\left ( B \right ) \label{9.7.3} \]
У цій комбінації, показаній у частині (b) на рисунку Template:index, позитивна частка однієї атомної орбіти np z перекриває негативну частку іншої, що призводить до руйнівного втручання двох хвиль і створює вузол між двома атомами. Звідси це антизв'язуюча молекулярна орбіталь. Оскільки вона теж симетрична щодо міжядерної осі, ця молекулярна орбіталь називається\( \sigma _{np_{z}}=np_{z}\left ( A \right )-np_{z}\left ( B \right ) \) антизв'язуючою молекулярною орбіталлю. Всякий раз, коли орбіталі об'єднуються, комбінація зв'язку завжди нижча за енергією (більш стабільна), ніж атомні орбіталі, з яких вона була отримана, а комбінація антизв'язків вища за енергією (менш стабільна).
Решта p орбіталів на кожному з двох атомів, np x і np y, не вказують безпосередньо один на одного. Замість цього вони перпендикулярні міжядерної осі. Якщо довільно позначити осі, як показано на рисунку Template:index, ми побачимо, що у нас є дві пари орбіталів np: дві орбіталі np x, що лежать у площині сторінки, і дві орбіталі np y перпендикулярно до літака. Хоча ці дві пари еквівалентні за енергією, орбіталь np x на одному атомі може взаємодіяти лише з орбіталлю np x на іншому, а орбітальна np y на одному атомі може взаємодіяти з тільки np y на іншому. Ці взаємодії є пліч-о-пліч, а не взаємодія «голова до голови», характерні для σ орбіталей. Кожна пара перекриваються атомних орбіталів знову утворює дві молекулярні орбіталі: одна відповідає арифметичній сумі двох атомних орбіталей і одна різниці. Сума цих бічних взаємодій збільшує ймовірність електронів у області вище і нижче лінії, що з'єднує ядра, тому це склеювальна молекулярна орбіталь, яка називається pi (π) орбітальною (склеючою молекулярною орбіталлю, утвореною з боку в бік взаємодії двох або більш паралельні ні атомні орбіталі). Різниця призводить до перекриття орбітальних часточок з протилежними ознаками, що виробляє вузлову площину, перпендикулярну міжядерної осі; отже, це антизв'язуюча молекулярна орбітальна, звана pi зіркою (π*) орбітальною Антитілінговою молекулярною орбіталлю, утвореною з різниці сторони в бік взаємодії двох і більше паралельних атомних орбіталей нп, що створюють вузлову площину, перпендикулярну міжядерної осі. .
\[ \pi _{np_{x}}=np_{x}\left ( A \right )+np_{x}\left ( B \right ) \label{9.7.4} \]
\[ \pi ^{\star }_{np_{x}}=np_{x}\left ( A \right )-np_{x}\left ( B \right ) \label{9.7.5} \]
Дві орбіталі np y також можуть поєднуватися, використовуючи бічні взаємодії для отримання склеювальної\( \pi _{np_{y}} \) молекулярної орбіталі та антизв'язуючої\( \pi _{np_{y}}^{\star } \) молекулярної орбіталі. Оскільки атомні орбіталі np x і np y взаємодіють однаково (збоку в бік) і мають однакову енергію,\( \pi _{np_{x}} \) і\( \pi _{np_{y}} \) молекулярні орбіталі є виродженою парою, як\( \pi _{np_{x}}^{\star } \) і\( \pi _{np_{y}}^{\star } \) молекулярні орбіталі.
Енергії для одноядерних двоатомних молекул
Зараз ми опишемо приклади систем, що включають гомоядерні двоатомні молекули періоду 2, такі як N 2, O 2 та F 2. Коли ми малюємо молекулярну орбітальну діаграму для молекули, слід пам'ятати чотири ключові моменти:
- Кількість вироблених молекулярних орбіталей таке ж, як і кількість атомних орбіталей, використовуваних для їх створення.
- Зі збільшенням перекриття між двома атомними орбіталями різниця в енергії між результуючим зв'язком і антизв'язуючими молекулярними орбіталями збільшується.
- Коли дві атомні орбіталі об'єднуються, утворюючи пару молекулярних орбіталів, склеювання молекулярної орбіталі стабілізується приблизно стільки, скільки антизв'язуюча молекулярна орбіталь дестабілізується.
- Взаємодія між атомними орбіталями найбільша, коли вони мають однакову енергію.
Figure Template:index - це діаграма енергетичного рівня, яка може бути застосована до двох однакових взаємодіючих атомів, які мають три атомні орбіталі np кожен. Існує шість вироджених p атомних орбіталів (по три від кожного атома), які об'єднуються, утворюючи шість молекулярних орбіталів, три зв'язку та три антизв'язування. Молекулярні орбіталі зв'язку нижчі за енергією, ніж атомні орбіталі через підвищену стабільність, пов'язану з утворенням зв'язку. І навпаки, антизв'язуючі молекулярні орбіталі вищі за енергією, як показано. Різниця енергій між молекулярними орбіталями σ і σ значно більше різниці між двома π і π* множинами. Причина цього полягає в тому, що атомне орбітальне перекриття і, отже, сила взаємодії більша для зв'язку σ, ніж π зв'язок, а це означає, що молекулярна орбіталь σ стабільніша (нижча за енергією), ніж π молекулярні орбіталі.
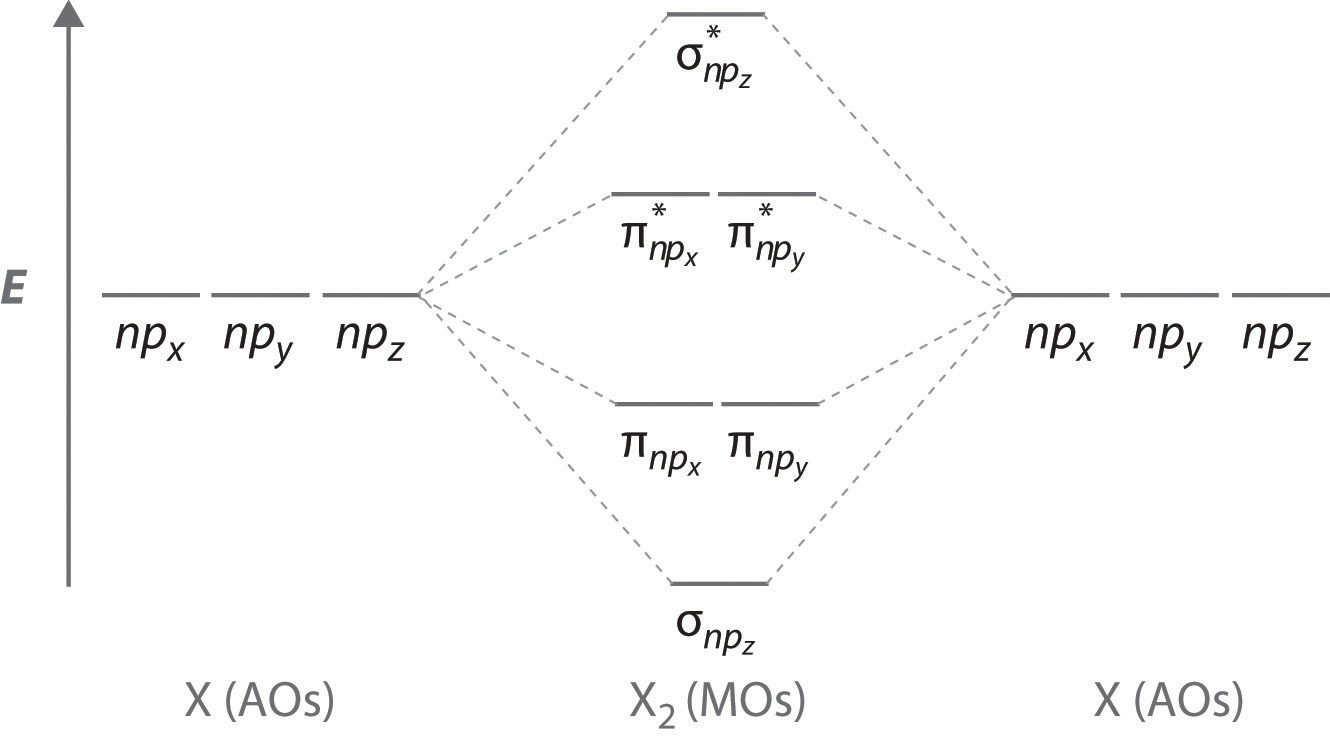
Кількість молекулярних орбіталей завжди дорівнює загальній кількості атомних орбіталей, з яких ми починали.
Ми ілюструємо, як використовувати ці точки, будуючи молекулярну орбітальну діаграму енергетичного рівня для F 2. Використовуємо діаграму на малюнку\(\PageIndex{5a}\); n = 1 орбіталі (σ 1 s і σ 1 с *) розташовані значно нижче орбіталів рівня n = 2 і не показані. Як показано на діаграмі, молекулярні орбіталі σ 2 s і σ 2 s * набагато нижчі за енергією, ніж молекулярні орбіталі, отримані з атомних орбіталів 2 р через велику різницю в енергія між 2 с і 2 р атомними орбіталями фтору. Молекулярна орбіталь з найменшою енергією, отримана з трьох орбіталів 2 p на кожній F, є\( \sigma _{2p_{z}} \) і наступною найбільш стабільною є дві вироджені орбіталі,\( \pi _{2p_{x}} \) і\( \pi _{2p_{y}} \). Для кожної орбітальної зв'язки на діаграмі існує антизв'язуюча орбіта, а антизв'язуюча орбітальна дестабілізується приблизно на стільки, скільки стабілізується відповідна орбітальна зв'язок. В результаті\( \sigma ^{\star }_{2p_{z}} \) орбіталь вище за енергією, ніж будь-який з вироджених\( \pi _{2p_{x}}^{\star } \) і\( \pi _{2p_{y}}^{\star } \) орбіталів. Тепер ми можемо заповнити орбіталі, починаючи з тієї, яка найнижча за енергією.
Кожен фтор має 7 валентних електронів, тому в молекулі F 2 всього 14 валентних електронів. Починаючи з найнижчого енергетичного рівня, електрони розміщуються на орбіталі за принципом Паулі і правилами Гунда. Два електрони кожен заповнюють σ 2 s і σ 2 s * орбіталі, 2 заповнюють\( \sigma _{2p_{z}} \) орбіталь, 4 заповнюють дві вироджені π орбіталі і 4 заповнюють дві вироджені π * орбіталі, загалом 14 електронів.
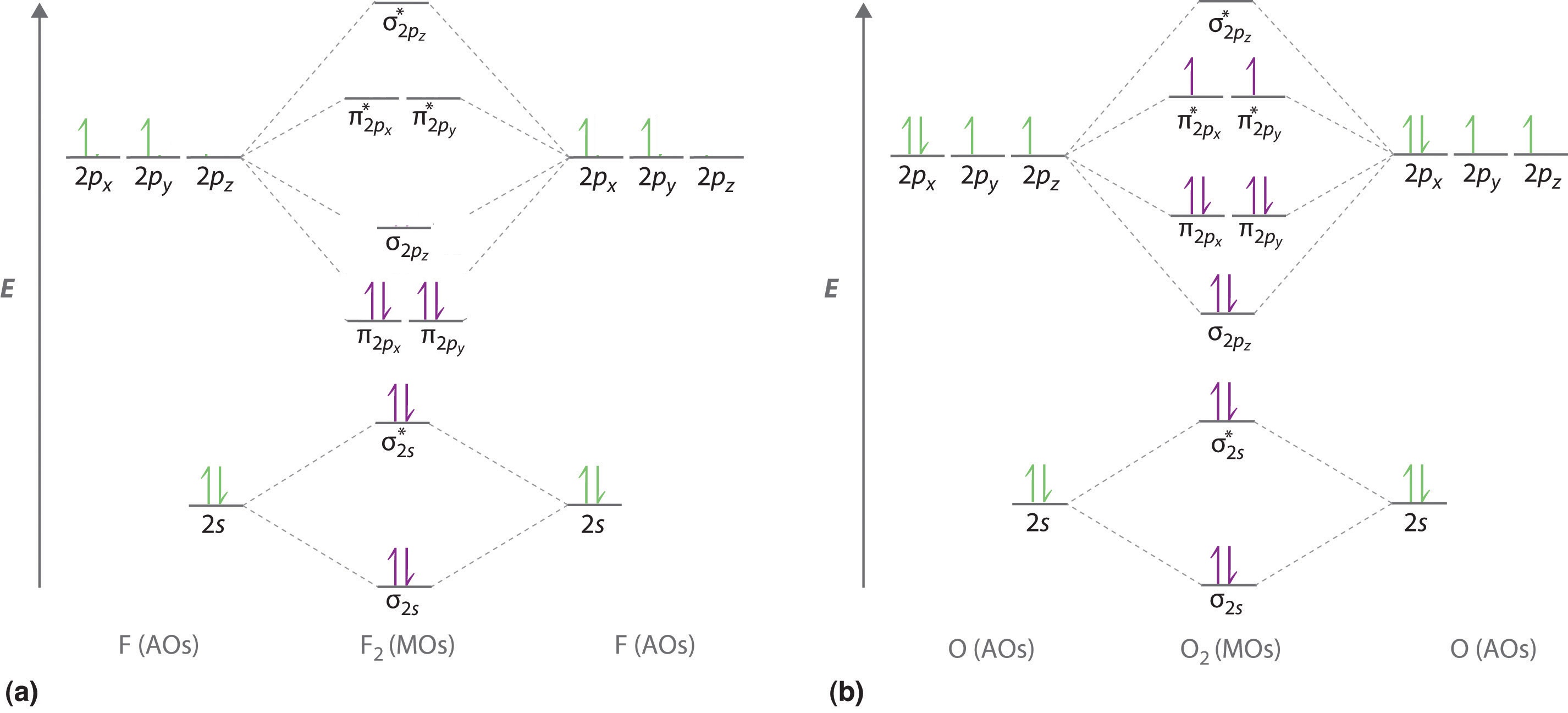
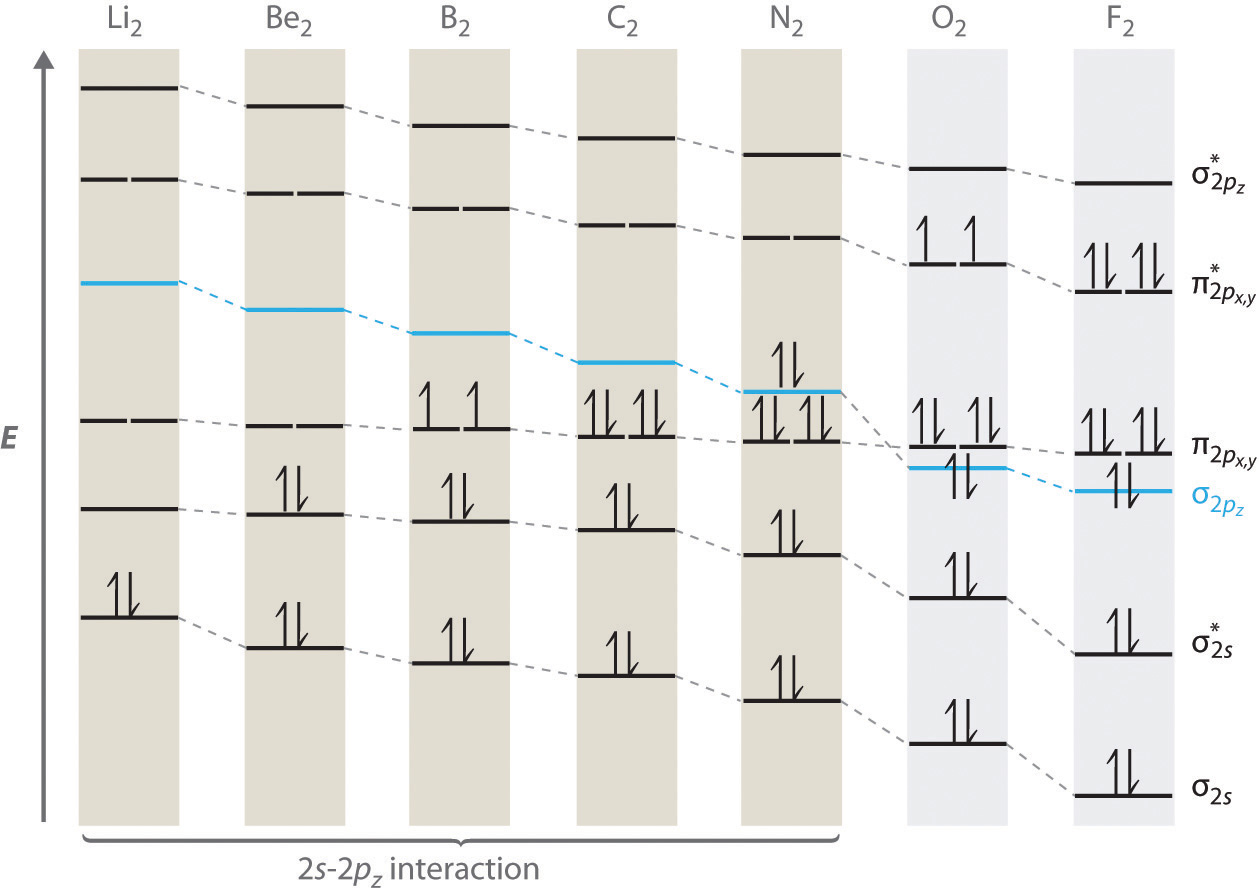
Для двоатомних молекул періоду 2 зліва від N 2 в таблиці Менделєєва потрібна дещо інша молекулярно-орбітальна діаграма рівня енергії, оскільки\( \sigma _{2p_{z}} \) молекулярна орбіталь трохи вища за енергією, ніж вироджена\( \pi ^{\star }_{np_{x}} \) та\( \pi ^{\star }_{np_{y}} \) орбітальна. Різниця в енергії між атомними орбіталями 2 с і 2 р збільшується від Li 2 до F 2 через збільшення ядерного заряду і поганого екранування електронів 2 s електронами в підоболонці 2 р. Взаємодія зв'язку між орбіталлю 2 s на одному атомі та орбітальною 2 p z на іншому є найбільш важливою, коли дві орбіталі мають подібні енергії. Ця взаємодія зменшує енергію орбіталі σ 2 с і збільшує енергію\( \sigma _{2p_{z}} \) орбіти. Таким чином, для Li 2,\( \sigma _{3p_{z}} \) Be 2, B 2, C 2 і N 2\( \sigma _{2p_{z}} \) орбіталь вище за енергією, ніж орбіталі, як показано на малюнку Template:index. Експериментально енергетичний розрив між атомними орбіталями ns і np збільшується зі збільшенням ядерного заряду (Рисунок Template:index). Так, наприклад,\( \sigma _{2p_{z}} \) молекулярна орбіталь знаходиться з меншою енергією, ніж\( \pi _{2p_{x,y}} \) пара.
Використовуйте якісну молекулярну орбітальну діаграму енергетичного рівня для прогнозування електронної конфігурації, порядку зв'язку та кількості непарних електронів у S 2, яскраво-синьому газі при високих температурах.
Дано: хімічні види
Запитано: молекулярна орбітальна діаграма енергетичного рівня, порядок зв'язку та кількість непарних електронів
Стратегія:
- Запишіть валентну електронну конфігурацію сірки і визначте тип молекулярних орбіталей, утворених в S 2. Прогнозуйте відносні енергії молекулярних орбіталів на основі того, наскільки близькі за енергією валентні атомні орбіталі один до одного.
- Намалюйте молекулярно-орбітальну діаграму енергетичного рівня для цієї системи та визначте загальну кількість валентних електронів у S 2.
- Заповнюйте молекулярні орбіталі в порядку збільшення енергії, обов'язково підкоряючись принципу Паулі і правилу Гунда.
- Розрахуйте порядок зв'язку і опишіть склеювання.
Рішення:
A Сірка має [Ne] 3 s 2 3 p 4 валентну електронну конфігурацію. Щоб створити молекулярну орбітальну діаграму енергетичного рівня, подібну до діаграми Template:index та Template:index, нам потрібно знати, наскільки близькі за енергією атомні орбіталі 3 s та 3 p, оскільки їх поділ енергії визначатиме, чи\( \pi _{3p_{x,y}} \) \( \sigma _{3p_{z}} \)> молекулярна орбіталь вища за енергією. Оскільки енергетичний проміжок ns - np збільшується у міру збільшення ядерного заряду,\( \sigma _{3p_{z}} \) молекулярна орбіталь буде меншою за енергією, ніж\( \pi _{3p_{x,y}} \) пара.
B Молекулярна орбітальна діаграма енергетичного рівня виглядає наступним чином:
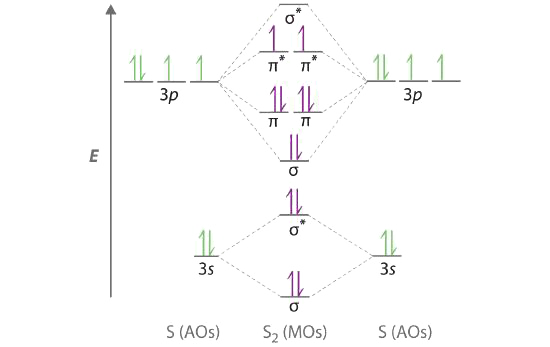
Кожен атом сірки вносить 6 валентних електронів, загалом 12 валентних електронів.
C Десять валентних електронів використовуються для заповнення орбіталів наскрізь\( \pi _{3p_{x}} \) і\( \pi _{3p_{y}} \), залишаючи 2 електрони, щоб зайняти вироджений\( \pi ^{\star }_{3p_{x}} \) і\( \pi ^{\star }_{3p_{y}} \) пару. З правила Ганда, інші 2 електрони повинні займати ці орбіталі окремо з вирівняними їх спинами. З числами електронів, записаних у вигляді надскриптів, електронна конфігурація S 2 -\( \left ( \sigma _{3s} \right )^{2}\left ( \sigma ^{\star }_{3s} \right )^{2}\left ( \sigma _{3p_{z}} \right )^{2}\left ( \pi _{3p_{x,y}} \right )^{4}\left ( \pi _{3p ^{\star }_{x,y}} \right )^{2} \) з 2 непарними електронами. Порядок зв'язку дорівнює (8 − 4) ÷ 2 = 2, тому ми прогнозуємо подвійний зв'язок S = S.
Використовуйте якісну молекулярно-орбітальну діаграму енергетичного рівня для прогнозування електронної конфігурації, порядку зв'язку та кількості непарних електронів у пероксидному іоні (O 2 2 −).
- Відповідь
-
\( \left ( \sigma _{2s} \right )^{2}\left ( \sigma ^{\star }_{2s} \right )^{2}\left ( \sigma _{2p_{z}} \right )^{2}\left ( \pi _{2p_{x,y}} \right )^{4}\left ( \pi _{2p ^{\star }_{x,y}} \right )^{4} \)порядок зв'язку 1; немає непарних електронів
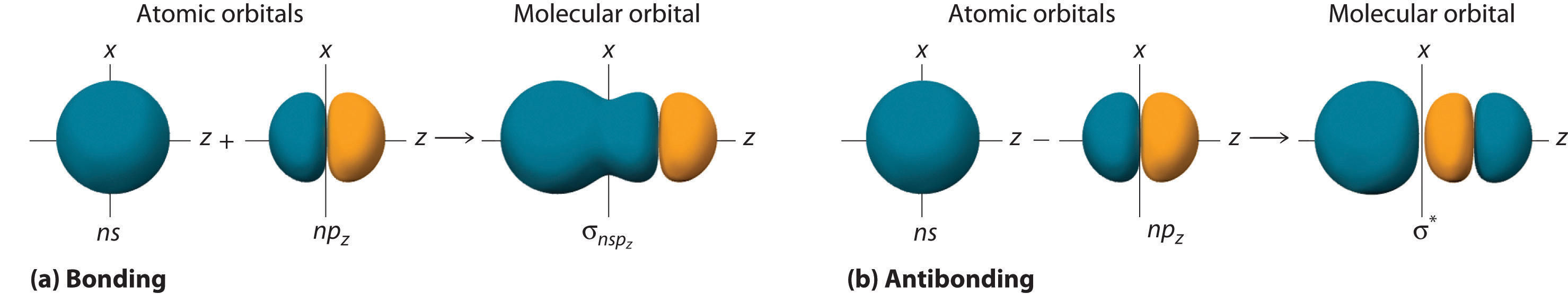
Молекулярні орбіталі, утворені з ns з n p орбіталями
Хоча багато комбінацій атомних орбіталів утворюють молекулярні орбіталі, ми обговоримо лише одну іншу взаємодію: атомну орбіталь ns на одному атомі з атомною орбіталлю np z на іншому. Як показано на малюнку Template:index, сума двох атомних хвильових функцій (ns + np z) утворює молекулярну орбіталь зв'язку σ. Їх різниця (ns − np z) утворює α* антизв'язуючу молекулярну орбіталь, яка має вузлову площину нульової щільності ймовірності перпендикулярно міжядерної осі.