10.4: Ентропія електрохімічних клітин
- Page ID
- 21093
Функція Гіббса пов'язана з ентропією через її температурну залежність
\[ \left( \dfrac{\partial \Delta G}{\partial T} \right)_p = - \Delta S\]
Аналогічну залежність можна вивести і для температурної дисперсії\(E^o\).
\[ nF \left( \dfrac{\partial E^o}{\partial T} \right)_p = \Delta S \label{eq2}\]
Розглянемо наступні дані для клітини Даніеля (Buckbeei, Surdzial, & Metz, 1969), що визначається наступною реакцією
\[Zn(s) + Cu^{2+}(aq) \rightleftharpoons Zn^{2+}(aq) + Cu(s)\]
| Т (°C) | 0 | 10 | 20 | 25 | 30 | 40 |
|---|---|---|---|---|---|---|
| Ео (V) | 1.1028 | 1.0971 | 1.0929 | 1.0913 | 1.0901 | 1.0887 |
Від прилягання даних до квадратичної функції, температурна залежність
\[\left( \dfrac{\partial E^o}{\partial T} \right)_p \]
легко встановлюється.
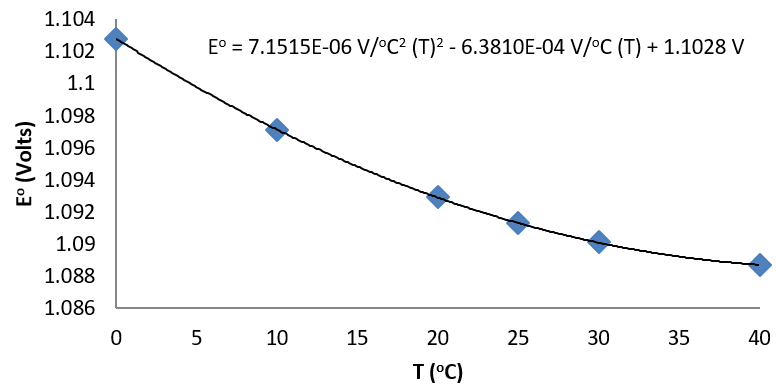
Квадратичне прилягання до даних призводить до
\[\left( \dfrac{\partial E^o}{\partial T} \right)_p = 3.8576 \times 10^{-6} \dfrac{V}{°C^2}(T) - 6.3810 \times 10^{-4} \dfrac{V}{°C}\]
Так, при 25° С
\[\left( \dfrac{\partial E^o}{\partial T} \right)_p = -54166 \times 10^{-4} V/K\]
зазначивши, що\(K\) можна замінити,\(°C\) так як в різниці вони мають однакову величину. Отже, зміна ентропії обчислюється (Equation\ ref {eq2})
\[ \Delta S = nF \left( \dfrac{\partial E^o}{\partial T} \right)_p = (2\,mol)(95484\,C/mol) (-5.4166 \times 10^{-4} V/K)\]
Тому що
\[ 1\,C \times 1\,V = 1\,J\]
Стандартна зміна ентропії для клітинної реакції Даніеля при 25° C становить
\[ \Delta S = -104.5\, J/(mol\,K).\]
Саме негативна зміна ентропії призводить до збільшення стандартного потенціалу клітин при більш низьких температурах. Для такої реакції, як
\[Pb(s) + 2 H^+(aq) \rightarrow Pb^{2+}(aq) + H_2(g)\]
що має велике збільшення ентропії (за рахунок вироблення газофазного продукту), стандартний потенціал осередку зменшується зі зниженням температури. Оскільки це реакція, яка використовується в більшості автомобільних акумуляторів, це пояснює, чому може бути важко запустити автомобіль дуже холодним зимовим ранком. Тема температурної залежності декількох стандартних потенціалів комірок повідомляється і обговорюється Bratsch (Bratsch, 1989).
