24.7: Функція електронного розділу ідеального газу
- Page ID
- 22144
Наша квантово-механічна модель для двоатомної молекули приймає нуль енергії, щоб бути нескінченно відокремленими атомами в спокої, тобто без кінетичної енергії. Електричні взаємодії між ядрами та електронами такі, що при наближенні атомів один до одного утворюється зв'язок і енергія двоатомної системи зменшується. На деякій міжядерної відстані енергія досягає мінімуму; на більш коротких міжядерних відстанях починають домінувати відштовхуючі взаємодії між ядрами, а енергія збільшується. Ми можемо використовувати квантову механіку, щоб знайти хвильову функцію та енергію молекули, коли ядра розділені на будь-яку фіксовану відстань. Повторюючи розрахунок на серії міжядерних відстаней, ми можемо знайти відстань, на якій молекулярна енергія мінімальна. Ми приймаємо цю мінімальну енергію як електронну енергію молекули, а відповідну міжядерну відстань - як довжину зв'язку. Це енергія найнижчого електронного стану молекули. Найнижчий електронний стан називається заземленим станом.
Збуджені електронні стани існують, і їх енергії можна оцінити за допомогою спектроскопічних вимірювань або за допомогою квантово-механічного розрахунку. Для більшості молекул ці збуджені електронні стани мають набагато вищу енергію, ніж основний стан. Коли ми порівнюємо терміни в функції електронного розділу, ми бачимо, що
\[{\mathrm{exp} \left({-{\epsilon }_{e,1}}/{kT}\right)\ }\gg {\mathrm{exp} \left({-{\epsilon }_{e,2}}/{kT}\right)\ }\]
Термін для будь-якого більш високого рівня енергії незначний порівняно з терміном для основного стану. Функція електронного розділу стає просто
\[z_e=g_1{\mathrm{exp} \left({-{\epsilon }_{e,1}}/{kT}\right)\ }\]
Виродження наземного стану є одним для більшості молекул.\(g_1\) Для незвичайних молекул виродження в основному стані може бути більшим; для молекул з одним непарним електроном - два.
Енергія електронного наземного стану, яку ми отримуємо прямим квантово-механічним розрахунком, включає енергетичні ефекти рухів електронів та енергетичні ефекти від електричних взаємодій між електронами та стаціонарними ядрами. Оскільки ми розраховуємо його для стаціонарних ядер, електронна енергія не включає енергію ядерних рухів. Електронна енергія наземного стану - це енергія, що виділяється при сходженні атомів з нескінченного поділу в стан, в якому вони знаходяться в стані спокою при рівноважному міжядерному поділі. Це всього лише мінус один раз робота, необхідна для відділення атомів на нескінченну відстань, починаючи від міжядерного поділу з найменшою енергією. На графіку електронної (або потенційної) енергії проти міжядерної відстані енергія наземного стану - це лише глибина енергетичної свердловини, виміряної зверху вниз\(\left({\epsilon }_{e,1}<0\right)\). Робота, необхідна для поділу одного моля цих молекул на складові їх атоми, називається енергією рівноваги дисоціації, і умовно дається символом\(D_e\). Ці визначення означають, що\(D_e>0\) і\(D_e=-\overline{N}{\epsilon }_{e,1}\).
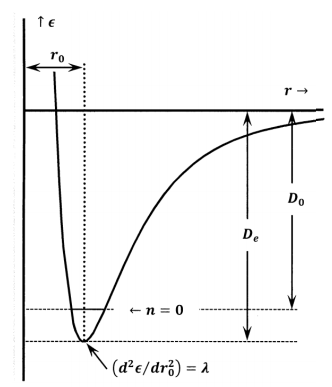
На практиці енергія електронного наземного стану часто оцінюється за спектроскопічними вимірами. Ретельно вивчивши його спектри, можна з'ясувати, скільки енергії потрібно додати, як фотон, щоб змусити молекулу дисоціювати на атоми. Виражена на моль, ця енергія називається спектроскопічною енергією дисоціації, і їй умовно дається символ\(D_0\). Ці спектроскопічні вимірювання передбачають поглинання фотонів реальними молекулами. Перш ніж вони поглинуть фотон, ці молекули вже мають енергію у вигляді коливальних і обертальних рухів. Таким чином, реальні молекули, які беруть участь у будь-якому спектроскопічному вимірюванні, мають енергії, більші за енергії гіпотетичних молекул нерухомого атома на дні потенційної енергетичної ями. Це означає, що для відділення реальної молекули потрібно менше енергії, ніж потрібно для відділення гіпотетичної молекули на дні свердловини. Для будь-якої молекули,\(D_e\mathrm{>}D_0\).
Щоб мати мінімально можливу енергію, реальна молекула повинна знаходитися в найнижчому обертальному та найнижчому коливальному енергетичному рівнях. Як виявляється, молекула може мати нульову енергію обертання, але її вібраційна енергія ніколи не може бути нульовою. У розділі 24.8 ми розглядаємо наближення гармонічного осцилятора. У найнижчому коливальному рівні\(\left(n=0\right)\) енергії мінімальна вібраційна енергія двоатомної молекули є\({h\nu }/{\mathrm{2}}\). \(D_0\)і\(\nu\) можуть бути оцінені за допомогою спектроскопічних експериментів. оцінюємо
\[{\epsilon }_{e,1}=-\frac{D_e}{\overline{N}}=-\left(\frac{D_0}{\overline{N}}+\frac{h\nu }{2}\right)\]
і молекулярна функція електронного розділу стає
\[z_e=g_1{\mathrm{exp} \left(\frac{D_0}{\overline{N}kT}+\frac{h\nu }{2kT}\right)\ }\]
або
\[z_e=g_1{\mathrm{exp} \left(\frac{D_0}{RT}+\frac{h\nu }{2kT}\right)\ }\]
