16.10: Колігативні властивості - Висота точки кипіння
- Page ID
- 21788
Система, яку ми уявляємо, коли говоримо про висоту точки кипіння, описана схематично на малюнку 7. Розглядаємо розчин з двох складових,\(A\) і\(B\). Молеві фракції\(A\)\(y_A\) і\(B\)\(y_B\), і, вказують склад розчину. Ми припускаємо, що один з компонентів присутній при низькій концентрації. Ми називаємо цей компонент розчиненою речовиною, і позначаємо його як з'єднання\(A\). За цими припущеннями ми маємо\(y_A\approx 0\) і\(y_B=1-y_A\approx 1\). Ми припускаємо далі,\(A\) що енергонезалежний, під яким ми маємо на увазі, що тиск пари чистого\(A\)\(P^{\textrm{⦁}}_A\), дуже мало. Потім другий компонент\(B\), складається з більшої частини матеріалу системи. Називаємо компонент\(B\) розчинником. Ми припускаємо, що\(A\) —\(B\) рішення знаходиться в рівновазі з газовою фазою. В принципі, молекули обох компонентів присутні в цьому газі. Оскільки ми припускаємо, що по суті жодної складової\(A\) немає в газовій фазі, ми маємо\(x_A=0\) і\(x_B=1\). Ми також припускаємо, що газова фаза\(B\) поводиться як ідеальний газ і розчинена речовина\(A\) підпорядковується закону Генрі.
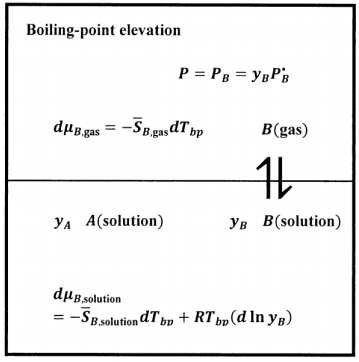
Коли ми вимірюємо температуру кипіння рідкої системи, знаходимо температуру, при якій тиск пари системи стає рівним заданому значенню. Для нормальної температури кипіння цей тиск дорівнює 1 атмосфері, або 1,01325 бар. У точці кипіння розчинник рідкої фази знаходиться в рівновазі з газофазним розчинником, так що хімічний потенціал рідкофазного розчинника дорівнює хімічному потенціалу газофазного розчинника. Тобто у нас є
\[\mu_{B,\mathrm{soluti}\mathrm{on}}=\mu_{B,\mathrm{gas}}.\nonumber \]
Ми хочемо описати зміну положення рівноваги, що відбувається при поступовому зміні концентрації розчиненої речовини\(dy_A\), при цьому тиск системи залишається постійним. Якщо система повинна залишатися в рівновазі,\(\mu_{B,\mathrm{solution}}=\mu_{B,\mathrm{gas}}\) повинна залишатися істинною. Звідси випливає, що хімічні потенціали двох фаз повинні змінюватися в тандемі. Продовження рівноваги має на увазі, що\(d\mu_{B,\mathrm{solution}}=d\mu_{B,\mathrm{gas}}\) при зміні концентрації розчиненої речовини на\(dy_A\).
Ми можемо проаналізувати явище висоти точки кипіння для будь-якого фіксованого тиску, при якому чиста рідина\(B\) може знаходитися в рівновазі з чистим газом\(B\). Позначимо фіксований тиск як\(P^{\#}\). Позначимо температуру кипіння чистого розчинника\(B\), при\(P^{\#}\), як\(T_B\); таким чином\(P^{\#}=P^{\textrm{⦁}}_B\left(T_B\right)\), де\(P^{\textrm{⦁}}_B\left(T_B\right)\) позначається рівноважний тиск пари чистого розчинника\(B\) при температурі\(T_B\). Наша мета - знайти температуру, при якій бінарний розчин знаходиться в рівновазі з чистим газом\(B\) при фіксованому тиску\(P^{\#}\). \(T_{bp}\)Допускаємо температуру кипіння розчину при\(P^{\#}\). Склад розчину уточнюється концентрацією розчиненої речовини,\(y_A=1-y_B\).
Оскільки ми припускаємо, що розчинена речовина підпорядковується закону Генрі, ми вибираємо стандартний стан для розчиненої речовини,\(A\) щоб бути чистою гіпотетичною рідиною, тиск пари\(A\) якої знаходиться\({\textrm{ĸ}}_A\) при\(T\). Ми вважаємо, що\({\textrm{ĸ}}_A\) це надзвичайно мало. З розділу 16. 4, у нас тоді є\(\tilde{a}_{A,\mathrm{solution}}=y_A\), так що
\[d ~ { \ln \tilde{a}_{A,\mathrm{solution}}\ }=d{ \ln y_A\ }\nonumber \]
при будь-якій температурі. З розділу 16. 8, у нас є
\[d ~ { \ln \tilde{a}_{B,\mathrm{solution}}\ }=d{ \ln y_B\ }\nonumber \]
Чистий рідкофазний розчинник знаходиться в рівновазі з газофазним розчинником при\(P^{\#}=P^{\textrm{⦁}}_B\left(T_B\right)\) і\(T_B\). Ми уявляємо, що ми створюємо розчин, додаючи невелику кількість розчиненої речовини\(A\), роблячи концентрації розчиненої речовини і розчинника\(y_A\) і\(y_B=1-y_A\), відповідно. Ми підтримуємо постійний тиск в системі\(P^{\#}\), змінюючи при цьому температуру для підтримки рівноваги між газовою фазою і розчинником фази розчинника\(B\). Нова температура є\(T_{bp}\).
Тиск газової фази В постійне при\(P^{\#}\). Температура йде від\(T_B\) до\(T_{bp}\). Ми вибираємо стандартний стан активності чистим газом В в\(P^{\#}\) і Т. Це означає, що активність чистого газу є одиницею при кожній температурі, так що\(d{ \ln \tilde{a}_{B,\mathrm{gas}}\ }=0\).
Варто зазначити, що ми можемо прийти до цього висновку з іншої точки зору: з розділу 14.14 поступова зміна діяльності є
\[d ~ { \ln \tilde{a}_{B,\mathrm{gas}}\ }=\left(-\frac{\overline{H}_B}{RT^2}+\frac{\tilde{H}^o_B}{RT^2}\right)dT\nonumber \]
де\(\overline{H}_B\) - часткова молярна ентальпія газової фази\(B\) at\(T\), і\(\tilde{H}^o_B\) часткова молярна ентальпія\(B\) в її активності в стандартному стані при\(\ T\). Оскільки ми припускаємо, що газова фаза по суті чиста\(B\), ми маємо\(\overline{H}_B=\tilde{H}^o_B\) і, знову ж таки,\(d \ln \tilde{a}_{B,\mathrm{gas}}=0\).
З розділу 14.3 ми маємо загальний результат, який
\[d\mu_B={\overline{V}}_BdP-{\overline{S}}_BdT+RT\left(d{ \ln \tilde{a}_B\ }\right)\nonumber \]
Тиск і температура в системі є\(P=P^{\#}\) і\(T=T_{bp}\). Як для газової фази, так і для фази розчину ми маємо\(dP=0\) і\(dT=dT_{bp}\). З тих пір\(d{ \ln \tilde{a}_{B,\mathrm{gas}}\ }=0\), у нас є
\[d\mu_{B,\mathrm{gas}}=-{\overline{S}}_{B,\mathrm{gas}}dT_{bp}\nonumber \]
З тих пір\(d ~ { \ln \tilde{a}_{B,\mathrm{solution}}\ }=d{ \ln y_B\ }\), у нас є
\[d\mu_{B,\mathrm{solution}}=-{\overline{S}}_{B,\mathrm{solution}}dT_{bp}+RT_{bp}\left(d{ \ln y_B\ }\right)\nonumber \]
Хімічний потенціал чистого, постійного тиску, газофазного розчинника залежить тільки від температури. Хімічний потенціал розчинника постійного тиску, розчин-фази залежить від температури та концентрації розчиненої речовини. Рівновага зберігається, якщо
\[d\mu_{B,\mathrm{solution}}=d\mu_{B,\mathrm{gas}}\nonumber \]
Підставляючи, ми маємо
\[-{\overline{S}}_{B,\mathrm{solution}}dT_{bp}+RT_{bp}\left(d{ \ln y_B\ }\right)=-{\overline{S}}_{B,\mathrm{gas}}dT_{bp}\nonumber \]
З тих пір\(y_B=1-y_A\approx 1\),
\[d{ \ln y_B\ }=d{ \ln \left(1-y_A\right)\ }={-dy_A}/{\left(1-y_A\right)}\approx -dy_A\nonumber \]
Відносини\(d\mu_{B,\mathrm{solution}}=d\mu_{B,\mathrm{gas}}\) стають
\[-{\overline{S}}_{B,\mathrm{solution}}dT_{bp}-RT_{bp}dy_A=-{\overline{S}}_{B,\mathrm{gas}}dT_{bp}\nonumber \]
або
\[dy_A=\left(\frac{\overline{S}_{B,\mathrm{gas}}}-\overline{S}_{B,\mathrm{solution}} {RT_{bp}} \right)dT_{bp} \nonumber \]
Розглянемо системи, в яких температура кипіння розчину\(T_{bp}\), мало чим відрізняється від температури кипіння чистого розчинника,\(T_B\). Потім\(T_B\approx T_{bp}\), і\({T_{bp}}/{T_B}\approx 1\). Ми пускаємо\(\Delta T=T_{bp}-T_B\), куди\(\left|\Delta T\right|\ll T_B\). Оскільки розчин майже чистий\(B\), часткова молярна ентропія\(B\) в розчині приблизно дорівнює чистому.\(B.\) Отже, ця часткова молярна різниця ентропії є, до хорошого наближення, просто ентропією випаровування розчинника, при рівновазі, в точці кипіння для зазначеного тиску в системі,\(P^{\#}=P^{\textrm{⦁}}_B\left(T_B\right)\). Тоді, оскільки випаровування чистого\(B\) при\(P^{\#}\) і\(T_B\) є оборотним процесом,
\[{\left({\overline{S}}_{B,\mathrm{gas}}-{\overline{S}}_{B,\mathrm{solution}}\right)}_{P^{\#},T_{bp}}\approx {\left({\overline{S}}^{\textrm{⦁}}_{B,\mathrm{gas}}-{\overline{S}}^{\textrm{⦁}}_{B,\mathrm{liquid}}\right)}_{P^{\#},T_B}=\Delta_{\mathrm{vap}}S_B={\Delta_{\mathrm{vap}}H_B}/{T_B}\nonumber \]
щоб
\[dy_A=\left(\frac{\Delta_{\mathrm{vap}}H_B}{RT_{bp}T_B}\right)dT_{bp}\nonumber \]
У розчині розчинена моль фракція є\(y_A\); в чистому розчиннику вона дорівнює нулю. При\(P^{\#}\) і\(T_B\),\(\Delta_{\mathrm{vap}}H_B\) є постійною. Інтегруючи, між межами\(\left(0,T_B\right)\) і\(\left(y_A,T_{bp}\right)\), ми маємо
\[\int^{y_A}_0{dy_A}=\frac{\Delta_{\mathrm{vap}}H_B}{RT_B}\int^{T_{bp}}_{T_B}{\frac{dT_{bp}}{T_{bp}}}\nonumber \]і\[y_A=\frac{\Delta_{\mathrm{vap}}H_B}{RT_B}{ \ln \frac{T_{bp}}{T_B}\ }\nonumber \]
Вводячи наближення\({ \ln x\approx x-1\ }\), яке справедливо для\(x\approx 1\), ми маємо
\[y_A=\frac{\Delta_{\mathrm{vap}}H_B}{RT_B}\left(\frac{T_{bp}}{T_B}-1\right)=\frac{\Delta_{\mathrm{vap}}H_B}{RT^2_B}\Delta T\]
Рішення для\(\Delta T\),
\[\Delta T=\left(\frac{RT^2_B}{\Delta_{\mathrm{vap}}H_B}\right)y_A\nonumber \]
Оскільки ентальпія випаровування і мольна фракція обидва більше нуля\(\Delta T=T_{bp}-T_B>0\); тобто додавання нелеткого розчиненого речовини збільшує температуру кипіння рідкої системи. Вимірюючи\(\Delta T\), ми можемо знайти\(y_A\); якщо ми знаємо молярну масу розчинника, ми можемо обчислити кількість молів розчиненої речовини в розчині. Якщо ми знаємо масу розчиненої речовини, яка використовується для приготування розчину, ми можемо обчислити молярну масу розчиненого речовини.
Часто корисно виражати концентрацію розчиненої речовини як моляльність, а не моль фракції. Використання співвідношення розбавлення-розчин між молярною фракцією та молялією з розділу 16. 6\(y_A={\overline{M}_B{\underline{m}}_A}/{1000}\), висота точки кипіння стає:
\[\Delta T=\left(\frac{RT^2_B}{\Delta_{\mathrm{vap}}H_B}\right)\left(\frac{\overline{M}_B}{1000}\right){\underline{m}}_A\nonumber \]
Наша теорія передбачає, що висота точки кипіння, що спостерігається для даного розчинника, пропорційна концентрації розчиненої речовини і не залежить від молекулярних характеристик розчиненої речовини. Експерименти підтверджують це прогнозування; однак його точність зменшується зі збільшенням концентрації розчиненої речовини. здача в оренду
\[{\textrm{ĸ}}_B=\frac{RT^2_B}{\Delta_{\mathrm{vap}}H_B}\nonumber \]і\[{\textrm{ĸ}}^*_B=\frac{RT^2_B\overline{M}_B}{1000\ \Delta_{\mathrm{vap}}H_B}\nonumber \]
у нас є\(\Delta T={\textrm{ĸ}}_By_A\) і\(\Delta T={\textrm{ĸ}}^*_B{\underline{m}}_A\). \({\textrm{ĸ}}^*_B\)Називаємо\({\textrm{ĸ}}_B\) або температуру кипіння (або температури кипіння) підвищення постійної для розчинника\(B\). Для практичного визначення молекулярних мас ми зазвичай знаходимо\({\textrm{ĸ}}_B\) або\({\textrm{ĸ}}^*_B\) вимірюємо збільшення температури кипіння розчину відомого складу.
