16.11: Колігативні властивості - депресія точки замерзання
- Page ID
- 21832
Температура кипіння чистого розчинника при заданому тиску - це температура, при якій хімічний потенціал чистого газу-розчинника дорівнює хімічному потенціалу чистої рідини розчинника. Температура кипіння розчину, що містить нелетку розчинену речовину, - це температура, при якій хімічний потенціал чистого газу-розчинника дорівнює хімічному потенціалу розчинника в розчині. У попередньому розділі ми з'ясували, що температура кипіння розчину більше, ніж температура кипіння чистого розчинника. Різниця температур - це висота точки кипіння.
Точно так само температура замерзання чистого розчинника при заданому тиску - це температура, при якій хімічний потенціал чисто-твердого розчинника дорівнює хімічному потенціалу чисто-рідкого розчинника. Точка замерзання розчину - це температура, при якій хімічний потенціал чисто-твердого розчинника дорівнює хімічному потенціалу розчинника фази розчинника. Виявляємо, що температура замерзання розчину менше температури замерзання чистого розчинника. Різниця температур - це депресія точки замерзання.
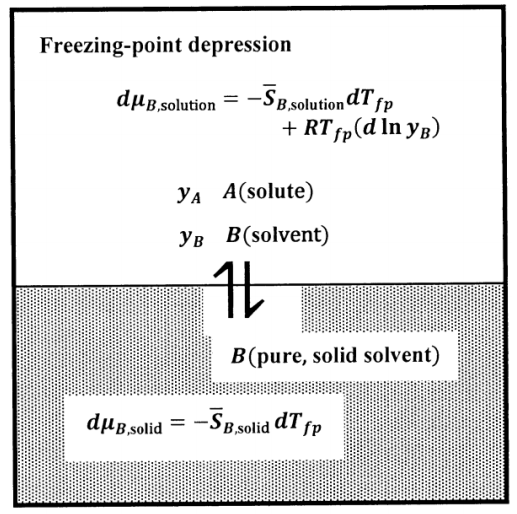
У випадку висоти точки кипіння ми припускаємо, що чистий газ розчинника не містить розчиненої речовини. У випадку депресії точки замерзання ми припускаємо, що чиста тверда речовина розчинника не містить розчиненої речовини. Ми знаходимо зв'язок між складом і депресією точки замерзання аргументом, дуже схожим на той, що для висоти точки кипіння. Рівноважний стан в експерименті з депресією точки замерзання описано схематично на малюнку 8.
Оскільки рівноважна температура знижується у міру збільшення концентрації розчиненої речовини, ми можемо реалізувати стан рівноваги експериментально шляхом повільного охолодження розчину зазначеного складу. Визначаємо температуру, при якій утворюється перший, дуже маленький, кристал твердого розчинника. Оскільки чистий розчинник замерзає при більш високій температурі, ніж будь-який розчин, перший утворений кристал є майже чистим твердим розчинником. Так як цей перший кристал дуже малий, то його утворення істотно не змінює склад розчину. Отже, розчин знаходиться в рівновазі з чистим твердим розчинником при цій температурі; ми називаємо цю температуру температурою замерзання розчину.
На практиці прийнято визначати температуру плавлення твердої суміші, а не температуру замерзання рідкого розчину. Температуру твердої суміші підвищують повільно. Коли суміш плавиться до утворення однорідного розчину, співвідношення розчин—розчинник в розплаві наближається до співвідношення, в якому готувалася суміш. Коли розплавиться остання частка твердого тіла, склад розчину відомий з способу приготування. Цей останній біт твердої речовини плавиться при найвищій температурі будь-якої частини суміші. Він містить, отже, найменшу частку розчиненої речовини. Якщо цей останній біт твердої речовини насправді є чистим розчинником, температура, при якій плавиться остання тверда речовина, є точкою замерзання рідкого розчину. У межах того, що експерименти з точкою замерзання та точки плавлення проводяться оборотно, стан системи точки замерзання відразу після першого біта твердих замерзань такий же, як стан системи точки плавлення безпосередньо перед останнім бітом твердих розплавів.
Знову уточнюємо склад розчину по мольних частках\(A\) і\(\ B\). Ми дозволяємо розчиненому речовині бути\(A\) сполукою, і припускаємо, що його концентрація низька. Ми дозволяємо концентрації розчиненої речовини бути\(y_A\), де\(y_A=1-y_B\),\(y_A\approx 0\) і\(y_B=1-y_A\approx 1\). The\(A\) —\(B\) розчин знаходиться в рівновазі з чистим твердим тілом\(B\). Ми хочемо знайти температуру, при якій ці фази знаходяться в рівновазі. При цій температурі\(\mu_{B,\mathrm{solution}}=\mu_{B,\mathrm{solid}}\), а значить і\(d\mu_{B,\mathrm{solution}}=d\mu_{B,\mathrm{solid}}\) при будь-якій зміні, яка виводить систему в новий рівноважний стан.
Ми можемо проаналізувати явище депресії точки замерзання для будь-якого фіксованого тиску, при якому чиста рідина\(B\) може знаходитися в рівновазі з чистою твердою речовиною\(\ B\). Позначимо фіксований тиск як\(P^{\#}\) і температуру замерзання чистої рідини В, в\(P^{\#}\), як\(T_F\). Наша мета - знайти температуру, при якій бінарний розчин знаходиться в рівновазі з чистим твердим тілом\(B\) при фіксованому тиску\(P^{\#}\). \(T_{fp}\)Допускаємо температуру замерзання розчину при\(P^{\#}\). Ми базуємо наш аналіз на припущенні, що\(A\) підпорядковується закону Генрі.
Ми дозволяємо чистому твердому розчиннику бути стандартним станом для твердого розчинника (див. Розділ 15.5). Потім, при кожній температурі\(\mu_{B,\mathrm{solid}}={\widetilde\mu}^o_{B,\mathrm{solid}}\), і
\[\mu_{B,\mathrm{solid}}-{\widetilde\mu}^o_{B,\mathrm{solid}}=RT{ \ln {\tilde{a}}_{B,\mathrm{solid}}\ }=0\]При кожній температурі,\({\tilde{a}}_{B,\mathrm{solid}}=1\) так що\({\left({ \ln {\tilde{a}}_{B,\mathrm{solid}}\ }\right)}_{PT}=0\). Тиск в системі постійний при\(P^{\#}\), значить\(dP=0\). У загальному вираженні
\[d\mu_{B,\mathrm{solid}}=\overline{V}_{B,\mathrm{solid}}dP-\overline{S}_{B,\mathrm{solid}}dT+RT{\left(d{ \ln {\tilde{a}}_{B,\mathrm{solid}}\ }\right)}_{PT}\]
тільки термін in\(dT\) є ненульовим. Визнаючи, що\(dT\) це зміна температури замерзання при\(P^{\#}\), для деякої зміни хімічного потенціалу чистого твердого тіла\(B\), ми маємо
\[d\mu_{B,\mathrm{solid}}=-\overline{S}^{\textrm{⦁}}_{B,\mathrm{solid}}\ dT_{fp}\]
Ми дозволяємо чисто-рідкому розчиннику при його рівноважному тиску пари бути стандартним станом для розчинника фази розчинника (див. Розділ 16.2). Позначимо це рівноважний тиск пари як\(P^{\textrm{⦁}}_B\left(T_{fp}\right)\). Тепер, оскільки ми в кінцевому підсумку знаходимо\(T_{fp}<t_f\) >, чиста рідина стихійно замерзає\(T_{fp}\). Таким чином, стандартним станом для рідкого розчинника є гіпотетичний стан; це чиста, переохолоджена рідина. Властивості цієї гіпотетичної рідини можна оцінити з нашої теорії; однак, за винятком, можливо, в незвичайних обставин, їх неможливо виміряти безпосередньо. Оскільки ми припускаємо, що розчинна речовина підпорядковується закону Генрі, ми маємо з розділу 16.8, що\(d{ \ln {\tilde{a}}_{B,\mathrm{solution}}=d{ \ln y_B\ }\ }\). Таким чином, поки активність чисто-твердого розчинника постійна, активність розчинника в розчині змінюється в залежності від концентрації розчиненої речовини. У нас є
\[d\mu_{B,\mathrm{solution}}=-\overline{S}_{B,\mathrm{solution}}\ dT_{fp}+RT_{fp}{\left(d{ \ln y_B\ }\right)}_{PT}\]
\(d{ \ln y_B\ }\approx -dy_A\)Використовуючи, відносини\(d\mu_{B,\mathrm{solution}}=d\mu_{B,\mathrm{solid}}\) стають
\[-\overline{S}_{B,\mathrm{solution}}\ dT_{fp}-RT_{fp}dy_A=-\overline{S}^{\textrm{⦁}}_{B,\mathrm{solid}}\ dT_{fp}\]
або
\[dy_A=-\left(\frac{\overline{S}_{B,\mathrm{solution}}-\overline{S}^{\textrm{⦁}}_{B,\mathrm{solid}}}RT_{fp}\right)dT_{fp}\]
Розглядаються системи, в яких температура замерзання розчину\(T_{fp}\), мало чим відрізняється від температури замерзання чистого розчинника,\(T_F\). Потім\(T_F\approx T_{fp}\), і\({T_{fp}}/{T_F}\approx 1\). Ми пускаємо\(\left|\Delta T\right|=T_F-T_{fp}\), куди\(\left|\Delta T\right|\ll T_F\). Оскільки розчин майже чистий\(B\), часткова молярна ентропія\(B\) в розчині приблизно така, як у чистої рідини\(B\). Отже, часткова молярна різниця ентропії - це, до хорошого наближення, просто ентропія злиття чистого розчинника, при рівновазі, в точці замерзання для заданого тиску системи. Тобто,
\[{\left(\overline{S}_{B,\mathrm{solution}}-\overline{S}^{\textrm{⦁}}_{B,\mathrm{solid}}\right)}_{P^{\#},T_{fp}}\approx {\left(\overline{S}^{\textrm{⦁}}_{B,\mathrm{liquid}}-\overline{S}^{\textrm{⦁}}_{B,\mathrm{solid}}\right)}_{P^{\#},T_F}=\Delta_{\mathrm{fus}}S_B={\Delta_{\mathrm{fus}}H_B}/{T_F}\]
щоб\[dy_A=-\left(\frac{\Delta_{\mathrm{fus}}H_B}{RT_{fp}T_F}\right)dT_{fp}\]
При\(P^{\#}\) і\(T_F\),\(\Delta_{\mathrm{fus}}H_B\) є постійною. У розчині розчинена мольна фракція є\(y_A\); в чистому твердому розчиннику вона дорівнює нулю. Інтеграція між межами\(\left(0,T_F\right)\) і\(\left(y_A,T_{fp}\right)\), у нас є
\[\int^{y_A}_0{dy_A}=-\frac{\Delta_{\mathrm{fus}}H_B}{RT_F}\int^{T_{fp}}_{T_F}{\frac{dT_{fp}}{T_{fp}}}\]і\[y_A=-\frac{\Delta_{\mathrm{fus}}H_B}{RT_F}{ \ln \frac{T_{fp}}{T_F}\ }\]
Представляючи\({ \ln x\approx x-1\ }\), у нас є\[y_A=-\frac{\Delta_{\mathrm{fus}}H_B}{RT_F}\left(\frac{T_{fp}}{T_F}-1\right)=\frac{\Delta_{\mathrm{fus}}H_B}{RT^2_F}\Delta T\] Рішення для\(\Delta T\),\[\Delta T=\left(\frac{RT^2_F}{\Delta_{\mathrm{fus}}H_B}\right)y_A\]
Процес злиття ендотермічний, і\(\Delta_{\mathrm{fus}}H_B>0\). Тому знаходимо\(\Delta T=T_F-T_{fp}>0\); тобто додавання розчиненої речовини зменшує температуру замерзання рідини. Заглиблення точки замерзання пропорційно концентрації розчиненої речовини.
Оскільки вимірювання\(\Delta T\) дозволяє нам знайти\(y_A\), депресія точки замерзання - як підвищення температури кипіння - дозволяє нам визначити молярну масу розчиненої речовини. У нашому обговоренні висоти точки кипіння ми відзначили, що часто зручно виражати концентрацію розведеного розчиненого речовини в одиницях молярності, а не мольної фракції. Це стосується і депресії точки замерзання. Так само для практичного застосування ми зазвичай знаходимо постійну депресії точки замерзання, вимірюючи депресію точки замерзання розчину відомого складу.
