10.E: Реакції додавання нуклеофільних карбонілів (вправи)
- Page ID
- 20712
P10.1: Намалюйте механізм, що показує формування імінного зв'язку між бічним ланцюгом лізину та a-кетобутиратом (це перший крок у деградації лізину, EC 1.5.1.8).
P10.2: Намалюйте чотири можливі циклічні гемікетільні ізомери сполуки нижче.
P10.3: Проміжний продукт нижче за течією в шляху деградації лізину піддається гідролізу іміну для вивільнення двох амінокислотних продуктів (EC 1.5.1.1). Намалюйте механізм цієї реакції гідролізу і покажіть структури двох утворених продуктів.
P10.4: Нижче наведена структура лактози, цукру, що міститься в молочних продуктах.
Лактоза - дисахарид галактози і глюкози. Люди, які страждають непереносимістю лактози, не виробляють достатньої кількості лактази - ферменту, який гідролізує глікозидний зв'язок, що зв'язує два моносахариди - щоб мати можливість повноцінно перетравлювати молочні продукти.
- Намалюйте ймовірний стабілізований проміжний проміжний продукт карбокату в реакції гідролізу, каталізованої лактазою.
- Намалюйте в конформації крісла структуру того, що ви прогнозуєте, буде найпоширенішою формою моносахариду галактози у водному розчині.
- Галактоза - альдоза або кетоза?
- Намалюйте, показуючи стерохімію, відкриту форму галактози.
P10.5: Ви, напевно, знаєте, що аскорбінова кислота (вітамін С) діє як антиоксидант в організмі. Коли вітамін С виконує свою роботу, він в кінцевому підсумку окислюється до дегідроаскобату, який зазвичай малюється, як показано нижче, у так званій формі трикарбонілу.
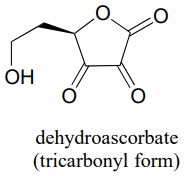
Однак докази свідчать про те, що найважливішою формою дегідроаскорбату у фізіологічному контексті є та, в якій одна з кетонових груп знаходиться у своїй гідратованій формі, а інша - внутрішньомолекулярний гемікетал (див. Новини хімічної та інженерної промисловості, 25 серпня 2008 р., стор. 36). Показати будову цієї форми дегідроаскорбінової кислоти.
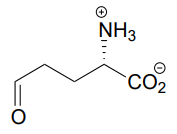
P10.6: З'єднання нижче є продуктом етапу гідролізу іміну, що відкриває кільце, в шляху деградації проліну, однієї з амінокислот. Намалюйте структуру стартового складу.
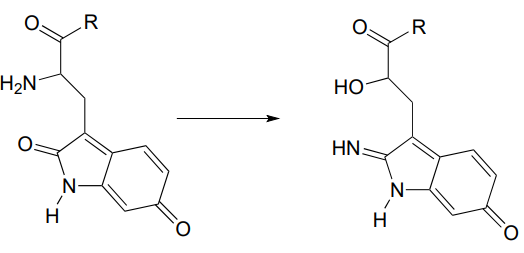
P10.7: Перестановку нижче було запропоновано продовжити через утворення іміну з подальшим нуклеофільним заміщенням. Запропонуйте механізм, який підходить під цей опис. (Дж. біол. Хім. 280, 12858, схема 2 частина 2).
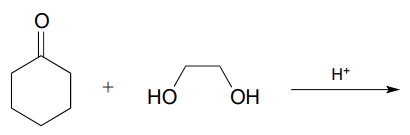
P10.8: Біохімічні ацетолоутворюючі реакції, про які ми дізналися в цьому розділі, вимагають активації геміацеталю шляхом фосфорилювання. У лабораторії органічного синтезу проводяться неферментативні ацетлообразующие реакції з каталітичною кількістю сильної кислоти, яка служить для активації геміацеталя. Прогнозуйте продукт наступної реакції формування ацеталу та запропонуйте розумний механізм реакції. Пам'ятайте, що реакція проводиться в кислих умовах, а це значить, що стан протонації проміжних продуктів буде відрізнятися від біохімічних реакцій, що протікають при нейтральних\(pH\).
Проблеми 9-15 пов'язані з варіаціями та комбінаціями кроків нуклеофільного додавання, які ми вивчали в цьому розділі. Хоча реагенти та/або продукти можуть виглядати дещо інакше, ніж простіші альдегіди, ацетали, іміни тощо, які ми використовували як приклади в розділі, ключові кроки все ще включають по суті ті ж механістичні моделі. Перш ніж спробувати ці проблеми, ви можете переглянути реакції тавтомеризації в розділі 7.6.
P10.9: Завершальним етапом біосинтезу інозинмонофосфату (IMP, попередника як AMP, так і GMP) є реакція закриття кільця, в якій утворюється новий азот-вуглецевий зв'язок (позначений стрілкою в структурі нижче). Прогнозуйте початковий субстрат для цієї реакції та запропонуйте механізм, який передбачає незначну зміну типового утворення іміну. (СЕК. 3.5.4.10)
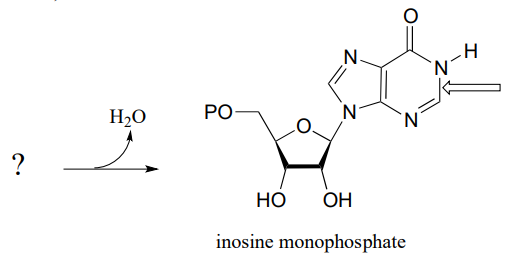
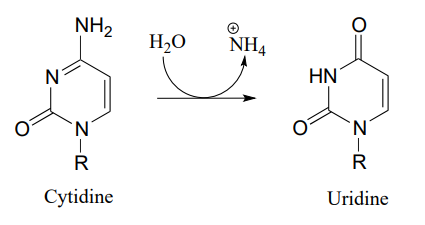
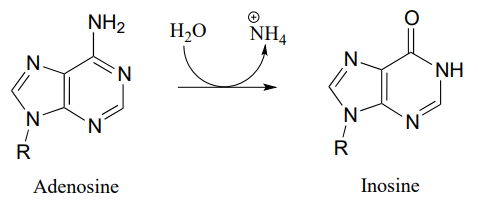
P10.10: Запропонуйте механізм для цих етапів метаболізму нуклеотидів:
- (СЕК. 3.5.4.5)
- (СЕК. 3.5.4.4)
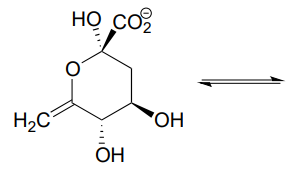
П10.11
- Намалюйте структуру (включаючи стереохімію) сполуки, яка виникає, коли циклічний гемікетал, показаний нижче, переходить до сполуки з відкритим ланцюгом з двома кетоновими групами.
- З'єднання, показане нижче, зазнає реакції відкриття кільця, утворюючи вид, який можна описати як енол, так і енамін. Намалюйте структуру (в тому числі і стереохімію) цього продукту, і ймовірний механізм його формування. (СЕК. 5.3.1.24)
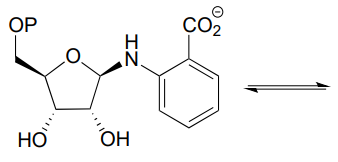
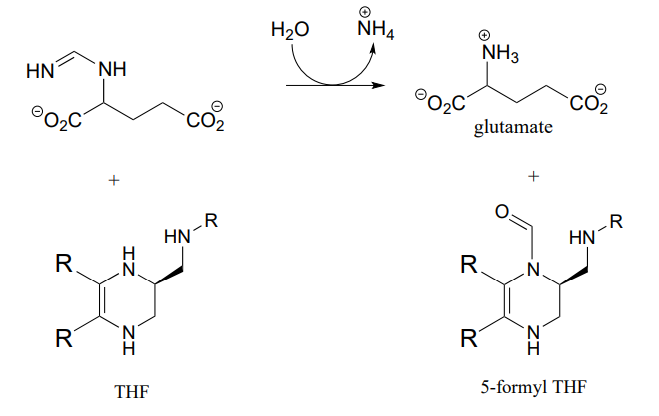
P10.12: Тетрагідрофолат (\(THF\)) - кофермент, який служить одновуглецевим донором у багатьох біохімічних реакціях. На відміну від\(S\) -аденозилметіоніну (SAM, див. Розділ 8.8), вуглець, що переноситься в\(THF\) -залежній реакції, часто є частиною карбонілу. Нижче наведена реакція в шляху деградації гістидину (EC 3.5.3.8). Вважається, що задіяний механізм є транзимінацією, з подальшою таутомеризацією іміну до іміну з подальшим гідролізом іміну. Запропонуйте розумний механізм, який підходить під цей опис. Підказка: спочатку визначте атом вуглецю, який переноситься.
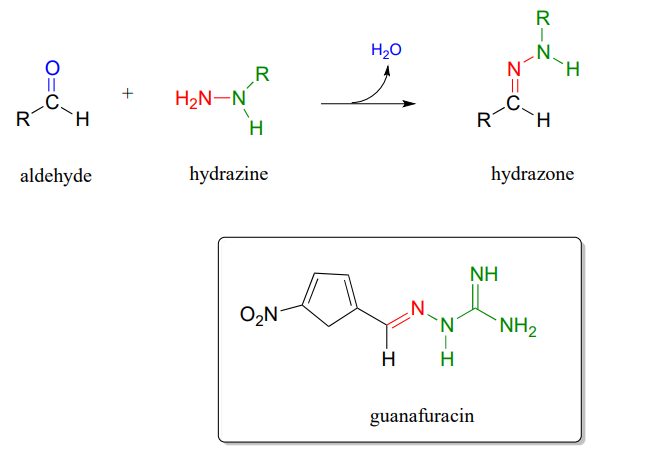
P10.13: Гідразони - близькі родичі імінів, що утворюються в реакціях між альдегідами/кетонами і гідразинами, функціональною групою, що містить азот-азот зв'язок. Механізм утворення гідразону аналогічний механізму утворення іміну.
Гуанафурацин, відома антибіотична сполука, є гідразоном, і його можна легко приготувати в лабораторії, поєднуючи еквимолярні кількості відповідного альдегіду та гідразину у воді (не потрібно тепла або кислотного каталізатора, і реакція завершується за лічені секунди).
Визначте вихідні матеріали, необхідні для синтезу гуанафурацину, і запропонуйте ймовірний механізм реакції.
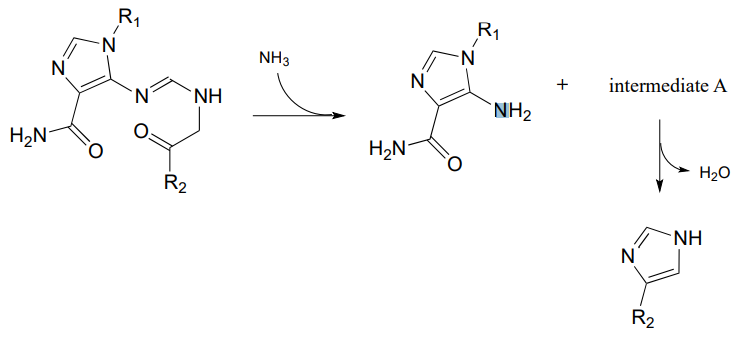
P10.14: Запропонувати розумні механізми для наступних кроків від шляху біосинтезу гістидину та передбачити структуру проміжного А (який є відкритим ланцюгом, а не циклічним).
Останні кілька проблем досить складні!
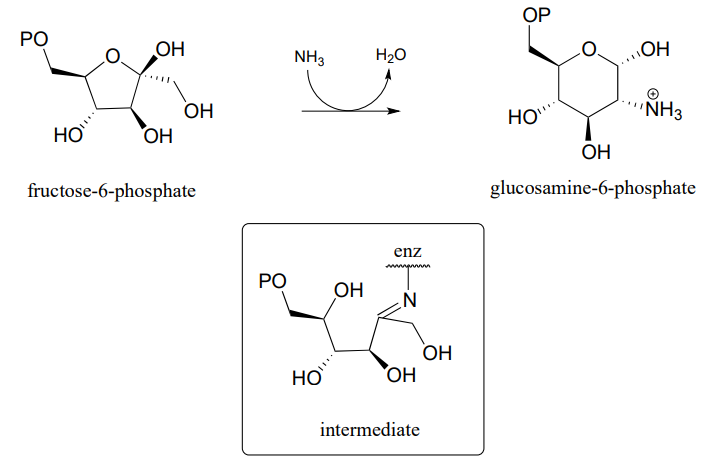
P10.15: Запропонуйте ймовірний механізм синтезу глюкозаміну 6-фосфату з фруктози-6-фосфату. Показаний один з декількох проміжних продуктів. (ВИД. 2.6.1.16.)
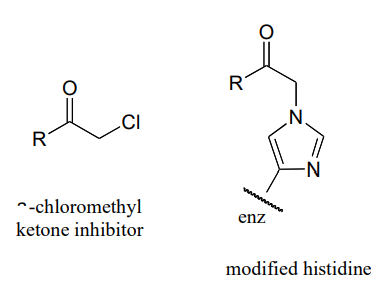
P10.16:\(\alpha \) -хлорметилкетони (структура нижче) є ефективними незворотними інгібіторами протеолітичних (руйнування пептидних зв'язків) ферментів, таких як хімотрипсин. У цих ферментах ключову роль в реакції відіграє нуклеофільний серин. Вважається, що механізм інактивації а-хімотрипсину передбачає, як перший крок, нуклеофільну атаку активним сайтом серину на карбонілі інгібітора. Однак, коли інактивований фермент аналізується, активний сайт гістидин, а не серин, виявляється ковалентно модифікованим інгібітором. Структура модифікованого гістидину показана нижче. Вважається, що механізм інактивації передбачає епоксидний проміжний продукт - маючи на увазі це, запропонувати розумний механізм інактивації.
P10.17: Фермент у бактеріях кишкової палички каталізує гідроліз A-глюкози-ВВП до глюкози.
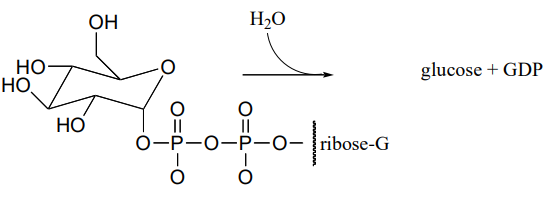
\(^1H-NMR\)аналіз поточної реакції показав початкову появу дуплету на 4,64 проміле з J = 7.9 Гц (спектр містив і інші сигнали, звичайно). Через 20 хвилин (в цей момент реакція гідролізу була завершена протягом деякого часу) ще один дуплет почав з'являтися трохи вниз, цей з J = 4.0 Гц. З часом сила сигналу нижнього поля поступово збільшувалася, а сигнал вгору поступово зменшувалася, поки вони не стабілізувалися на постійних рівнях.
Намалюйте механізм реакції ферментативного гідролізу, і співвіднесіть свій механізм з\(NMR\) даними (включаючи появу другого дуплета).
P10.18: Аргініндеаміназа, фермент у шляху деградації аргініну, каталізує перетворення (\(L\)) -аргініну в (\(L\)) -цитрулін через проміжний проміжний проміжний продукт ковалентного субстрата-цистеїну.
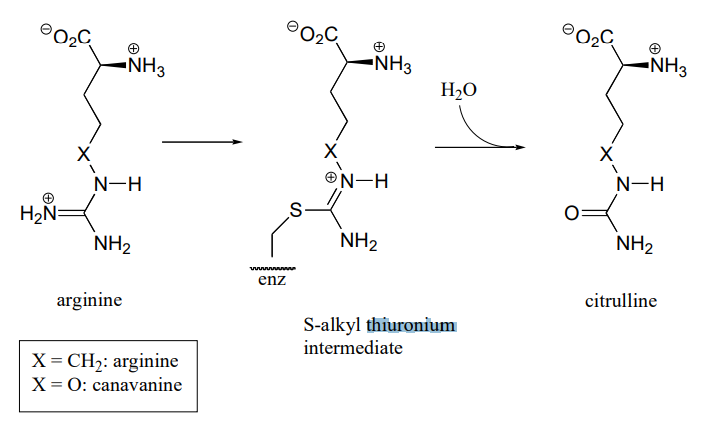
Цей фермент є мішенню для розробки ліків від раку та імунологічних захворювань, таких як артрит. Однак, замість того, щоб повністю і постійно вимикати фермент (наприклад, з незворотним інгібітором), дослідники шукають спосіб тимчасово «зменшити» активність ферменту. Одна стратегія, про яку нещодавно повідомлялося, передбачає використання оксигенсодержащего аналога аргініну, який називається канаванін, який реагує так само, як аргінін, за винятком того, що другий (гідроліз) етап дуже повільний. У той час як фермент ковалентно приєднується до інгібітора (в стадії\(S\) -алкілтіуроній), він інактивується.
- Показати механізм реакції, каталізованої аргініндеаміназою.
- Поясніть, як електронний ефект кисневого замінника сповільнить етап гідролізу реакції, і чому на швидкість стадії гідролізу більше впливає заміщення кисню, ніж етап\(S\) формування -алкілтіуронію.
