10.2: Нуклеофільні добавки до альдегідів та кетонів - огляд
- Page ID
- 20725
Альдегідні і кетонові функціональні групи
Нагадаємо з глави 1, що функціональна група кетонів складається з карбонілу, пов'язаного з двома вуглецями, тоді як в альдегіді один (або обидва) сусідніх атомів - водень.
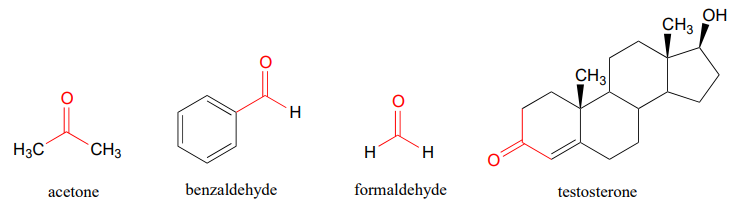
Ви, напевно, знайомі з прикладами, показаними нижче: ацетон, найпростіша кетонова сполука, є розчинником для зняття лаку для нігтів, бензальдегід - ароматизатор у вишні мараскино, а формальдегід (особливий випадок, коли карбонільний вуглець пов'язаний з воднями з обох сторін) - це неприємний запах речі, які були використані для збереження невдалої жаби, яку ви розсікали в класі біології середньої школи. Чоловічий статевий гормон тестостерон містить кетонову групу на додаток до алкогольних і алкенових груп.
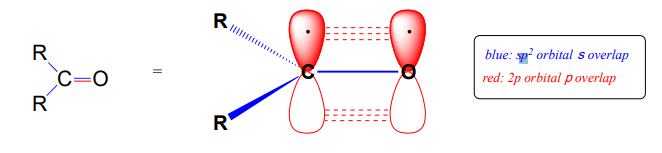
Нагадаємо, з глави 2 картину зв'язку в кетоні або альдегіді: карбонільний вуглець\(sp^2\) гібридизований, причому три тригональні плоскі\(sp^2\) орбіталі утворюють\(s\) зв'язки з орбіталями на кисні та на двох атомах вуглецю або водню. Решта\(2p\) негібридизованої орбіталі перпендикулярна площині, утвореній\(sp^2\) орбіталями, і утворює\(p\) зв'язок через бічне перекриття з\(2p\) орбіталлю на кисні. \(s\)І\(p\) зв'язки між вуглецем і киснем об'єднуються, щоб зробити\(C=O\) подвійний зв'язок, який визначає карбонільну функціональність.
Нуклеофільна добавка
Подвійний зв'язок вуглецево-кисневий полярний: кисень більш електронегативний, ніж вуглець, тому електронна щільність вище на кисневому кінці зв'язку і нижча на вуглецевому кінці. Нагадаємо, що полярність зв'язку може бути зображена за допомогою дипольної стрілки (A на малюнку нижче), або показуючи кисень як несучий частковий негативний заряд, а карбонільний вуглець - частковий позитивний заряд (B).
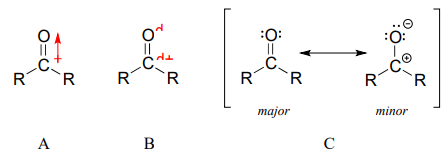
Третій спосіб проілюструвати вуглець-кисневий диполь (C на малюнку вище) - розглянути два основні резонансні учасники: основну форму, яку ви зазвичай бачите намальованою в структурах Льюїса, і незначний, але дуже важливий внесок, в якому обидва електрони в зв'язку р локалізуються на кисні, даючи йому повний негативний заряд. На останньому зображенні зображений вуглець з порожньою\(2p\) орбітою і повним позитивним зарядом.
Однак полярність зв'язку зображена, кінцевим результатом є те, що карбонільний вуглець є бідним електроном - іншими словами, це електрофіл. Крім того, тригональна планарна геометрія означає, що карбонільна група безперешкодна). Таким чином, він є відмінною мішенню для атаки багатою електронами нуклеофільної групою, механістичним кроком, званим нуклеофільним додаванням:
Нуклеофільна добавка до альдегіду або кетону (ферментативного)
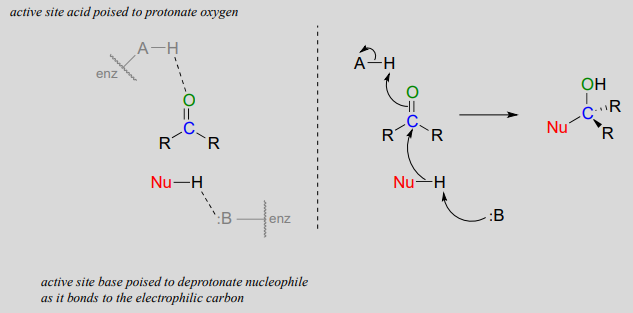
Зверніть увагу на кислотно-лужний каталіз, який відбувається в цьому узагальнювальному механізмі: в активному місці ферменту основна група готова депротонувати нуклеофіл (тим самим посилюючи його нуклеофільність), оскільки починає атакувати карбонільний вуглець, тоді як в той же час кислий протон на іншій активній групі сайту розташований трохи вище карбонільного кисню (тим самим підвищуючи електрофільність вуглецю), готовий протонувати кисень і нейтралізувати будь-який негативний заряд, який накопичується.
Стереохімія нуклеофільної добавки до карбонілу
Нагадаємо з розділу 3.11B, що коли дві групи, прилеглі до карбонілу, не однакові, ми можемо розрізнити re та si «грані» планарної структури.
Поняття тригональної планарної групи, що має дві чіткі грані, вступає в дію, коли ми розглядаємо стереохімічний результат реакції нуклеофільного приєднання. Зверніть увагу, що в ході реакції приєднання карбонілів гібридизація карбонільного вуглецю змінюється від sp2 до sp3, що означає, що геометрія зв'язку змінюється від тригональної планарної до тетраедричної. Якщо дві групи R не еквівалентні, то при додаванні нуклеофіла створюється хіральний центр. Конфігурація нового хірального центру залежить від того, з якого боку карбонільної площини атакує нуклеофіл.
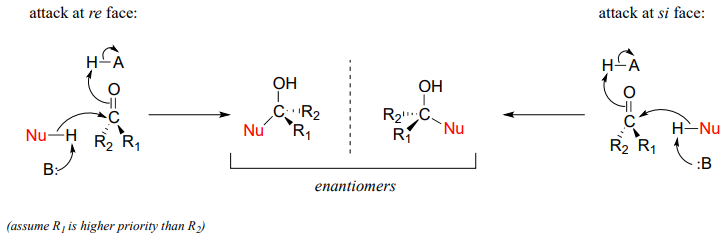
Якщо реакція каталізується ферментом, стереохімія додавання (як і слід було очікувати) жорстко контролюється, і призводить виключно до одного стереоізомера - нуклеофільні та електрофільні субстрати пов'язані в певних положеннях в межах активної ділянки, так що атака повинна відбуватися конкретно з одного сторона, а не інша. Неферментативні реакції цього типу часто призводять до суміші стереоізомерів 50:50, але також можливо, що один стереоізомер може бути більш рясним, залежно від структури реагентів і умов, в яких відбувається реакція. Ми побачимо кілька прикладів цього явища незабаром, коли розглянемо циклічні форми молекул цукру.
