31.1: Металоцени
- Page ID
- 106305
Відкриття ферроцену було однією з тих випадкових випадковостей, які були абсолютно непередбачуваними - своєрідним відкриттям, яке знову і знову змінювало хід науки. Паусон намагався синтезувати фульвален\(1\), спочатку зв'язавши дві молекули броміду циклопентадієнілмагнію з,\(\ce{FeCl_3}\) а потім дегідруючи продукт:
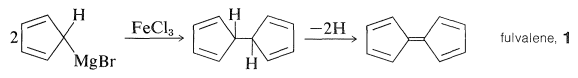
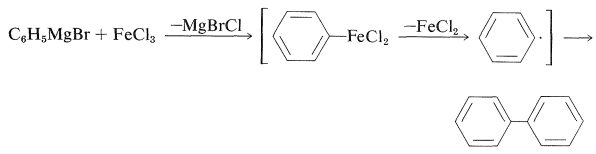
Обгрунтування реакції зчеплення полягало в тому, що фенілмагнію бромід з\(\ce{FeCl_3}\) дає високі врожаї біфенілу, імовірно, шляхом нестійкого з'єднання фенілірона:
Продукт реакції представляв собою красиво кристалічну, високостабільну помаранчеву речовину\(\ce{C_{10}H_{10}Fe}\), яку Паусон сформулював як просту комбінацію двох аніонів циклопентадієніду та іона заліза з двома\(\ce{C-Fe}\) зв'язками\(2\). Однак незабаром продукт був показаний різними фізичними методами, щоб мати структуру «сендвіча»,\(3\):
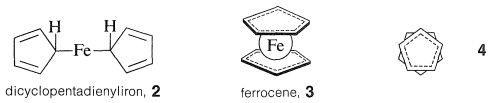
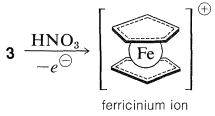
Зв'язок між металом та кільцями циклопентадієну включає\(\pi\) електрони двох кілець, всі вуглеці однаково пов'язані з центральним іоном заліза. Останній, приймаючи частку 12\(\pi\) електронів від двох циклопентадієнілових аніонів, досягає 18 зовнішньої оболонки електронної\(^1\) конфігурації інертного газу - криптона. Аналіз структури кристалічного ферроцену показує, що при погляді вниз на молекулу вздовж осі кільцево-залізо-кільце циклопентадієнові кільця видно в шаховому порядку відносно один одного, як показано в\(4\). Ферроцен має mp\(173^\text{o}\) і, хоча і стійкий до сірчаної кислоти, він легко окислюється азотною кислотою до менш стабільного іона феррицинію:
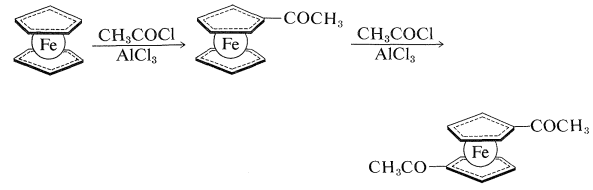
Як і бензол, ферроцен не реагує легко шляхом додавання, але піддається електрофільному заміщенню. Наприклад, ацилювання Friedel-Crafts (Розділ 22-4F)\(\ce{CH_3COCl}\) дає як моноетаноілферроцен, так і діетаноілферроцен. Дві ацильні групи приєднуються до двох різних кілець, і, оскільки можна виділити лише один діетаноїлферроцен, циклопентадієнілові групи, здається, вільно обертаються навколо осі вуглецево-залізних зв'язків:
Ферроцен - це лише одне з великої кількості сполук перехідних металів з циклопентадієніл-аніоном. Інші метали, що утворюють структури сендвіч-типу, схожі на ферроцен, включають нікель, титан, кобальт, рутеній, цирконій та осмій. Стабільність металоценів сильно змінюється залежно від металу та його ступеня окислення; ферроцен, рутеноцен та осмоцен особливо стабільні, оскільки в кожному металі досягається електронна конфігурація інертного газу. Майже гранична стійкість до окислювальної атаки досягається в\(\ce{(C_2H_5)_2Co}^\oplus\), іон кобальтицинію, який може бути відновлений з киплячої aqua regia (суміш концентрованих азотної і соляної кислот, названих за його здатність розчиняти платину і золото). У іоні кобальтицинію метал має 18 електронів зовнішньої оболонки, характерних для криптону.
Багато інших ненасичені органічні сполуки можуть утворювати\(\pi\) комплекси з перехідними металами. Речовина, яка в деякому роді аналогічна ферроцену, - це комплекс двох молекул бензолу з металом хрому, званий дибензолхромом. У зв'язку беруть участь нульовий хром і\(\pi\) електрони двох бензольних кілець. У дибензолхрому електронна конфігурація атома хрому аналогічна конфігурації криптону:
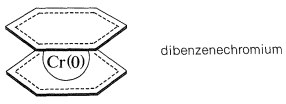
Хоча дибензенхром термічно досить стабільний, він менше, ніж ферроцен і плавиться з розкладанням при\(285^\text{o}\) отриманні бензолу і металевого хрому. Крім того, він, як видається, не має ароматичного характеру або бензолу, або ферроцену, як судять про те, що він руйнується реагентами, що використовуються для реакцій електрофільного заміщення.
Підготовлено кілька перехідно-металевих комплексів циклобутадієну, і це тим більше примітно через нестабільність вихідного вуглеводню. Реакції, які логічно повинні призвести до циклобутадієну, замість цього дають димерні продукти. Таким чином, 3,4-дихлорциклобутен був дехлорований амальгамою літію в ефірі, а вуглеводневий продукт є димером циклобутадієну,\(5\). Однак 3,4-дихлорциклобутен вступає в реакцію з дізалізонононокарбонілом\(\ce{Fe_2(CO)_9}\), щоб дати стабільний залізо трикарбонільний комплекс циклобутадієну\(6\), структура якого була встановлена за допомогою рентгенівського аналізу. \(\pi\)-електронна система циклобутадієну значно стабілізується комплексоутворенням із залізом, яке знову досягає електронної конфігурації криптону.
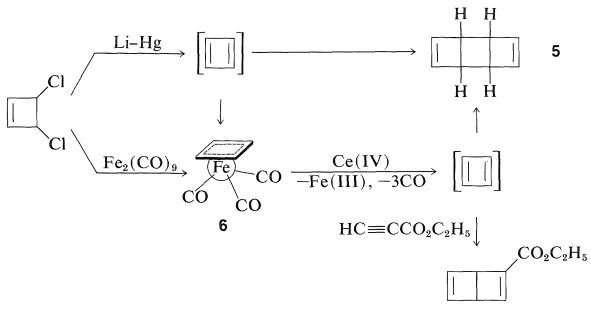
Окислення\(6\) цериновим залізом\(\ce{Ce}\) (IV) вивільняє циклобутадієн, який швидко димеризується, але може бути захоплений хорошими дієнофілами, такими як етилпропіноат, щоб дати циклоаддукт.
Багато металоценових похідних відомі з інших спряжених циклічних поліенів. Прикладами є біс (циклооктатетраен) уран (ураноцен\(7\)) і біс (пенталенілнікель),\(8\) (див. Розділ 22-12B):

Багато металоценових сполук проявляють незвичайні реактивності та реакції, з яких жодна не є більш вражаючою, ніж відкриття російським хіміком М.Е. Вольпіном поглинання азоту титаноценом\(\ce{(C_2H_5)_2Ti}\), щоб сформувати комплекс або комплекси, які можна легко зменшити для формування\(\ce{N_2}\) аміак. Природа цих комплексів викликає сумніви, але дуже чіткі докази були отримані Дж.Е. Берко для будови комплексу,\(9\) утвореного з декаметилцирконоцену і дизотрогену:
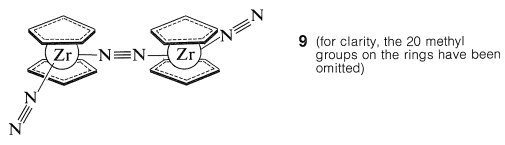
Цей комплекс, оброблений кислотами, дає\(\ce{NH_2-NH_2}\) і деякі\(\ce{NH_3}\).
\(^1\)На малюнку 6-4 видно, що залізо (0) має 8 електронів на\(3d\) орбіталах\(4s\) і. \(\left( \ce{Fe^{2+}} \right)\)Тоді чорне залізо матиме 6 електронів зовнішньої оболонки. Цей 6 плюс 12\(\pi\) електронів двох кілець циклопентадієніду робить загальну 18-електронну та електронну конфігурацію криптону.
