21.4: Синтез карбонових кислот
- Page ID
- 24104
Синтез карбонової кислоти - огляд
Атом вуглецю карбоксильної групи має високу ступінь окислення. Тому не дивно, що багато хімічних реакцій, які використовуються для їх приготування, є окисленнями. Такі реакції обговорювалися в попередніх розділах цього тексту, і наступна діаграма узагальнює більшість з них. Щоб переглянути попереднє обговорення будь-якого з цих класів реакції, просто натисніть на число (від 1 до 4) або описовий заголовок групи.
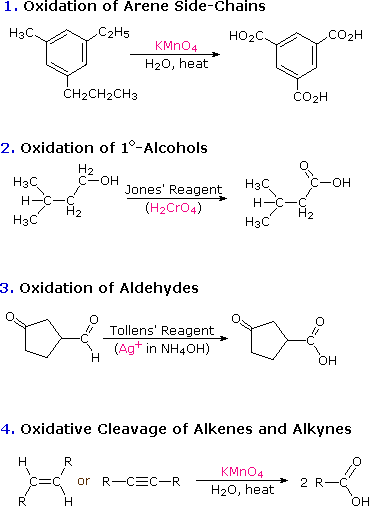
Синтез карбонової кислоти - новий
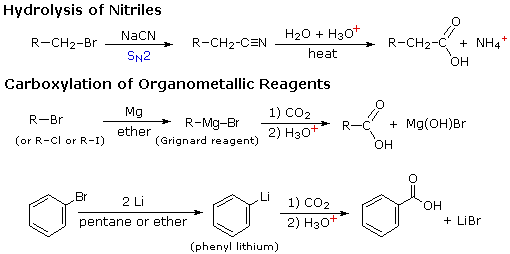
Дві інші корисні процедури для отримання карбонових кислот включають гідроліз нітрилів і карбоксилювання металоорганічних проміжних продуктів. Як показано на наступній схемі, обидва способи починаються з органічного галогенного з'єднання і карбоксильна група в кінцевому підсумку замінює галоген. Обидва методи вимагають двох етапів, але взаємодоповнюють тим, що нітрильний проміжний продукт у першій процедурі генерується реакцією S N 2, в якій аніон ціанід є нуклеофільним попередником карбоксильної групи. Гідроліз може бути як кислотним, так і базово-каталізованим, але останні дають карбоксилатну сіль в якості вихідного продукту.
У другій процедурі електрофільний галогенід спочатку перетворюється на сильно нуклеофільне похідне металу, і це додає до вуглекислого газу (електрофілу). Вихідним продуктом є сіль карбонової кислоти, яку потім необхідно вивільнити шляхом обробки сильною водною кислотою.
Існуюча карбонова кислота може бути подовжена однією метиленовою групою, використовуючи процедуру омологації, яка називається реакцією Арндта-Ейстерта. Щоб дізнатися про цей корисний метод натисніть тут.
Гідроліз похідних карбонової кислоти та нітрилів
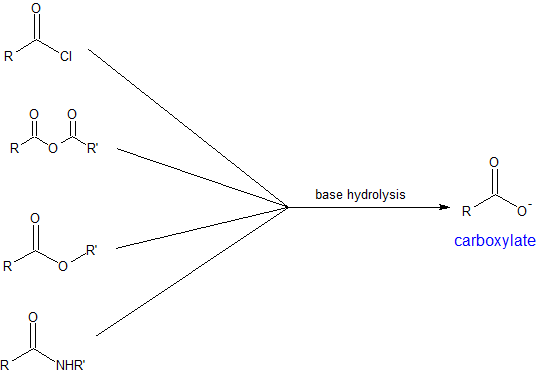
У цьому розділі ми дізнаємося, що всі похідні карбонової кислоти можуть бути синтезовані з карбонових кислот. Ці реакції, як правило, більш корисні для багатоступінчастих синтезів для побудови великих і складних молекул. Похідні карбонової кислоти разом можуть бути гідролізовані для отримання карбонових кислот. Ці реакції гідролізу мають обмежене використання в багатоступінчастому синтезі, оскільки кислий протон може бути проблематичним для багатьох органічних реакцій. Біохімічно реакції гідролізу дуже важливі в обміні їжі, ліків та інших поживних речовин. Гідроліз може відбуватися в кислих або основних умовах, що визначають іонізацію карбонової кислоти. Реакції в основних умовах потребують остаточної стадії нейтралізації з розведеним Н + для відновлення карбонової кислоти. Щоб посилити наше усвідомлення чутливості до рН карбонових кислот, обидві карти реакцій наведені нижче.
- Кислотний гідроліз похідних карбонової кислоти
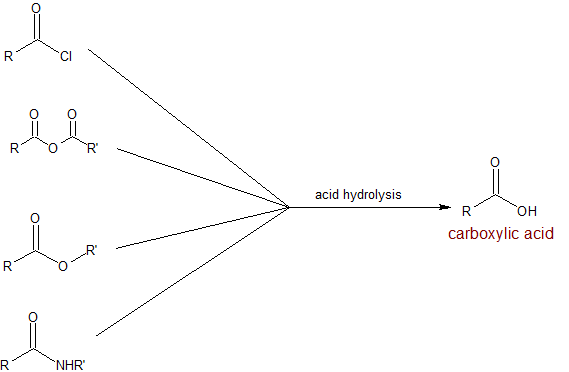
Корисна підказка: Різні професори, як правило, використовують різні джерела протонів. Корисно розпізнати реагенти за їх роль у реакції. Наприклад, H 2 SO 4, HCl, H 3 PO 4, CH 3 CO 2 H і p-tSA - все це джерела Н +. Неважливо, який з них використовується для каталізу або нейтралізації. Азотна кислота окислюється, тому вона, як правило, використовується лише в реакціях окислення. Оскільки ми продовжуємо вивчати більше реакцій/реагентів, це може допомогти групувати їх за їх реакційною здатністю: кислоти, основи, нейтральні, окислювальні, відновлювальні, пронові, апротові тощо Наприклад, пероксиди окислюються - будь то H 2 O 2 або MCPBA (м-хлоропероксибензойна кислота).
- Основний гідроліз похідних карбонової кислоти
Вправа
4. Завершіть реакції нижче.
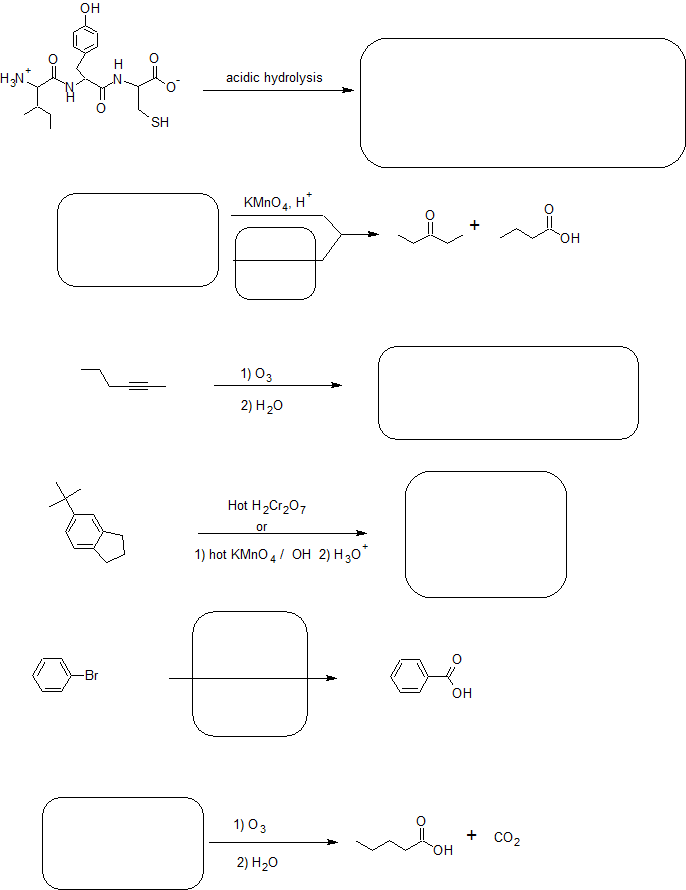
- Відповідь
-
4.
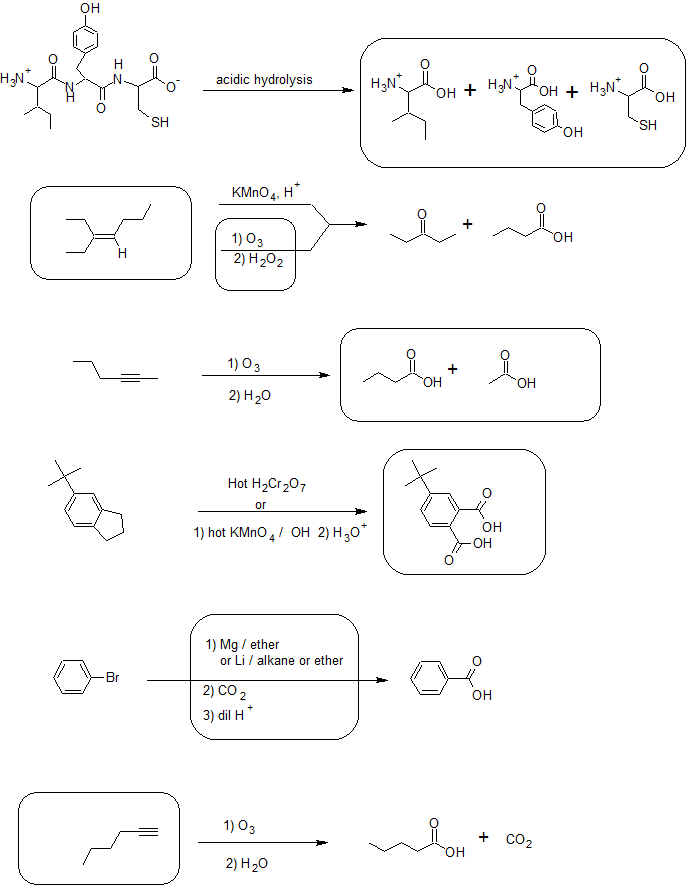
Автори та атрибуція
- Template:ContribKennepohl
- Template:ContribFarmer
- William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry