21.2: Кислотність карбонових кислот
- Page ID
- 24120
Порівняння сильних сторін слабких кислот 
Сильні сторони слабких кислот вимірюються за шкалою pK. Чим менше число на цій шкалі, тим сильніше кислота. Три сполуки, на які ми будемо розглядати, разом із їх значеннями pK a:
Пам'ятайте - чим менше РКа, тим сильніше кислота. Порівнюючи інші два з етановою кислотою, ми бачимо, що фенол дуже слабкіший з pK a 10.00, а етанол настільки слабкий з pK a приблизно 16, що навряд чи вважається кислим взагалі! РКа етанолу становить близько 17, в той час як рКа оцтової кислоти - близько 5: це 10-12-кратна різниця двох констант кислотності. В обох сполуках кислий протон пов'язаний з атомом кисню. Чим вони можуть бути такими різними за кислотністю? Почнемо з розгляду сполучених підстав.
У обох видів негативний заряд на сполученій основі утримується киснем, тому періодичні тенденції не можуть бути викликані. Для оцтової кислоти, однак, є ключова відмінність: може бути намальований резонансний внесок, в якому негативний заряд локалізується на другому кисні групи. Дві резонансні форми для сполученого підстави рівні за енергією. Це означає, що негативний заряд на ацетатному іоні розташований не на одному чи іншому кисні: скоріше він розділений між ними. Хіміки використовують термін «делокалізація заряду» для опису цієї ситуації. У етоксид-іоні, навпаки, негативний заряд «заблокований» на одному кисні — йому більше нікуди діватися.
Нагадаємо фундаментальну ідею про те, що електростатичні заряди, будь то позитивні чи негативні, є більш стабільними, коли вони «розподілені», ніж коли вони обмежені одним атомом. Тут заряд «поширюється» (іншими словами, делокалізований) резонансом, а не просто розміром задіяного атома.
Делокалізація заряду резонансом надає дуже потужний вплив на реакційну здатність органічних молекул, достатню для обліку різниці понад 12 pK одиниць між етанолом і оцтовою кислотою. Ацетатний іон набагато стабільніший, ніж етоксид-іон, все завдяки наслідкам резонансної делокалізації.
Резонансний вплив на кислотність карбонових кислот
Чому наявність карбонільної групи, прилеглої до гідроксильної групи, має надавати такий глибокий вплив на кислотність гідроксильного протона? Щоб відповісти на це питання, ми повинні повернутися до природи кислотно-лужних рівноваг та визначення pK a, проілюстрованого загальними рівняннями, наведеними нижче.
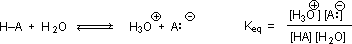
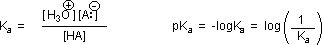
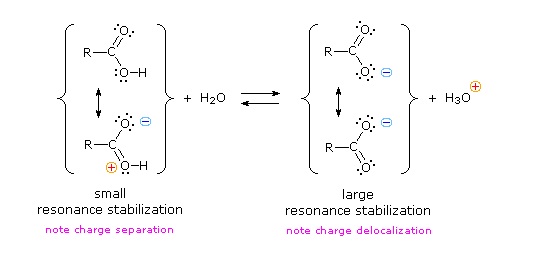
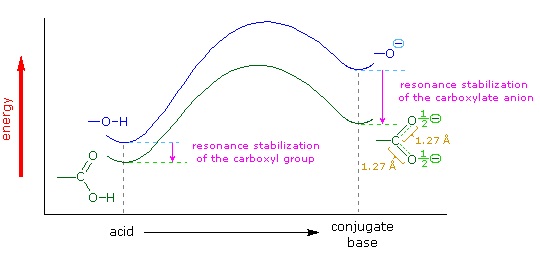
Ми знаємо, що рівновага сприяє термодинамічно більш стабільній стороні, і що величина постійної рівноваги відображає різницю енергії між компонентами кожної сторони. У рівновазі кислотної основи рівновага завжди сприяє слабшій кислоті та основи (це більш стабільні компоненти). Вода є стандартною базою, яка використовується для вимірювань pK a; отже, все, що стабілізує сполучену основу (A: (—)) кислоти обов'язково зробить цю кислоту (H—A) сильнішою і змістить рівновагу вправо. І карбоксильна група, і карбоксилатний аніон стабілізуються резонансом, але стабілізація аніону набагато більша, ніж у нейтральної функції, як показано на наступній діаграмі. У карбоксилатному аніоні дві сприяючі структури мають однакову вагу в гібриді, а зв'язки С—О мають однакову довжину (між подвійним та одиночним зв'язком). Така стабілізація призводить до помітно підвищеної кислотності, про що свідчить енергетична діаграма, що відображається натисканням кнопки «Toggle Display».
Індуктивний вплив на відносну кислотність
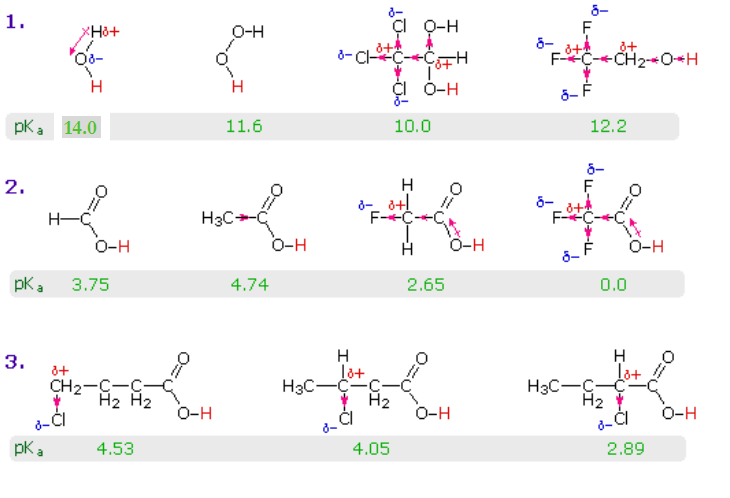
Описаний тут резонансний ефект, безсумнівно, є основним фактором виняткової кислотності карбонових кислот. Однак індуктивні ефекти також відіграють певну роль. Наприклад, спирти мають pK a з 16 або більше, але їх кислотність підвищується за рахунок відведення електронів замісників на алкільну групу. Наступна діаграма ілюструє цей фактор для декількох простих неорганічних та органічних сполук (рядок #1), і показує, як індуктивне виведення електронів може також збільшити кислотність карбонових кислот (ряди #2 & 3). Кислий водень пофарбований в червоний колір у всіх прикладах. Вода менш кисла, ніж перекис водню, оскільки водень менш електронегативний, ніж кисень, і ковалентний зв'язок, що приєднується до цих атомів, поляризується таким чином, як показано. Спирти трохи менш кислі, ніж вода, через погану електронегативність вуглецю, але хлоралгідрат, Cl 3, CCH (OH) 2, і 2,2,2, -трифторетанол значно кислотніші, ніж вода, за рахунок індуктивного відведення електронів електронегативними галогенами (і другим киснем в хлоралгідраті). У випадку з карбоновими кислотами, якщо електрофільний характер карбонільного вуглецю знижується, кислотність карбонової кислоти також знизиться. Аналогічно збільшення його електрофільності підвищить кислотність кислоти. Оцтова кислота в десять разів слабкіше кислоти, ніж мурашина (перші два записи в другому ряду), підтверджуючи електронний донорський характер алкільної групи щодо водню, як зазначалося раніше в обговоренні стабільності карбокатів. Електронегативні замісники підвищують кислотність шляхом індуктивного виведення електронів. Як і очікувалося, чим вище електронегативність замісника, тим більше збільшення кислотності (F > Cl > Br > I), і чим ближче замісник до карбоксильної групи, тим більше його ефект (ізомери в 3-му ряду). Замісники також впливають на кислотність похідних бензойної кислоти, але резонансні ефекти конкурують з індуктивними ефектами. Метоксигрупа - це донорство електронів, а нітрогрупа - відведення електронів (останні три записи в таблиці значень pK a).
Більш пильний погляд на вплив електрон-відвідних і електрондонуючих груп на стійкість кон'югатних основ можна побачити в значеннях pKA бензойної кислоти, як показано в таблиці нижче. Кон'югатна основа бензойної кислоти стабілізується електрон-відбирають групами. Це робить кислоту більш кислою
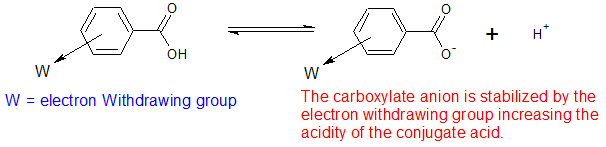
Групи, що відводять електрони, деактивують бензольне кільце до електрофільних реакцій і роблять бензойні кислоти більш кислими.
Кон'югатна основа бензойної кислоти дестабілізується електрондонуючими групами. Це робить кислоту менш кислою
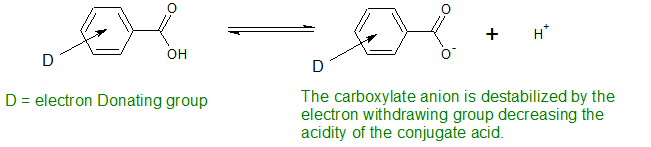
Електронно-донорські групи активують бензольне кільце до електрофільних реакцій і роблять бензойні кислоти менш кислими.
Вправа
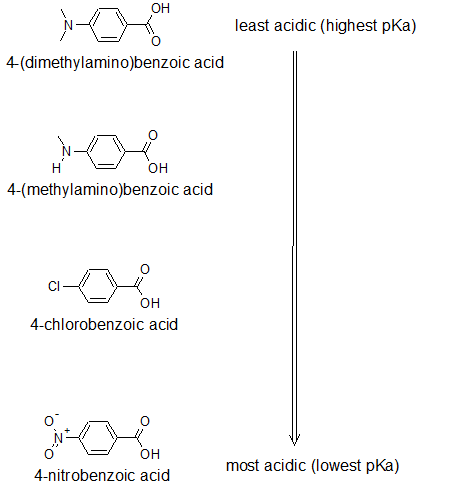
2. Намалюйте зв'язкові структури і організуйте наступні сполуки в порядку підвищення кислотності: 4-нітробензойна кислота; 4- (метиламіно) бензойна кислота; р-хлорбензойна кислота; 4- (диметиламіно) бензойна кислота.
- Відповідь
-
2.
Дописувачі та атрибуція
- Template:ContribKennepohl
- Template:ContribFarmer
- Template:ContribReusch
- Tom Neils (Grand Rapids Community College)