20.6: Реакції амінів
- Page ID
- 23112
Аміни як нуклеофіли
Аміни рідко служать покидають групи в реакціях нуклеофільної заміщення або каталізованих основою реакцій елімінації. Дійсно, вони ще менш ефективні в цій ролі, ніж гідроксильні і алкоксильні групи. Поки ми побачимо ще один розділ про те, що можна примусити амін служити групою, що відходить. Як слабкі основи аміни є хорошими нуклеофілами.
Аміни та карбоніли
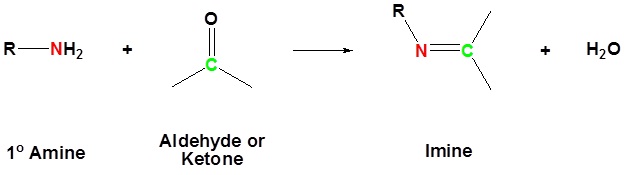
Реакція альдегідів і кетонів з аміаком або 1º-амінами утворює похідні іміну, також відомі як основи Шиффа (сполуки, що мають функцію C = N). Вода усувається в реакції, яка каталізується кислотою і оборотна в тому ж сенсі, що і ацетальне утворення. РН для реакцій, які утворюють імінові сполуки, необхідно ретельно контролювати. Швидкість, з якою утворюються ці імінові сполуки, як правило, найбільша поблизу рН 5, і падає при вищому і нижчому pH. При високому рН не буде достатньо кислоти для протонації ОН в проміжному, щоб забезпечити видалення як Н 2 О. При низькому рН більша частина амін-реагенту буде пов'язана як його амонійна кон'югатна кислота і стане ненуклеофільної.
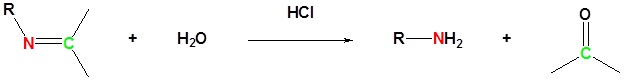
Іміноутворення оборотне. Іміни можуть бути гідролізовані назад до відповідного первинного аміну в кислих водних умовах.
Більшість альдегідів і кетонів реагують з 2º-амінами, даючи продукти, відомі як емалі.
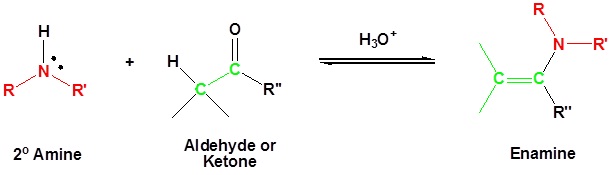
Слід зазначити, що, як і ацетальне та іміноутворення, це каталізовані кислотою оборотні реакції, при яких втрачається вода. Отже, емалі легко перетворюються назад у свої карбонільні попередники шляхом кислотно-каталізованого гідролізу.
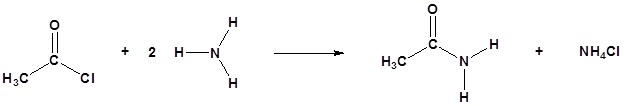
Аміни та хлориди кислот
Хлориди кислот вступають в реакцію з аміаком, 1 o амінами і 2 o амінами з утворенням амідів

| Приклади: |
|---|
|
|
Аміни та сульфонілхлорид
Сульфонільна група є сірчано-аналогом карбонільної групи. Обидві групи містять електрофільний карбонільний вуглець з хлоридом як відмінну групу, що залишає. Оскільки сірка є третім елементом оболонки, вона може утворювати «розширені октети».

Аміни реагують з сульфонільними групами з утворенням сульфаніламідів. Сульфаніламіди застосовуються як протимікробні засоби терапевтично і називаються сульфаніламідами. Реакція на утворення сульфаніламідів відбувається в лужних умовах, щоб зберегти нуклеофільний амін. Будь-який раз, коли аміни присутні у водному розчині, вимірюваний гідроксид присутній. Механізм реакції сульфонації аналогічний механізму ацилювання, як показано нижче.
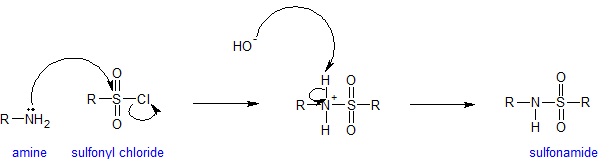
Кінець цієї глави включає деяку додаткову інформацію про сульфаніламіди.
алкіляції
Повчально досліджувати реакції заміщення азоту, використовуючи загальні алкілгалогеніди як електрофіли. Таким чином, реакція первинного алкілброміду з великим надлишком аміаку дає відповідний 1º-амін, імовірно за механізмом S N 2. Отриманий в реакції бромід водню з'єднується з деякою часткою надлишку аміаку, даючи бромід амонію в якості побічного продукту. Вода зазвичай не реагує з 1º-алкілгалогенідами, щоб дати спирти, тому чітко продемонстрована підвищена нуклеофільність азоту щодо кисню.
2 RCH 2 Br + NH 3 (великий надлишок) RCH 2 NH 2 + NH 4 (+) Br (—) RCH 2 NH 2 + NH 4 (+) Br (—) |
Звідси випливає, що прості аміни також повинні бути більш нуклеофільними, ніж їх спиртові або ефірні еквіваленти. Якщо, наприклад, ми хочемо провести реакцію S N 2 алкоголю з алкілгалогенідом для отримання ефіру (синтез Вільямсона), необхідно перетворити слабонуклеофільний спирт на його більш нуклеофільну кон'югатну основу для реакції. На відміну від цього, аміни реагують з алкілгалогенідами безпосередньо, щоб дати N-алкіліровані продукти. Оскільки ця реакція виробляє HBr як побічний продукт, також будуть утворюватися гідробромідні солі алкільованого аміну або не прореагував стартового аміну (в рівновазі).
2 РНХ 2 + С 2 Н 5 Бр РНХК 2 Н 5 + РНХ 3 (+) Бр (—) РНХК 2 Н 5 + РНХ 3 (+) Бр (—) РНХ 2 С 2 Н 5 (+) Бр (—) + РНХ 2 РНХ 2 С 2 Н 5 (+) Бр (—) + РНХ 2 |
На жаль, пряме алкілування 1º або 2º-амінів для отримання більш заміщеного продукту не відбувається чисто. Якщо використовується співвідношення аміну до алкілгалогеніду 1:1, лише 50% аміну буде реагувати, оскільки решта аміну буде зв'язана як сіль галогеніду амонію (пам'ятайте, що виробляється один еквівалент сильної кислоти HX). Якщо використовується співвідношення аміну до алкілуючого агента 2:1, як у наведеному вище рівнянні, питання HX вирішується, але виникає інша проблема. І початковий амін, і амін продукту є нуклеофілами. Отже, як тільки реакція почалася, амін продукту конкурує з вихідним матеріалом на пізніх стадіях алкілування, і також утворюються деякі вищі алкілірованние продукти. Навіть 3º-аміни можуть бути алкіліровані з утворенням четвертинних (4º) амонійних солей. Коли потрібні солі тетраалкілу амонію, як показано в наступному прикладі, основа Хюніга може бути використана для очищення HI, що утворюється в трьох реакціях S N 2. Стерична перешкода запобігає метилюванню цього 3º-аміну (основа Хюніга).
C 6 H 5 NH 2 + 3 CH 3 I + Hünig база C 6 H 5 N (CH 3) 3 (+) I (—) + HI сіль основи Хюніга
C 6 H 5 N (CH 3) 3 (+) I (—) + HI сіль основи Хюніга
Ви отримуєте складну серію реакцій на нагріванні первинних амінів галогеноалканами для отримання суміші продуктів - ймовірно, один з найбільш заплутаних наборів реакцій, які ви зустрінете на цьому рівні. До продуктів реакцій відносяться вторинні і третинні аміни і їх солі, а також солі четвертинного амонію.
Виготовлення вторинних амінів і їх солей
На першій стадії реакції ви отримуєте сіль утворюється вторинного аміну. Наприклад, якщо ви почали з етиламіну та брометану, ви отримаєте бромід діетиламмонію.

При наявності надлишку етиламіну в суміші існує ймовірність оборотної реакції. Етиламін видаляє водень з іона діетиламонію, щоб отримати вільний діетиламін - вторинний амін.

Виготовлення третинних амінів і їх солей
Але це не зупиняється на цьому! Діетиламін також вступає в реакцію з брометаном - в ті ж дві стадії, що і раніше. Тут реакція почнеться, якщо ви відреагували вторинний амін галогеноалканом.
На першому етапі ви отримуєте триетиламмонію бромід.

Знову ж таки існує можливість оборотної реакції між цією сіллю і надлишком етиламіну в суміші.

Етиламін видаляє іон водню з іона триетиламонію, щоб залишити третинний амін - триетиламін.
Виготовлення четвертинної амонійної солі
Заключний етап! Триетиламін вступає в реакцію з брометаном з отриманням броміду тетраетиламонію - четвертинної амонійної солі (тієї, в якій всі чотири водню були замінені алкільними групами).

Цього разу на азоті не залишилося водню, який потрібно видалити. Реакція тут припиняється.
Вправа
10. Намалюйте продукти наступних реакцій.

11. Намалюйте структуру реагенту, необхідного для отримання зазначеного продукту.
12. Намалюйте продукти для наступних реакцій.

13. Намалюйте відсутній реагент, щоб завершити кожну реакцію нижче.

Відповідь
-
10.
11.

12.
13.