20.7: Реакції ариламінів
- Page ID
- 23168
Надмірна реакція аніліну
Аріламіни дуже реагують на електрофільне ароматичне заміщення. Найсильнішими активуючими та орто/пара-направляють замісниками є аміногрупи (-NH 2) та гідроксильна (-OH). Пряме нітровання фенолу (гідроксибензол) розведеною азотною кислотою дає скромні виходи нітрованих фенолів і значне окислювальне розкладання до смолистих матеріалів; анілін (амінобензол) значною мірою руйнується. Монобромінування як фенолу, так і аніліну важко контролювати, при цьому продукти ді- і трибромо утворюються легко.
Через високу нуклеофільну реакційну здатність анілін і фенол проходять реакції заміщення йодом - галогеном, який нормально не реагує з похідними бензолу. Змішаний хлорид галогену йоду (iCl) забезпечує більш електрофільний йодний фрагмент і ефективний при йодуванні ароматичних кілець, що мають менш потужні активуючі замінники.
| С 6 Н 5 —Н 2 + I 2 + НаХСО 3 |  |
р- I —С 6 Н 4 —Н 2 + Na I + СО 2 + Н 2 О |
На додаток до надмірної реактивності, ми раніше бачили, що реакції Friedel-Crafts, що використовують каталізатор AlCl 3, не працюють з аніліном. Сольовий комплекс утворює і перешкоджає електрофільному ароматичному заміщенню.
І цю проблему, і надмірну реакційну здатність аніліну можна обійти, спочатку пройшовши відповідний амід.
Модифікація впливу сильних активуючих груп
Ацетилюючи гетероатомний замінник на анілін, його активуючий вплив можна істотно послабити. Наприклад, ацетилювання аніліну дає ацетанілід (перший крок у наступному рівнянні), який піддається нітровання при низькій температурі, даючи пара-нітро продукт у високому виході. Модифікуючу ацетильну групу потім можна видалити за допомогою кислотно-каталізованого гідролізу (остання стадія), щоб отримати пара-нітроанілін. Незважаючи на те, що активуючий вплив аміногрупи було зменшено цією процедурою, похідне ацетилу залишається орто/пара-спрямовуючим і активуючим замісником.
С 6 Н 5 —Н 2 + (СН 3 СО) 2 О |
піридин (основа) |
C 6 H 5 -НХКОХ 3 |
НЕ 3, 5 ºC |
П-о 2 Н—С 6 Н 4 —НХКОЧ 3 |
H 3 O (+) & тепло |
П-о 2 Н—С 6 Н 4 —Н |
Іони діазонію та їх солі
Резонансний опис іонів діазонію показує, що позитивний заряд делокалізований над двома атомами азоту. Нуклеофіли не можуть зв'язуватися з внутрішнім азотом, але зв'язок (або зчеплення) негативних нуклеофілів з кінцевим азотом дає нейтральні азосполуки. Як показано в наступному рівнянні, це з'єднання з кінцевим азотом має бути відносно швидким і оборотним. Азопродукти можуть існувати як стереоізомери E /Z. На практиці встановлено, що Е-ізомер переважає при рівновазі.
Якщо ці азопродукти не будуть захоплені або стабілізовані певним чином, зворотний до іона діазонію та повільне нуклеофільне заміщення при вуглеці (з незворотними втратами азоту) буде кінцевим ходом реакції, як описано в попередньому розділі. Наприклад, якщо в холодний розчин гідроксиду натрію швидко додати фенілдіазонію бісуфат, виходить відносно стабільний розчин фенілдіазоату натрію (кон'югатна основа спочатку утворилася діазонової кислоти). Зниження рН цього розчину регенерує фенілдіазоєву кислоту (pK a ca. 7), яка роз'єднується назад до іона діазонії і в кінцевому підсумку піддається заміщенню, генеруючи фенол.
| С 6 Н 5 Н 2 (+) ГСО 4 (—) + NaOH (холодний розчин) |  |
С 6 Н 5 Н 2 —ОН + NaOH (холод) |  |
С 6 Н 5 Н 2 —О (—) Na (+) |
| фенілдіазонію бісульфат | фенілдіазоєва кислота | фенілдіазоат натрію |
Солі аріл-діазонію можуть бути зменшені до відповідних гідразинів м'якими відновниками, такими як бісульфіт натрію, хлорид олова або цинковий пил. Відновлення бісульфіту може протікати початковим з'єднанням сірка-азот, як показано в наступному рівнянні.
Ар-Н 2 (+) Х (—) |
АнХСО 3 |
Ар-н = Н-СО 3 Н |
АнХСО 3 |
Ар-нх-НН-Со 3 Н |
Н 2 О |
Ар-нг-нх 2 + Н 2 СО 4 |
Діазонієві солі: реакції Сандмейера
Арілдіазонієві солі є важливими проміжними продуктами. Вони готуються в холодному (від 0 º до 10 ºC) водному розчині і зазвичай вступають в реакцію з нуклеофілами з втратою азоту. Деякі з найбільш часто використовуваних реакцій заміщення показані на наступній схемі. Оскільки група виходу (N 2) термодинамічно дуже стабільна, ці реакції енергетично сприятливі. Ті реакції заміщення, які каталізуються солями міді, відомі як реакції Сандмейєра. Заміна фтору відбувається при лікуванні BF 4 (—), реакцією, відомою як реакція Шимана. Стабільні діазонієві солі тетрафторбората можуть виділятися, і при нагріванні вони втрачають азот, щоб дати арилфторидний продукт. Верхня реакція з гіпофосфорною кислотою, H 3 PO 2, примітна тим, що вона досягає відновного видалення аміногрупи (або нітро). На відміну від реакцій нуклеофільного заміщення, це скорочення, ймовірно, протікає радикальним механізмом.
Ці реакції заміщення аріл-діазонію значно розширюють тактику, доступну для синтезу полізаміщених похідних бензолу. Розглянемо наступні варіанти:
- Звичайним попередником ариламіну є відповідне нітроз'єднання. Нітрозамінник деактивує ароматичне кільце і направляє електрофільну заміну на мета-місця.
- Зниження нітрогрупи до аміну може бути досягнуто кількома способами. Отриманий замінник аміну сильно активує ароматичне кільце і направляє електрофільну заміну в орто & пара-місця.
- Активуючий характер амінзамінника може бути ослаблений утворенням похідного аміду (оборотного) або навіть змінений на деактивуючий і мета-спрямовуючий шляхом утворення четвертинно-амонійної солі (незворотної).
- Перетворення аріламіну в проміжний проміжний іон діазонію дозволяє замінити його безліччю різних груп (включаючи водень), які, в свою чергу, можуть бути використані в наступних реакціях.
Наступні приклади ілюструють деякі комбіновані застосування цих варіантів до конкретних випадків. Слід намагатися зачати правдоподібну послідовність реакції для кожного. Після того, як ви це зробите, ви можете перевірити запропоновані відповіді нижче.
- Відповідь 1:
-
Повинно бути зрозуміло, що метилзамінник з часом буде окислюватися до функції карбонової кислоти. Терміни важливі, оскільки метиловий замінник є орто/пара-направленням, а карбоксильний замінник - мета-направляючим. Ціано-група буде введена проміжним діазонієм, тому цьому кроку має передувати нітровання з подальшим зменшенням до аміну.

- Відповідь 2:
-
Гідроксильна група є сильним активуючим замінником і направляє ароматичне кільцеве хлорування до місць орто & пара до себе, що призводить до неправильного продукту. Як альтернатива, нітрогрупа є не тільки мета-направленням, вона може бути перетворена в гідроксильну групу за допомогою діазонію проміжного продукту. Отримана стратегія сама собою очевидна.

- Відповідь 3:
-
Селективне введення фтору найкраще досягається шляхом обробки проміжного діазонію аніоном тетрафториду бору. Для отримання необхідного проміжного нам потрібно зробити п-нітроанілін. Оскільки нітрозамінник на вихідному матеріалі направить новий замінник на мета-локацію, ми повинні спочатку зменшити його до орто-/пара-спрямованої аміногрупи. Аміногрупи є потужними активуючими замісниками, тому ми деактивуємо його ацетилюванням перед нітрованням. Ацетилзамінник також захищає початкову функцію аміну від реакції з азотною кислотою пізніше. Вона видаляється на останньому кроці.
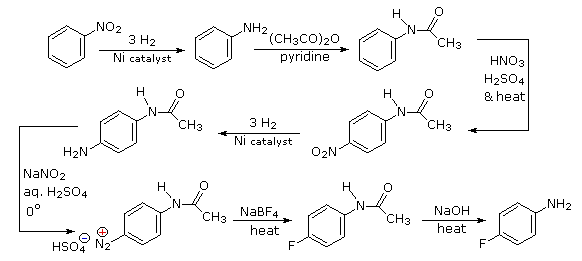
- Відповідь 4:
-
Полібромізація бензолу призведе до орто/паразаміщення. Для досягнення взаємної мета-зв'язку трьох бромів необхідно ввести потужний орто-пара-направлення до бромування, а потім видалити його після трибромізації. Для цієї мети ідеально підходить аміногрупа. Редуктивне видалення діазонієвої групи може здійснюватися декількома способами (показано три).
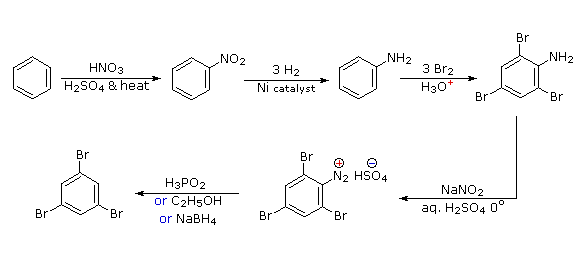
- Відповідь 5:
-
Пропілзамінник найкраще вводити шляхом ацилювання Friedel-Crafts з подальшим відновленням, і це не може бути здійснено в присутності нітрозамінника. Оскільки ациловий замінник є мета-директором, логічно використовувати цю властивість для визначення місцезнаходження нітро- і хлорогруп перед зменшенням карбонільного фрагмента. Той же метод відновлення може бути використаний для зменшення як нітрогрупи (до аміну), так і карбонільної групи до пропілу. Ми вже бачили використання проміжних продуктів діазонію як попередників фенолів.
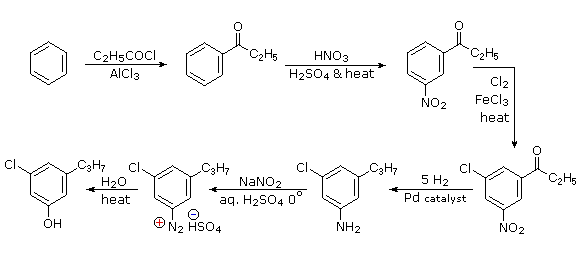
- Відповідь 6:
-
Ароматичне йодування може здійснюватися лише безпосередньо на високоактивованих сполуках бензолу, таких як анілін, або опосередковано за допомогою проміжного продукту діазонію. Знову ж таки, деактивована аміногрупа є попередником п-нітроаніліну (prb. #3). Це похідне аніліну вимагає більш електрофільного хлориду йоду (iCl) для орто-йодонування через наявність дезактивуючого нітрозамінника. Нарешті, третій йод вводиться процедурою діазоній-іонів.

Реакції заміщення іонів діазонію
Іони діазонію присутні в таких розчині, як розчин хлориду бензолдіазонію. Вони містять групу -N 2 +. У випадку з бензолдіазонію хлоридом це кріпиться до бензольного кільця. Бензендіазонію хлорид виглядає так:

У цьому наборі реакцій іона діазонію група -N 2 + замінюється чимось іншим. Азот виділяється у вигляді газу азоту.
Заміна групою -OH
Щоб отримати таку реакцію, все, що вам потрібно зробити, це підігріти розчин хлориду бензолдіазонію. Іон діазонію вступає в реакцію з водою в розчині і утворюється фенол - або в розчині, або як чорна масляниста рідина (в залежності від того, скільки утворюється). Газ азоту виділяється.
![]()

Це та сама реакція, яку ви отримуєте, якщо реагуєте феніламін з азотною кислотою в теплі. Спочатку утворюється іон діазонію, а потім відразу ж вступає в реакцію з водою в розчині, щоб дати фенол.
Заміна атомом йоду
Це хороший приклад використання солей діазонію для заміни речей у бензольне кільце, які в іншому випадку досить важко прикріпити. (Це, до речі, однаково вірно і з попередньою реакцією.) Якщо додати розчин йодиду калію в розчин бензолдіазонію хлориду на холоді, виділяється газ азоту, і утворюються маслянисті крапельки йодобензолу.
Існує проста реакція між іонами діазонію та йодидними іонами з розчину йодиду калію.
![]()

Реакції зчеплення іонів діазонію
У реакціях заміщення вище втрачається азот в іоні діазонію. В решті реакцій на цій сторінці азот затримується і використовується для створення моста між двома бензольними кільцями.
Найважливішим застосуванням реакцій діазозв'язку є електрофільне ароматичне заміщення активованих похідних бензолу електрофілами діазонію. Продукти таких реакцій - це високо забарвлені ароматичні азо сполуки, які знаходять застосування в якості синтетичних барвників, які зазвичай називають азобарвниками. Азобензол (Y = Z = H) світло-помаранчевий; однак колір інших азосполук може варіюватися від червоного до глибокого синього залежно від природи ароматичних кілець та замінників, які вони несуть. Азосполуки можуть існувати у вигляді пар цис/транс-ізомерів, але більшість добре охарактеризованих і стабільних сполук є транс.

Реакція з фенолом
Фенол розчиняють в розчині гідроксиду натрію для отримання розчину феноксиду натрію.
![]()

Розчин охолоджують в льоду, і додають холодний розчин бензолдіазонію хлориду. Відбувається реакція між іоном діазонію і феноксидним іоном і утворюється жовто-оранжевий розчин або осад. Продукт є одним з найпростіших з тих, що відомі як азосполуки, в якому два бензольних кільця з'єднані азотним містком.
![]()

Реакція з нафтален-2-ол
Нафтален-2-ол також відомий як 2-нафтол або бета-нафтол. Він містить групу -OH, прикріплену до молекули нафталіну, а не до простого бензольного кільця. Нафталін має два бензольних кільця, сплавлені між собою. Реакція проводиться в точно таких же умовах, як і з фенолом. Нафтален-2-ол розчиняють у розчині гідроксиду натрію, щоб отримати іон так само, як фенольний. Цей розчин охолоджують і змішують з розчином бензолдіазонію хлориду.
Утворюється інтенсивний оранжево-червоний осад - ще одне азоз'єднання.
![]()

Реакція з феніламіном (аніліном)
Деякий рідкий феніламін додають в холодний розчин хлориду бензолдіазонію, і суміш енергійно збовтують. Випускається тверда речовина жовтого кольору.

Ці сильно забарвлені азосполуки часто використовуються як барвники, відомі як азобарвники. Той, що виготовлений з феніламіну (аніліну), відомий як «аніліновий жовтий» (серед багатьох інших речей - див. Примітку вище). Азосполуки становлять більше половини сучасних барвників.
Застосування азобарвника в якості індикатора - метилового апельсина
Азосполуки містять сильно делокалізовану систему електронів, яка приймає як бензольні кільця, так і два атоми азоту, що з'єднують кільця. Делокалізація також може поширюватися на речі, прикріплені до бензольних кілець, а також. Якщо біле світло падає на одну з цих молекул, деякі довжини хвиль поглинаються цими делокалізованими електронами. Колір, який ви бачите, є результатом непоглинених довжин хвиль. Групи, які сприяють делокалізації (і так до поглинання світла), відомі як хромофор.
Модифікація груп, присутніх у молекулі, може впливати на поглинене світло, і так на колір, який ви бачите. Скористатися цим можна в показниках. Метиловий апельсин - це азобарвник, який існує в двох формах залежно від рН:

Коли іон водню втрачається або отримується, відбувається зсув у точному характері делокалізації в молекулі, і це спричиняє зсув довжини хвилі світла, що поглинається. Очевидно, це означає, що ви бачите інший колір. При додаванні метилового апельсина іон водню приєднується до додання червоної форми. Метиловий апельсин червоний в кислих розчинами (насправді розчини рН менше 3,1). Якщо додається луг або видаляються іони водню, то жовта форма, якщо утворюється. Метиловий оранжевий жовтий при рН більше 4,4.
Між ними, в якийсь момент буде однакова кількість червоної та жовтої форм, і тому метиловий апельсин виглядає помаранчевим.
Деякі приклади реакцій азозв'язку наведені нижче. Кілька простих правил допомагають при прогнозуванні перебігу таких реакцій:
- При кислотному рН (< 6) аміногрупа є сильнішим активуючим замісником, ніж гідроксильна група (тобто фенол). При лужному рН (> 7,5) фенольні функції є сильнішими активаторами, що обумовлено підвищеною концентрацією феноксидної основи.
- З'єднання з активованим бензольним кільцем відбувається переважно для активуючої групи, якщо це місце вільне. В іншому випадку відбудеться орто-зчеплення.
- Нафталін зазвичай піддається електрофільному заміщенню в альфа-розташуванні швидше, ніж на бета-сайтах; однак, орто-зв'язок є кращим. Див. діаграму для прикладів позначення α/β в нафталінах.
Ви повинні спробувати придумати правдоподібну структуру виробу для кожної з наступних муфт.
Вправа
14. Запропонуйте синтез для наступної сполуки за допомогою бензолу та будь-якого аміну, який вам може знадобитися.

15. Пропонується синтез для кожного з наступних сполук за допомогою бензолу.
(а) N, N -діетиланілін
(б) р -Бромоанілін
(c) -бромоанілін
(г) 2,4-діетиланілін
16. Запропонуйте синтез для кожної з наступних молекул бензолу через іон діазонію.
(а) р -хлорбензойна кислота
(б) м -хлорбензойна кислота
(c) -дихлорбензол
(г) р -етилбензойна кислота
(е) 1,2,4-трихлорбензол
Класифікують наступні спирти як первинні, вторинні або третинні.
- Відповідь
-
14.

15.
(а) 1. НІ 3, Н 2 ТАК 4; 2. Zn (Hg), HCl; 3. ETBR
(б) 1. НІ 3, Н 2 ТАК 4; 2. Zn (Hg), HCl; 3. (СН 3 СО) О 2; 4. Бр 2, Лютий 3; 5. Н 2 О, НАО
(c) 1. НІ 3, Н 2 ТАК 4; 2. Бр 2, Лютий 3; 3. Zn (Hg), HCl
(d) 1. НІ 3, Н 2 ТАК 4; 2. Zn (Hg), HCl; 3. (СН 3 СО) О 2; 4. ЕтКЛ, АлСл 35; Н 2 О, НАО
16.
(а) 1. СН 3 СН 2 Сл, АлСл 3; 2. НІ 3, Н 2 ТАК 4; 3. SnCl 2; 4. нано 2, Н 2 СО 4; 5. Кубр; 6. КМно 4, Н 2 О
(б) 1. НІ 3, Н 2 ТАК 4; 2. Сл 2, FeCl 3; 3. SnCl 2, Н 3 О +; 4. нано 2, Н 2 СО 4; 5. CuCN; 6. Н 3 О +
(c) 1. НІ 3, Н 2 ТАК 4; 2. Сл 2, FeCl 3; 3. SnCl 2; 4. нано 2, Н 2 СО 4; 5. CuCl
(d) 1. СН 3 СН 2 Кл, АлСл 3: 2. НІ 3, Н 2 ТАК 4; 3. SnCl 2; 4. нано 2, Н 2 СО 4; 5. CuCN; 6. Н 3 О +
(е) 1. НІ 3, Н 2 ТАК 4; 2. Н 2 /ВВП 2; 3. (СН 3 СО) 2 О; 4. 2 Сл 2; 5. Н 2 О, НаО; 6. нано 2, Н 2 СО 4; 7. CuCl



