13.5: Кислотність спиртів і фенолів
- Page ID
- 24091
Огляд - водні проти органічних розчинників
У водних розчині феноли слабокислі і знижують рН розчину. Гідроксид натрію може бути використаний для повного депротонації фенолу. Водорозчинні спирти не змінюють рН розчину і вважаються нейтральними. Водні розчини гідроксиду натрію НЕ можуть депротонувати спирти до досить високої концентрації, щоб бути синтетично корисними.
У розчині органічних розчинників можуть створюватися більш екстремальні умови реакції. Метал натрію може бути доданий до спирту в системі органічних розчинників, щоб повністю депротонувати спирт з утворенням іонів алкоксиду.
Кислотність спиртів
Кілька важливих хімічних реакцій спиртів, що включають O-H зв'язок або киснево-водневий зв'язок тільки і залишають вуглець-кисневий зв'язок недоторканим. Важливий приклад - солеобразование з кислотами і підставами. Спирти, як і вода, є як слабкими підставами, так і слабкими кислотами. Постійна іонізації кислоти (Ка) етанолу становить близько 10 ~ 18, трохи менше, ніж у води. Етанол може бути перетворений на його кон'югатну основу за допомогою кон'югатної основи слабшої кислоти, такої як аміак {Ka - 10 ~ 35), або водень (Ka ~ 10-38). Зручно використовувати метал натрію або гідрид натрію, які енергійно, але контрольно реагують зі спиртами:
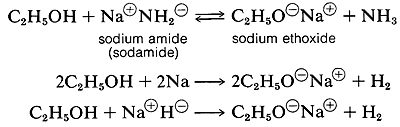
Порядок кислотності різних рідких спиртів, як правило, є вода> первинний> вторинний> третинний ROH. Під цим ми маємо на увазі, що положення рівноваги для реакції перенесення протонів лежить більше на стороні ROH, оскільки R змінюється з первинного на вторинний на третинний; тому трет-бутиловий спирт вважається менш кислим, ніж етанол:
\[ ROH + OH^- \rightleftharpoons RO^- + HOH\]
However, in the gas phase the order of acidity is reversed, and the equilibrium position for lies increasingly on the side of the alkoxide as R is changed from primary to secondary to tertiary, tert-butyl alcohol is therefore more acidic than ethanol in the gas phase. This seeming contradiction appears more reasonable when one considers what effect solvation (or the lack of it) has on equilibria. In solution, the larger alkoxide ions, probably are less well solvated than the smaller ions, because fewer solvent molecules can be accommodated around the negatively charged oxygen in the larger ions:
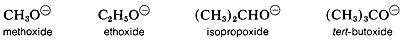
Кислотність спиртів, отже, зменшується у міру збільшення розміру сполученого підстави. Однак «голі» газоподібні іони більш стабільні, чим більші асоційовані групи R, ймовірно, тому, що більші групи R можуть стабілізувати заряд на атомі кисню краще, ніж менші групи R. Вони роблять це поляризацією своїх зв'язкових електронів, і чим більша група, тим вона більш поляризована.
Основність спиртів
Спирти є основами, схожими за силою з водою і приймають протони з сильних кислот. Прикладом може служити реакція метанолу з бромідом водню для отримання метілоксонію броміду, який є аналогом утворення броміду гідроксонію з бромідом водню і водою:
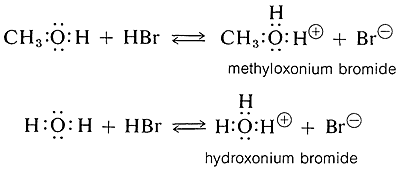
Кислотність фенолу
Такі сполуки, як спирти та фенол, які містять групу -OH, приєднану до вуглеводню, є дуже слабкими кислотами. Спирти настільки слабокислі, що для звичайних лабораторних цілей їх кислотність можна практично не враховувати. Однак фенол досить кислий, щоб він мав впізнавано кислотні властивості - навіть якщо це все ще дуже слабка кислота. Іон водню може відірватися від групи -OH і перейти на основу. Наприклад, в розчині у воді:

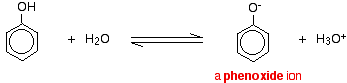
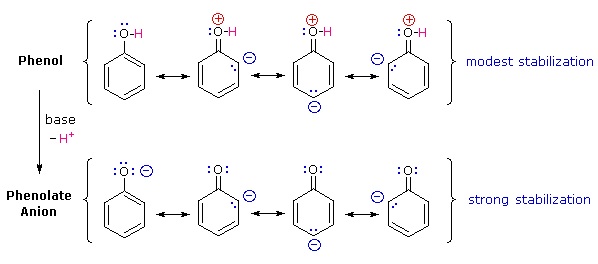
Фенол - дуже слабка кислота і положення рівноваги лежить добре зліва. Фенол може втратити іон водню, оскільки утворений феноксидний іон певною мірою стабілізується. Негативний заряд на атомі кисню делокалізується навколо кільця. Чим стабільніше іон, тим більша ймовірність його утворення. Одна з одиноких пар на атомі кисню перекривається з делокалізованими електронами на бензольному кільці.
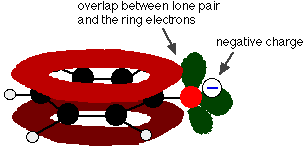
Це перекриття призводить до делокалізації, яка простягається від кільця назовні над атомом кисню. В результаті негативний заряд вже не повністю локалізується на кисні, а поширюється навколо всього іона.
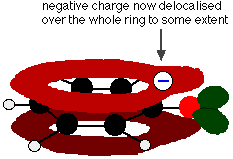
Поширення заряду навколо робить іон більш стійким, ніж було б, якби весь заряд залишився на кисні. Однак кисень є найбільш електронегативним елементом в іоні, і делокалізовані електрони будуть тягнутися до нього. Це означає, що навколо кисню все ще буде багато заряду, який, як правило, знову приверне іон водню. Саме тому фенол є лише дуже слабкою кислотою.
Чому фенол набагато сильніша кислота, ніж циклогексанол? Щоб відповісти на це питання, ми повинні оцінити спосіб взаємодії кисневого замінника з бензольним кільцем. Як зазначалося в нашому попередньому лікуванні електрофільних ароматичних реакцій заміщення, кисневий замінник підсилює реактивність кільця і сприяє електрофільній атаці на орто- і пара-сайтах. Було запропоновано, що резонансна делокалізація незв'язаної електронної пари кисню в піелектронну систему ароматичного кільця відповідає за цей ефект замісника. Подібний набір резонансних структур для кон'югатної основи фенолатних аніонів з'являється нижче фенольних структур.
Резонансна стабілізація в цих двох випадках сильно відрізняється. Важливим принципом резонансу є те, що поділ заряду зменшує важливість канонічних учасників резонансного гібриду і зменшує загальну стабілізацію. Сприяють структурам фенольного гібриду все зазнають поділу заряду, що призводить до дуже скромної стабілізації цієї сполуки. З іншого боку, фенолатний аніон вже заряджений, і канонічні вкладники діють на розсіювання заряду, що призводить до значної стабілізації цього виду. Кон'югатні основи простих спиртів не стабілізуються делокалізацією шихти, тому кислотність цих сполук аналогічна кислотності води. Праворуч показана енергетична діаграма, що показує вплив резонансу на циклогексанол та фенольну кислотність. Оскільки резонансна стабілізація фенолатного кон'югатного підстави набагато більше, ніж стабілізація самого фенолу, кислотність фенолу щодо циклогексанолу підвищується. Підтверджуючі докази того, що фенолатний негативний заряд делокалізований на орто- і паравуглеці бензольного кільця, походять від впливу електронів замісників на цих ділянках.

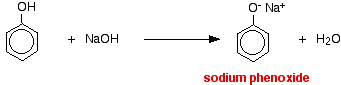
У цій реакції іон водню був видалений сильно основним іоном гідроксиду в розчині гідроксиду натрію.
Кислоти вступають в реакцію з більш реактивними металами, даючи водневий газ. Фенол не виняток - єдина відмінність полягає в повільній реакції, оскільки фенол є такою слабкою кислотою. Фенол підігрівають в сухій пробірці до розплавлення, і додають невеликий шматочок натрію. Існує деяка фіззірованість, коли виділяється водневий газ. Суміш, що залишилася в пробірці, буде містити феноксид натрію.

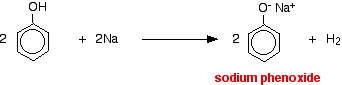
Кислотність заміщених фенолів
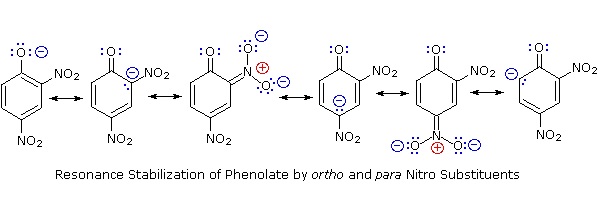
Заміна атома гідроксильного водню ще більш легка фенолами, які приблизно в мільйон разів більш кислі, ніж еквівалентні спирти. Ця фенольна кислотність додатково посилюється за рахунок відведення електронів замісників орто і пара до гідроксильної групи, як показано на наступній діаграмі. Спиртовий циклогексанол показаний для довідки вгорі ліворуч. Примітно, що вплив нітрозамісника в паралокаціі більш ніж в десять разів сильніше, ніж мета, незважаючи на те, що останнє положення ближче до гідроксильної групі. Крім того, додаткові нітрогрупи мають адитивний вплив, якщо вони розташовані в орто- або парних місцях. З'єднання тринітро, показане внизу праворуч, є дуже сильною кислотою, яка називається пікриновою кислотою.
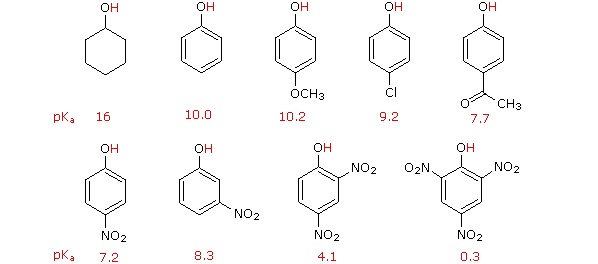
Порівняння кислотності спиртів з фенолами
Чому фенол набагато сильніша кислота, ніж циклогексанол? Щоб відповісти на це питання, ми повинні оцінити спосіб взаємодії кисневого замінника з бензольним кільцем. Як зазначалося в нашому попередньому лікуванні електрофільних ароматичних реакцій заміщення, кисневий замінник підсилює реактивність кільця і сприяє електрофільній атаці на орто- і пара-сайтах. Було запропоновано, що резонансна делокалізація незв'язаної електронної пари кисню в піелектронну систему ароматичного кільця відповідає за цей ефект замісника. Формули, що ілюструють цю електронну делокалізацію, будуть відображатися при натисканні кнопки «Резонансні структури» під попередньою діаграмою. Подібний набір резонансних структур для кон'югатної основи фенолатних аніонів з'являється нижче фенольних структур.
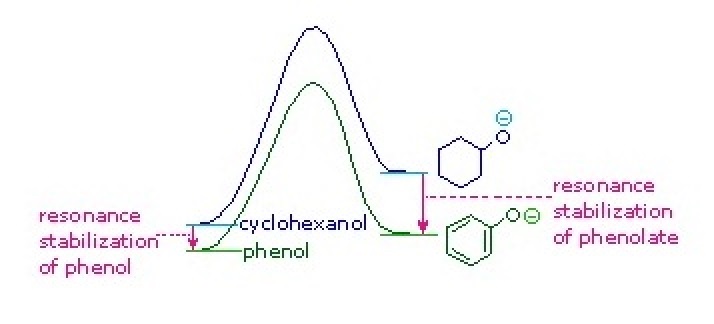
Резонансна стабілізація в цих двох випадках сильно відрізняється. Важливим принципом резонансу є те, що поділ заряду зменшує важливість канонічних учасників резонансного гібриду і зменшує загальну стабілізацію. Сприяють структурам фенольного гібриду все зазнають поділу заряду, що призводить до дуже скромної стабілізації цієї сполуки. З іншого боку, фенолатний аніон вже заряджений, і канонічні вкладники діють на розсіювання заряду, що призводить до значної стабілізації цього виду. Кон'югатні основи простих спиртів не стабілізуються делокалізацією шихти, тому кислотність цих сполук аналогічна кислотності води. Праворуч показана енергетична діаграма, що показує вплив резонансу на циклогексанол та фенольну кислотність. Оскільки резонансна стабілізація фенолатного кон'югатного підстави набагато більше, ніж стабілізація самого фенолу, кислотність фенолу щодо циклогексанолу підвищується. Підтверджуючі докази того, що фенолатний негативний заряд делокалізований на орто- і паравуглеці бензольного кільця, походять від впливу електронів замісників на цих ділянках.
Вправа
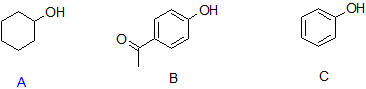
9. Розставте наступні сполуки в порядку зниження кислотності, коли вони знаходяться в розчині.
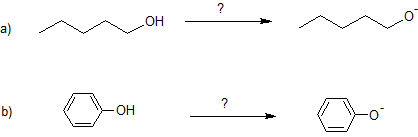
10. Вкажіть базу, необхідну для депротонації кожного реагенту.
- Відповідь
-
9. Б > С > А
10. а) Na або Nah або NH 2
б) NaOH або КОН або LiOH
Дописувачі