13.4: Спектроскопія спиртів
- Page ID
- 24126
Інфрачервона спектроскопія
Якщо ви подивитеся на ІК-спектр 1-бутанолу, то побачите:
- є сп 3 С-Н розтягування і СН 2 режими згинання при 2900 і 1500 см -1.
- є сильний режим розтягування C-O близько 1000 см -1.
- є дуже великий пік близько 3400 см -1. Піки O-H, як правило, дуже широкі, як цей.
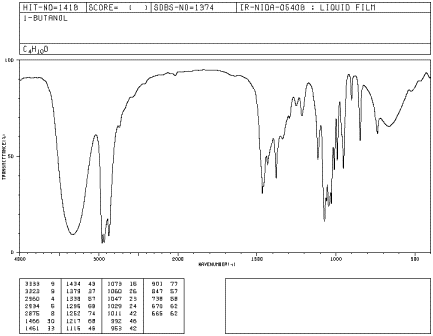
Пікові форми іноді дуже корисні для визнання того, який вид зв'язку присутній. Закруглена форма більшості режимів розтягування O-H виникає через водневого зв'язку між різними гідроксигрупами. Оскільки протони в тій чи іншій мірі діляться з сусідніми киснями, ковалентні O-H зв'язки у зразку спирту вібрують на дещо різних частотах і виявляються в дещо різних положеннях в ІЧ-спектрі. Замість того, щоб побачити один гострий пік, ви бачите цілу кількість їх усіх розмазані в одну широку пляму. Оскільки C-H зв'язки не дуже добре водневі зв'язки, ви не бачите цього явища в ефірі, а пік O-H дуже легко відрізнити в ІЧ-спектрі.
Спектроскопія ядерного магнітного резонансу
Спирти 
Де знаходиться пік -O-H? Це дуже заплутано! Різні джерела цитують абсолютно різні хімічні зрушення для атома водню в групі -ОН у спиртах - часто непослідовно. Наприклад:
- Книга даних Наффілда цитує 2.0 - 4.0, але текстова книга Наффілда показує пік приблизно 5,4.
- Лист даних OCR для використання в своїх іспитах цитує 3.5 - 5.5.
- Надійний рівень рівня органічної хімії підручник цитує 1.0 - 5.0, але потім показує спектр ЯМР для етанолу з піком приблизно 6,1.
- База даних SDBS (використовується на цьому сайті) дає пік -OH в етанолі приблизно 2.6.
Проблема, здається, полягає в тому, що положення піку -OH різко змінюється в залежності від умов - наприклад, який розчинник використовується, концентрації та чистоти спирту - особливо від того, чи є він повністю сухим.
Розумний спосіб вибору піку -OH 
Якщо виміряти спектр ЯМР для алкоголю, як етанол, а потім додати кілька крапель окису дейтерію, D 2 O, до розчину, дозволити йому осісти, а потім повторно виміряти спектр, пік -OH зникає! Порівнюючи два спектри, можна відразу сказати, який пік був обумовлений групою -OH.
Причина втрати піку криється у взаємодії між оксидом дейтерію і спиртом. Всі спирти, такі як етанол, дуже і дуже слабокислі. Водень на групі -ОН переходить в одну з одиноких пар на кисень молекули води. Той факт, що тут у нас є «важка вода», не має ніякого значення.
Утворений негативний іон, швидше за все, зіткнеться з простою молекулою оксиду дейтерію для регенерації алкоголю - за винятком того, що зараз група -OH перетворилася на групу -OD.
Атоми дейтерію не виробляють піків у тій же області спектра ЯМР, що і звичайні атоми водню, і тому пік зникає. Ви можете задатися питанням, що відбувається з позитивним іоном в першому рівнянні, а ОД - у другому. Вони втрачаються в нормальній рівновазі, яка існує скрізь, де у вас є молекули води - важкі чи інші.
\[2D_2O \rightleftharpoons D_3O^+ + OH^-\]
Відсутність розщеплення з -OH групами 
Якщо алкоголь не є абсолютно вільним від будь-якої води, водень групи -OH та будь-які водні гени на сусідньому вуглеці не взаємодіють, щоб виробляти розщеплення. Пік -OH - це синглет, і вам не доведеться турбуватися про його вплив на сусідні водороді.
Ліве скупчення піків обумовлено групою СН 2. Це квартет через 3 водню на сусідній групі CH 3. Можна ігнорувати вплив водню -ОН. Аналогічно, пік -OH в середині спектра є синглет. Він не перетворився на триплет через вплив групи СН 2.
Шаблони фрагментації масових спектрів 
Фрагментація молекулярних іонів в асортимент фрагментних іонів є змішаним благословенням. Характер фрагментів часто дає підказку до молекулярної структури, але якщо молекулярний іон має термін служби менше декількох мікросекунд, він не витримає достатньо довго, щоб його спостерігали. Без молекулярного іонного піку як еталонного, складність інтерпретації масового спектру помітно зростає. На щастя, більшість органічних сполук дають масові спектри, які включають молекулярний іон, і ті, які не часто успішно реагують на використання більш м'яких умов іонізації. Серед простих органічних сполук найбільш стабільними молекулярними іонами є ті з ароматичних кілець, інших кон'югованих пі-електронних систем та циклоалканів. Спирти, ефіри та сильно розгалужені алкани, як правило, демонструють найбільшу тенденцію до фрагментації.
Наявність функціональної групи, особливо тієї, що має гетероатом Y з незв'язними валентними електронами (Y = N, O, S, X тощо), може різко змінити картину фрагментації сполуки. Вважається, що цей вплив відбувається через «локалізацію» радикального катіонного компонента молекулярного іона на гетероатомі. Адже легше видалити (іонізувати) незв'язний електрон, ніж той, який входить до складу ковалентного зв'язку. Локалізуючи реактивний фрагмент, будуть сприяти певним процесам фрагментації. Вони узагальнені на наступній схемі, де зелений затінений ящик вгорі відображає приклади таких «локалізованих» молекулярних іонів. Перші два шляхи фрагментації призводять до парно-електронних іонів, а елімінація (шлях #3) дає непарно-електронний іон. Зверніть увагу на використання різних криволінійних стрілок, щоб показати зсуви одиночних електронів порівняно зі зміщеннями електронних пар.
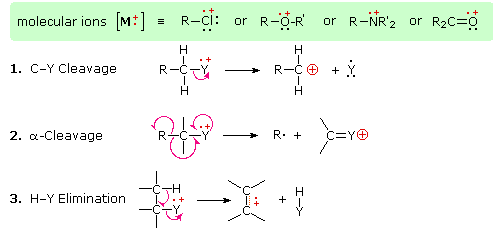
3-Пентанол показує три значущих фрагментних іона. Альфа-фрагментація (втрата етилового радикала) утворює базовий пік m/z = 59. Втрата води від цього дає фрагмент m/z=41, а втрата етена з m/z=59 дає фрагмент m/z=31.
Вправа
6. З аналізу мас-спектроскопії було визначено, що сполука має загальну формулу C 5 H 12 O. Враховуючи наступний спектр ЯМР 1 Н, намалюйте структуру. Значення інтеграції кожної групи сигналів наведено на спектрі.
7. Враховуючи, що спирти відносно кислі, а протони переносяться у розчині, що б ви очікували, що станеться зі спектром ЯМР, якби D 2 O використовувався як розчинник.
8. З аналізу мас-спектроскопії було визначено, що сполука має загальну формулу C3H 8 O. Враховуючи наступний спектр ЯМР 1 Н, намалюйте структуру. Значення інтеграції кожної групи сигналів наведено на спектрі.
- Відповідь
-
6.

7.
Очікується, що інтенсивність сигналу протона алкоголю в ЯМР 1 Н зменшиться і, ймовірно, зникне. Це пов'язано з тим, що ЯМР може досліджувати тільки спінові зміни ядер з непарною кількістю протонів.
8.
1-пропанол
