13.3: Фізичні властивості спиртів
- Page ID
- 24127
Точки кипіння
На наведеній нижче діаграмі показані температури кипіння наступних простих первинних спиртів з до 4 атомів вуглецю:
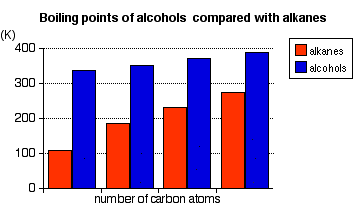
Ці точки кипіння порівнюються з показниками еквівалентних алканів (метану до бутану) з однаковою кількістю атомів вуглецю.
Зверніть увагу, що:
- Точки кипіння спиртів збільшуються зі збільшенням кількості атомів вуглецю.
Візерунки в точці кипіння відображають закономірності в міжмолекулярних атракціоні.
водневе зв'язування
Водень зв'язок відбувається між молекулами, в яких атом водню прикріплений до сильно електронегативного елементу: фтору, кисню або азоту. У випадку зі спиртами водневі зв'язки виникають між частково-позитивними атомами водню і одинокими парами на атомах кисню інших молекул.
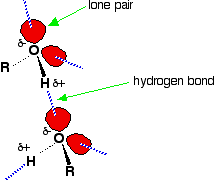
Атоми водню трохи позитивні, оскільки зв'язкові електрони тягнуться до самих електронегативних атомів кисню. У алканах єдиними міжмолекулярними силами є сили дисперсії ван дер Ваальса. Водневі зв'язки набагато міцніші, ніж ці, і тому для поділу молекул алкоголю потрібно більше енергії, ніж для поділу молекул алкану. Це основна причина підвищення температури кипіння в спиртах.
Ефект ван дер Ваальса
- Порівняння між алканами та спиртами: Навіть без будь-яких водневих зв'язків або дипольно-дипольних взаємодій температура кипіння спирту була б вищою, ніж відповідний алкан з такою ж кількістю атомів вуглецю.
Порівняйте етан і етанол:
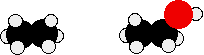
Етанол - більш довга молекула, а атом кисню приносить з собою зайві 8 електронів. Обидва вони збільшують розмір сил дисперсії ван дер Ваальса, а згодом і температуру кипіння. Більш точним вимірюванням впливу водневого зв'язку на температуру кипіння було б порівняння етанолу з пропаном, а не етаном. Довжини двох молекул більш схожі, а кількість електронів точно таке ж.
Розчинність спиртів у воді
Дрібні спирти повністю розчиняються у воді; змішування двох в будь-якій пропорції утворює єдиний розчин. Однак розчинність зменшується в міру збільшення довжини вуглеводневого ланцюга в спирті. При чотирьох атомах вуглецю і за його межами помітно зниження розчинності; двошарова речовина може з'явитися в пробірці при змішуванні двох.
Розглянемо етанол як типовий дрібний алкоголь. Як у чистій воді, так і в чистому етанолі основними міжмолекулярними пам'ятками є водневі зв'язки.
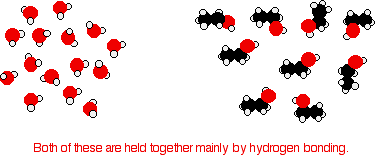
Для того, щоб змішати їх, водневі зв'язки між молекулами води та водневими зв'язками між молекулами етанолу повинні бути порушені. Для обох цих процесів потрібна енергія. Однак при змішуванні молекул між молекулами води та молекулами етанолу утворюються нові водневі зв'язки.
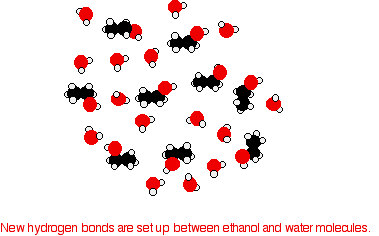
Енергія, що виділяється при утворенні цих нових водневих зв'язків, приблизно компенсує енергію, необхідну для розриву початкових взаємодій. Крім того, відзначається посилення розладу системи, збільшення ентропії. Це ще один фактор при вирішенні питання про те, чи відбуваються хімічні процеси. Розглянемо гіпотетичну ситуацію, пов'язану з 5-ю молекулами вуглецевого спирту.
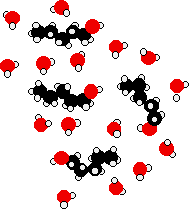
Вуглеводневі ланцюги змушені між молекулами води, розриваючи водневі зв'язки між цими молекулами води. -OH кінці молекул спирту можуть утворювати нові водневі зв'язки з молекулами води, але вуглеводневий «хвіст» не утворює водневих зв'язків. Це означає, що багато оригінальних водневих зв'язків, які розриваються, ніколи не замінюються новими.
Замість цих оригінальних водневих зв'язків є лише сили дисперсії ван дер Ваальса між водою і вуглеводневими «хвостами». Ці атракціони набагато слабкіше, і не в змозі надати достатньо енергії, щоб компенсувати розірвані водневі зв'язки. Навіть допускаючи збільшення розладу, процес стає менш здійсненним. Зі збільшенням довжини спирту така ситуація стає більш вираженою, і таким чином зменшується розчинність.
Вправа
Використовуйте 1-октанол і етанол, показані нижче, щоб відповісти на наступні питання.
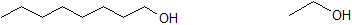
3. Яка сполука більш розчинна у воді?
4. Яке з'єднання має найвищу температуру кипіння?
5. Поясніть, чому відповіді вище не конфліктують, використовуючи ваше розуміння міжмолекулярних сил, відносних точок кипіння та розчинності.
- Відповідь
-
3. етанол
4. октанол
5. Хоча обидві сполуки проявляють H-зв'язування, менший, гідрофобний вуглецевий ланцюг етанолу призводить до вищої розчинності у воді етанолу, тоді як довший вуглецевий ланцюг октанолу збільшує площу поверхні, що призводить до більш високої температури кипіння.