9.13: Дигідроксилювання алкенів
- Page ID
- 22944
Мета навчання
- прогнозувати продукти/вказати реагенти для дигідроксилювання алкенів
дигідроксилювання алкенів
Алкени можуть дигідроксилюватися двома різними стереохімічними шляхами: анти-дигідроксилювання або син-дигідроксилювання. Відкриття епоксидів слід за механізмом антигідроксилювання, тоді як перманганат калію або тетроксид осмію виробляють синдігідроксилірованние продукти. Реакція третроксиду осмію також може відбуватися двоетапним процесом: 1) OSO 4 в піридині, а потім 2) H 2 S або NaHSO 3. Важливо відзначити, що різні професори підкреслюватимуть різні системи реагентів для досягнення тієї ж хімічної реакції. У цих ситуаціях може бути корисно визнати роль кожного реагенту для розрізнення закономірностей.
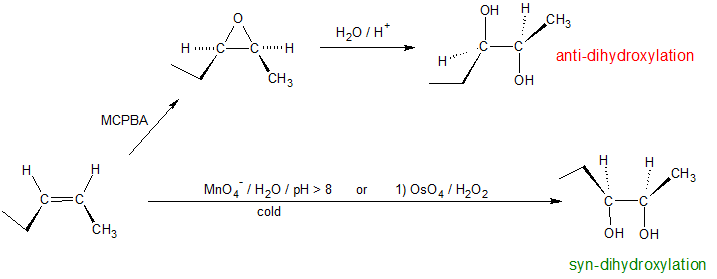
Анти дигідроксилювання
Епоксиди можуть бути розщеплені водною кислотою, щоб дати гліколі, які часто є діастереомерними, з тими, які отримують реакцією сингідроксилювання, описаною вище. Перенесення протонів з кислотного каталізатора генерує кон'югатну кислоту епоксиду, яку атакують нуклеофіли, такі як вода, так само, як циклічний іон бромонію, описаний вище, зазнає реакції. Результатом є антигідроксилювання подвійного зв'язку, на відміну від синстереоселективності більш раннього методу. У наступному рівнянні ця процедура проілюстрована для цис-дизаміщеного епоксиду, який, звичайно, можна було б отримати з відповідного цис-алкена. Ця гідратація епоксиду не змінює ступінь окислення будь-яких атомів або груп. Механізм кільцевого розкриття епоксидів залежить від умов реакції і більш детально розглядається в наступному розділі цієї глави.
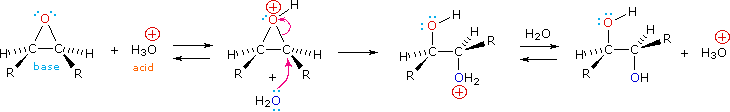
Синій дигідроксилювання
Тетроксид осмію окислює алкени, даючи гліколі через додавання синів. Гліколь, також відомий як віцинальний діол, являє собою з'єднання з двома -OH групами на сусідніх вуглецях.

Дигідроксилірованние продукти (гліколі) отримують шляхом реакції з водним перманганатом калію (рН > 8) або тетроксидом осмію в розчині піридину. Обидві реакції протікають за одним і тим же механізмом (показано нижче); металоциклічний проміжний продукт може бути виділений в реакції осмію. У базовому розчині фіолетовий перманганат аніон зменшується до зеленого іона манганату, забезпечуючи приємний кольоровий тест для функціональної групи подвійних зв'язків. Від показаного тут механізму ми очікуємо синтестереоселективності у зв'язку з киснем, і регіоселективність не є проблемою.
Якщо розглядати в контексті з раніше обговорюваними реакціями додавання, реакція гідроксилювання може здатися неправдоподібною. Перманганат і тетроксид осмію мають схожі конфігурації, при яких атом металу займає центр чотиригранної угруповання негативно заряджених атомів кисню. Як же тоді такий вид взаємодіяв би з нуклеофільними пі-електронами подвійного зв'язку? Можливе пояснення полягає в тому, що порожня d-орбіталь електрофільного атома металу виходить далеко за межі навколишніх атомів кисню і ініціює перенесення електронів від подвійного зв'язку до металу, майже таким же способом, зазначеним вище для платини. Зворотне зв'язування нуклеофільних кисню з антитілінгом π*-орбіталі завершує цю взаємодію. Результатом є формування металоциклічного проміжного продукту, як показано вище.
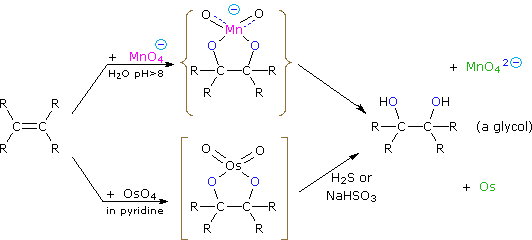
Реакція з\(OsO_4\) - це узгоджений процес, який має циклічний проміжний і ніяких перестановок. Vicinal син дигідроксилювання доповнює послідовність епоксид-гідролізу, яка являє собою анти дигідроксилювання алкену. Коли алкен реагує з тетроксидом осмію, в продукті гліколю можуть утворюватися стереоцентри. Цис-алкени дають мезопродукти, а транс-алкени дають рацемічні суміші.

\(OsO_4\)утворюється повільно, коли порошок осмію реагує з газами\(O_2\) при температурі навколишнього середовища. Реакція сипучих твердих речовин вимагає нагрівання до 400 °С:
\[Os_{(s)} + 2O_{2\;(g)} \rightarrow OS_4\]
Оскільки тетроксид осмію дорогий і високотоксичний, реакція з алкенами була модифікована. Каталітичні кількості OSO 4 та стехіометричні кількості окислювача, такого як перекис водню, тепер використовуються для усунення деяких небезпек. Також більш старим реагентом, який використовувався замість OSO 4, був перманганат калію,\(KMnO_4\). Хоча син-діоли будуть результатом реакції KMnO 4 і алкену, перманганат калію менш корисний, оскільки дає погані врожаї продукту через надмірне окислення.
Хімічна підсвічування
Протипухлинні препарати були сформовані за допомогою дигідроксилювання. Цей метод був застосований до енантіоселективного синтезу оваліцину, який є класом грибкових продуктів, що називаються антиангіогенезними агентами. Ці протипухлинні продукти можуть перекрити кровопостачання солідних пухлин. Похідне оваліцину TNP-470 є хімічно стабільним, нетоксичним і незапальним. TNP-470 був використаний у дослідженнях для визначення його ефективності при лікуванні раку молочної залози, мозку, шийки матки, печінки та передміхурової залози.
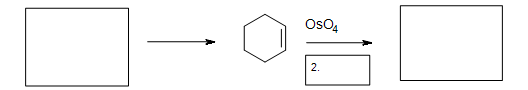
Вправа
1. Дайте основний продукт.
.bmp)
2. Що таке продукт в дигідроксилюванні (Z) -3-гексену?

3. Що таке продукт в дигідроксилюванні (Е) -3-гексену?

4. Намалюйте проміжну частину цієї реакції.
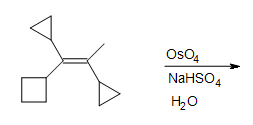
5. Заповніть відсутні реагенти, реагенти та продукт.
- Відповідь
-
1. Утворюється син-1,2-етандіол. У цій конкретній реакції немає стереоцентру. Групи OH знаходяться на одній стороні.

2. Утворюється мезо-3,4-гександіол. У цій реакції є 2 стереоцентру.
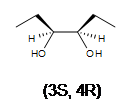
3. Утворюється рацемическая суміш 3,4-гександіолу. Є 2 стереоцентру в обох продуктах.

4. Утворюється циклічний космічний ефір.

5. Реакція циклоприєднання Дільса-Альдера необхідна в першій коробці для утворення циклогексену. Друга коробка потребує реагенту для зменшення проміжного циклічного ефіру (не показано). Третя коробка має продукт: 1,2-циклогександіол.

Посилання
- Дехестані, Ахмад та ін. (2005). Ліганд-відновлення тетроксиду осмію молекулярним воднем за допомогою механізму [3+2]. Журнал Американського хімічного товариства, 2005, 127 (10), 3423-3432.
- Соррелл, Томас, Н. Органічна хімія. Нью-Йорк: Університетські наукові книги, 2006.
- Волльхардт, Пітер і Ніл Е. Шоре. Органічна хімія: структура та функції. 5-е видання. Нью-Йорк: Фрімен та компанія WH, 2007.
Дописувачі та атрибуція
- Шивам Нанд