1.15: Молекулярні формули та емпіричні формули (огляд)
- Page ID
- 22817
Мета навчання
- Визначте електронну емпіричну і молекулярну формули за даними горіння
Молекулярні формули говорять вам, скільки атомів кожного елемента знаходиться в сполуці, а емпіричні формули говорять вам про найпростішому або найбільш зниженому співвідношенні елементів у сполуці. Якщо молекулярна формула сполуки більше не може бути зменшена, то емпірична формула така ж, як і молекулярна формула. Аналіз горіння може визначити емпіричну формулу сполуки, але не може визначити молекулярну формулу (інші методи можуть, хоча). Після того, як відомо, молекулярну формулу можна обчислити за емпіричною формулою.
Емпіричні формули
Емпірична формула говорить нам про відносні співвідношення різних атомів у сполуці. Співвідношення тримаються вірно і на молярному рівні. Таким чином, Н 2 О складається з двох атомів водню і 1 атома кисню. Так само 1,0 моль H 2 O складається з 2,0 моль водню і 1,0 моль кисню. Ми також можемо працювати назад від молярних співвідношень, оскільки якщо ми знаємо молярні кількості кожного елемента в сполуці, ми можемо визначити емпіричну формулу.
Приклад\(\PageIndex{1}\): Mercury Chloride
Ртуть утворює з'єднання з хлором, яке становить 73,9% ртуті і 26,1% хлору по масі. Що таке емпірична формула?
Скажімо, у нас був 100-грамовий зразок цієї сполуки. Тому зразок містив би 73,9 грама ртуті та 26,1 грама хлору. Скільки родимок кожного атома представляють окремі маси?
Для Меркурія:
\[(73.9 \;g) \times \left(\dfrac{1\; mol}{200.59\; g}\right) = 0.368 \;moles\]
Для хлору:
\[(26.1\; g) \times \left(\dfrac{1\; mol}{35.45\; g}\right) = 0.736\; mol \]
Яке молярне співвідношення між двома елементами?
\[\dfrac{0.736 \;mol \;Cl}{0.368\; mol\; Hg} = 2.0 \]
Таким чином, у нас в два рази більше родимок (тобто атомів) Cl, ніж Hg. Таким чином, емпірична формула буде (не забудьте перерахувати катіон першим, аніон останній):
\[HgCl_2 \]
Молекулярна формула з емпіричної формули
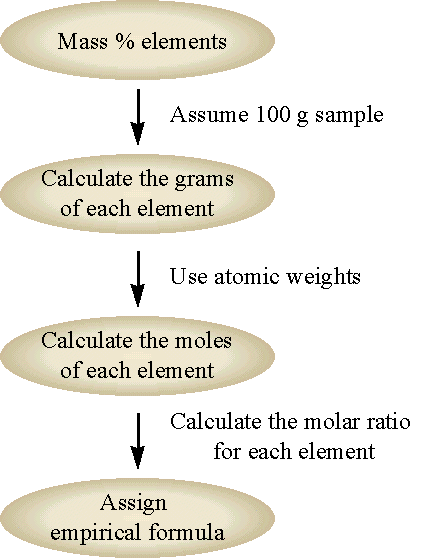
Хімічна формула з'єднання, отриманого шляхом аналізу складу, завжди є емпіричною формулою. Ми можемо отримати хімічну формулу з емпіричної формули, якщо знаємо молекулярну масу сполуки. Хімічна формула завжди буде деяким цілим числом кратним емпіричній формулі (тобто цілим кратним індексам емпіричної формули). Загальний перебіг цього підходу показано на малюнку\(\PageIndex{1}\) та продемонстровано на прикладі\(\PageIndex{2}\).
Приклад\(\PageIndex{2}\): Ascorbic Acid
Вітамін С (аскорбінова кислота) містить 40,92% С, 4,58% Н і 54,50% O, по масі. Експериментально визначена молекулярна маса становить 176 аму. Яка емпірична і хімічна формула аскорбінової кислоти?
Рішення
Розглянемо довільну кількість 100 грам аскорбінової кислоти, щоб у нас вийшло:
- 40,92 грама С
- 4,58 г Н
- 54.50 г О
Це дало б нам, скільки родимок кожного елемента?
- Вуглець
\[ (40.92\; \cancel{g\; C}) \times \left( \dfrac{1\; mol\; C}{12.011\; \cancel{g\; C}} \right) = 3.407\; mol \; C \]
- Водень
\[ (4.58\; \cancel{g\; H}) \times \left( \dfrac{1\; mol\; H}{1.008\; \cancel{g\; H}} \right) = 4.544\; mol \;H \]
- Кисень
\[ (54.50\; \cancel{g\; O}) \times \left( \dfrac{1\; mol\; O}{15.999\; \cancel{g\; O}} \right) = 3.406\; mol \; O \]
Визначте найпростіше співвідношення цілого числа, діливши на найменшу молярну кількість (3,406 моль в даному випадку - див. Кисень):
- Вуглець
\[ C= \dfrac{3.407\; mol}{3.406\; mol} \approx 1.0\]
- Водень
\[ C= \dfrac{4.5.44\; mol}{3.406\; mol} = 1.0\]
- Кисень
\[ C= \dfrac{3.406\; mol}{3.406\; mol} = 1.0\]
Відносні молярні кількості вуглецю та кисню здаються рівними, але відносна молярна кількість водню вище. Оскільки ми не можемо мати «дробові» атоми в сполуці, нам потрібно нормалізувати відносну кількість водню рівним цілому числу. 1.333 буде здаватися 1 і 1/3, тому якщо ми помножимо відносну кількість кожного атома на «3», ми повинні мати можливість отримати ціле значення для кожного атома.
C = (1,0) * 3 = 3
Ч = (1,333) * 3 = 4
О = (1,0) * 3 = 3
або
З 3 Ч 4 О 3
Це наша емпірична формула аскорбінової кислоти.
А як щодо хімічної формули? Нам розповідають, що експериментально визначена молекулярна маса становить 176 аму. Яка молекулярна маса нашої емпіричної формули?
(3* 12,011) + (4* 1,008) + (3* 15,999) = 88.062 ранку
Молекулярна маса з нашої емпіричної формули значно нижче, ніж експериментально визначене значення. Яке співвідношення між двома значеннями?
(176 аму/88.062 амуру) = 2.0
Таким чином, здавалося б, що наша емпірична формула по суті становить половину маси фактичної молекулярної маси. Якби ми помножили нашу емпіричну формулу на «2», тоді молекулярна маса була б правильною. Таким чином, фактична молекулярна формула:
2* С 3 Н 4 О 3 = С 6 Н 8 О 6
Аналіз горіння
Коли з'єднання, що містить вуглець і водень, піддається згорянню з киснем в спеціальному апараті горіння весь вуглець перетворюється в СО 2, а водень - в Н 2 О (рис.\(\PageIndex{2}\)). Кількість виробленого вуглецю можна визначити шляхом вимірювання кількості виробленого CO 2. Це потрапляє в пастку гідроксиду натрію, і таким чином ми можемо контролювати масу виробленого СО 2 шляхом визначення збільшення маси пастки СО 2. Так само ми можемо визначити кількість Н, що виробляється кількістю H 2 O, захопленого перхлоратом магнію.
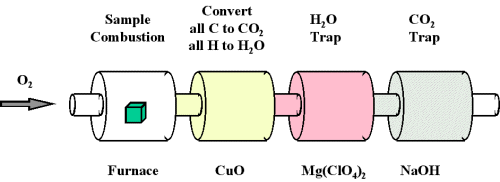
Одним з найпоширеніших способів визначення елементного складу невідомого вуглеводню є аналітична процедура, яка називається аналізом горіння. Невеликий, ретельно зважений зразок невідомого з'єднання, який може містити вуглець, водень, азот і/або сірку, спалюється в атмосфері кисню, інші елементи, такі як метали, можуть бути визначені іншими методами. і кількості одержуваних газоподібних продуктів (CO 2, H 2 O, N 2, і SO 2 відповідно) визначаються одним з декількох можливих методів. Одна процедура, яка використовується при аналізі горіння, схематично викладена на малюнку,\(\PageIndex{3}\) а типовий аналіз горіння проілюстрований на прикладах\(\PageIndex{3}\) і\(\PageIndex{4}\).

Приклад\(\PageIndex{3}\): Combustion of Isopropyl Alcohol
Яка емпірична формула для ізопропілового спирту (який містить лише С, Н і О), якщо при згорянні зразка ізопропілового спирту 0,255 г утворюється 0,561 г СО 2 і 0,306 г Н 2 О?
Рішення
З цієї інформації кількісно визначають кількість С і Н в зразку.
\[ (0.561\; \cancel{g\; CO_2}) \left( \dfrac{1 \;mol\; CO_2}{44.0\; \cancel{g\;CO_2}}\right)=0.0128\; mol \; CO_2 \]
Оскільки один моль СО 2 складається з одного моля С і двох родимок О, якщо у нас в зразку є 0,0128 молі СО 2, то ми знаємо, що у зразку є 0,0128 молі С. Скільки грамів С це?
\[ (0.0128 \; \cancel{mol\; C}) \left( \dfrac{12.011\; g \; C}{1\; \cancel{mol\;C}}\right)=0.154\; g \; C \]
Як щодо водню?
\[ (0.306 \; \cancel{g\; H_2O}) \left( \dfrac{1\; mol \; H_2O}{18.0\; \cancel{g \;H_2O}}\right)=0.017\; mol \; H_2O \]
Так як один моль Н 2 О складається з одного моля кисню і двох молів водню, якщо у нас 0,017 моль Н 2 О, то у нас 2* (0,017) = 0,034 молі водню. Оскільки водень становить близько 1 грам/моль, у нашому вихідному зразку ми повинні мати 0,034 грама водню.
Коли ми додаємо наш вуглець і водень разом, ми отримуємо:
0,154 грама (С) + 0,034 грам (Н) = 0,188 грам
Але ми знаємо, що спалили 0,255 грама ізопропілового спирту. «Відсутня» маса повинна бути з атомів кисню в ізопропіловому спирті:
0,255 грам - 0,188 грам = 0,067 грам кисню
Це багато кисню - скільки родимок?
\[ (0.067 \; \cancel{g\; O}) \left( \dfrac{1\; mol \; O}{15.994\; \cancel{g \;O}}\right)=0.0042\; mol \; O \]
Таким чином, в цілому ми маємо:
- 0,0128 молів вуглецю
- 0,0340 молі водню
- 0,0042 молі кисню
Розділіть на найменшу молярну кількість для нормалізації:
- C = 3,05 атомів
- Н = 8,1 атома
- О = 1 атом
В рамках експериментальної помилки найбільш імовірною емпіричною формулою пропанолу буде\(C_3H_8O\)
Приклад\(\PageIndex{4}\): Combustion of Naphalene
Нафталін, діюча речовина одного різновиду нафталів, є органічною сполукою, яка містить лише вуглець і водень. При повному згорянні 20,10 мг зразка нафталіну в кисні вийшло 69,00 мг СО 2 і 11,30 мг Н 2 О. Визначити емпіричну формулу нафталіну.
Задано: маса проби і маса продуктів згоряння
Запитано: емпірична формула
Стратегія:
- Використовують маси і молярні маси продуктів згоряння CO 2 і H 2 O, для розрахунку мас вуглецю і водню, присутніх у вихідній пробі нафталіну.
- Використовуйте ці маси і молярні маси елементів для обчислення емпіричної формули нафталіну.
Рішення:
A При згорянні\(\ce{CO2}\) виробляється 1 моль на кожен моль атомів вуглецю в вихідному зразку. Аналогічно, 1 моль H 2 O виробляється на кожні 2 моль атомів водню, присутніх у зразку. Маси вуглецю і водню в вихідному зразку можна розрахувати за цими співвідношеннями, мас СО 2 і Н 2 О і їх молярних мас. Оскільки одиницями молярної маси є грами на моль, ми повинні спочатку перетворити маси з міліграмів в грами:
\[ mass \, of \, C = 69.00 \, mg \, CO_2 \times {1 \, g \over 1000 \, mg } \times {1 \, mol \, CO_2 \over 44.010 \, g \, CO_2} \times {1 \, mol C \over 1 \, mol \, CO_2 } \times {12.011 \,g \over 1 \, mol \, C} \]
\[ = 1.883 \times 10^{-2} \, g \, C \]
\[ mass \, of \, H = 11.30 \, mg \, H_2O \times {1 \, g \over 1000 \, mg } \times {1 \, mol \, H_2O \over 18.015 \, g \, H_2O} \times {2 \, mol H \over 1 \, mol \, H_2O } \times {1.0079 \,g \over 1 \, mol \, H} \]
\[ = 1.264 \times 10^{-3} \, g \, H \]
B Для отримання відносних чисел атомів обох присутніх елементів нам потрібно обчислити кількість молей кожного і розділити на кількість молей присутнього елемента в найменшій кількості:
\[ moles \, C = 1.883 \times 10^{-2} \,g \, C \times {1 \, mol \, C \over 12.011 \, g \, C} = 1.568 \times 10^{-3} \, mol C \]
\[ moles \, H = 1.264 \times 10^{-3} \,g \, H \times {1 \, mol \, H \over 1.0079 \, g \, H} = 1.254 \times 10^{-3} \, mol H \]
Ділення кожного числа на кількість молей елемента, присутнього в меншій кількості, дає
\[H: {1.254\times 10^{−3} \over 1.254 \times 10^{−3}} = 1.000 \, \, \, C: {1.568 \times 10^{−3} \over 1.254 \times 10^{−3}}= 1.250\]
При цьому нафталін містить співвідношення молів вуглецю 1. 25:1 до молів водню: С 1,25 Н 1,0. Оскільки співвідношення елементів в емпіричній формулі повинні виражатися невеликими цілими числами, помножте обидва індекси на 4, що дає C 5 H 4 як емпіричну формулу нафталіну. Насправді молекулярна формула нафталіну - C 10 H 8, що відповідає нашим результатам.
Вправа 1\(\PageIndex{4}\)
- Ксилол, органічна сполука, яка є основним компонентом багатьох бензинових сумішей, містить лише вуглець і водень. Повне згоряння 17,12 мг зразка ксилолу в кисні дало 56,77 мг СО 2 і 14,53 мг Н 2 О. Визначити емпіричну формулу ксилолу.
- Емпірична формула бензолу - СН (його молекулярна формула - С 6 Н 6). Якщо 10,00 мг бензолу піддати аналізу на горіння, то яка маса СО 2 і Н 2 О буде вироблятися?
- Відповідь на
-
Емпірична формула - C 4 H 5. (Молекулярна формула ксилолу насправді C 8 H 10.)
- Відповідь б
-
33,81 мг СО 2; 6,92 мг Н 2 О
Вправа 2
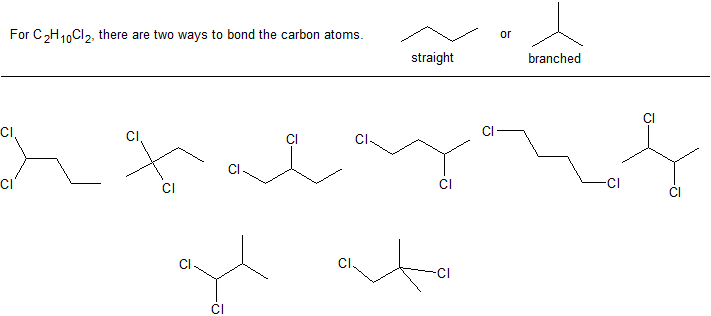
Елементний аналіз органічної сполуки вказує на те, що її склад становить 37,82% вуглецю, 6,36% водню та 55,82% хлору.
а Яка емпірична формула для цієї сполуки?
б. масовий спектральний аналіз вказує на молярну масу 129 г/моль. Яка молекулярна формула цієї сполуки?
c Намалюйте всі можливі структури лінії зв'язку за допомогою цієї молекулярної формули.
Рішення для вправ 2
а. C 2 H 5 Cl з молярною масою 64,5 г/моль
б С 4 Н 10 Сл 2
с. існує 8 можливих структур з молекулярною формулою C 4 H 10 Cl 2. Це може допомогти почати з різних вуглецевих магістралей, а потім систематично додавати будь-які гілки (замінники).