1.14: Прогнозування відносної кислотності
- Page ID
- 22856
Мета навчання
- Прогнозувати відносні сили кислот і підстав з їх структури, зв'язку та резонансу
Оскільки сполуки нейтральні, може бути важко оцінити і порівняти їх загальну стабільність, не проходячи стомлюючий процес виконання розрахунків енергії зв'язку.
Коли кислі сполуки здають іони водню або приймають електрони, вони стають іонізованими. Порівняти іони набагато простіше, оскільки ми можемо оцінити щільність заряду. Чим нижче щільність заряду, тим стабільніше іон. І навпаки, чим вище щільність заряду, тим менш стабільний іон. Щільність заряду аналогічна щільності речовини. Розміщуємо заряд в чисельнику, замість маси, а обсяг ще можна знайти в знаменнику.
\[ \text{charge density} =\dfrac{\text{charge}}{\text{volume}}\]
Шість сильних кислот (HCl, HBr, HI, HNO 3, H 2 SO 4, HClO 4) повністю іонізуються, утворюючи високостабільні аніони (Cl -, Br -, I -, NO 3 -, SO 4 2-, ClO 4 -) відповідно.
Для інших слабких кислот (ГК) ми можемо визначити їх відносну кислотність шляхом порівняння відносних електронних щільностей їх кон'югатних основ (А -).
чим нижче електронна щільність, тим стабільніше сполучена основа
Структурний вплив на електронну щільність - чотири міркування
Існує чотири основні міркування для оцінки електронної щільності.
- Ідентичність елемента або атомів, що тримають заряд
- Чи може заряд делокалізуватися резонансом?
- Чи є індуктивні ефекти?
- Гібридизація орбітального утримання заряду
Ці міркування перераховані в порядку важливості і пояснюються індивідуально, але їх слід розглядати колективно.
Ідентичність стихії
При порівнянні тотожності елементів вона залежить від позиційного співвідношення елементів на таблиці Менделєєва.
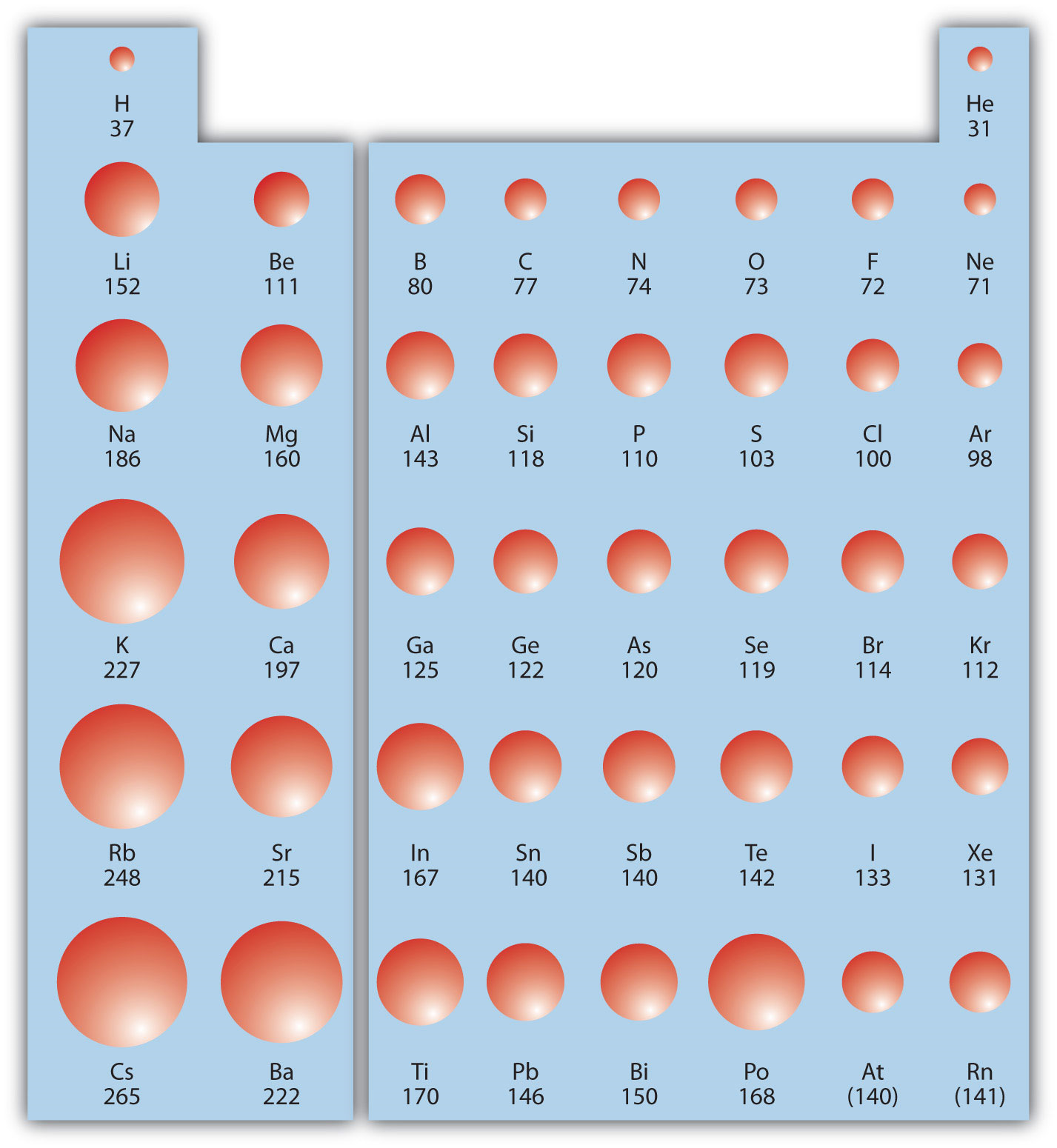
У групі (він же вниз по стовпчику) Коли ми рухаємося вниз по періодичній таблиці, електрони займають більш високі енергетичні підоболонки, створюючи більший атомний розмір і об'єм. Зі збільшенням обсягу електронна щільність зменшується.
\(\PageIndex{1}\)На малюнку показані сфери, що представляють атоми s і p блоків з періодичної таблиці до масштабу, показуючи дві тенденції для атомного радіуса.
Цей зв'язок атомного розміру та електронної щільності ілюструється, коли ми порівнюємо відносні кислотності метанолу, CH 3 OH, з метанетиолом, CH 3 SH. Нижнє значення pKA 10,4 для метанетиолу вказує на те, що це сильніша кислота, ніж метанол зі значенням pKA 15,5. Важливо пам'ятати, що жодне з'єднання не вважається кислотою. Ці відносини стають корисними при спробі депротонувати сполуки для підвищення їх хімічної реакційної здатності в неводних умовах реакції.
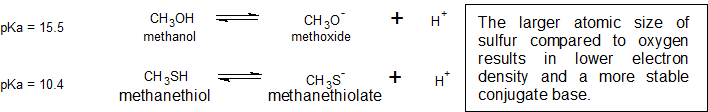
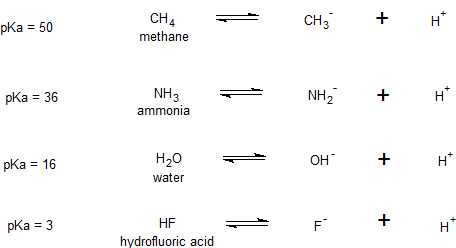
Через період (він же через ряд) Коли ми рухаємося через період основних елементів групи, валентні електрони займають орбіталі в одній оболонці. Ці електрони мають порівнянну енергію, тому цей фактор не допомагає нам розрізнити відмінності відносної стійкості. Відмінності в електронегативності зараз є домінуючим фактором. Ця тенденція показана при порівнянні значень pKA метану, аміаку, води та плавикової кислоти, відображає відносну електронегативність C < N < O < F.
періодичні тенденції
Спочатку зупинимося на окремих атомах, і подумаємо про тенденції, пов'язані з положенням елемента в таблиці Менделєєва. Ми будемо використовувати в якості наших перших моделей прості органічні сполуки етан, метиламін і етанол, але концепції однаково застосовуються до більш складних біомолекул, таких як бічні ланцюги аланіну, лізину та серину.
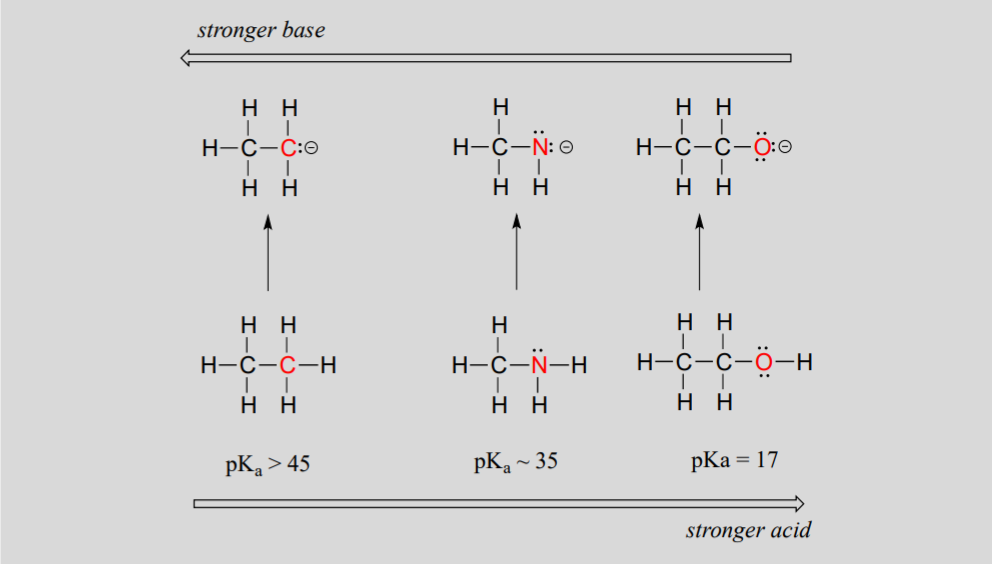
Ми бачимо чітку тенденцію кислотності, коли ми рухаємося зліва направо вздовж другого ряду періодичної таблиці від вуглецю до азоту до кисню. Ключ до розуміння цієї тенденції полягає в розгляді гіпотетичної сполученої основи в кожному випадку: чим стабільніше (слабкіше) сполучена основа, тим сильніше кислота. Подивіться, де негативний заряд закінчується в кожній сполученій основі. У етиланіоні негативний заряд несе вуглець, тоді як в метиламін-аніоні і етоксид-аніоні заряди розташовуються на азоті і кисні відповідно. Пам'ятайте періодичну тенденцію в електронегативності (розділ 2.3А): вона також збільшується, коли ми рухаємося зліва направо уздовж ряду, що означає, що кисень є найбільш електронегативним з трьох, а вуглець - найменше. Чим більше електронегативний атом, тим краще він здатний нести негативний заряд. Таким чином, етоксид-аніон є найбільш стабільним (найнижча енергія, найменш основна) з трьох кон'югатних основ, а етиланіон - найменш стійким (найвища енергія, найосновніша).
Ми можемо використовувати той самий набір ідей, щоб пояснити різницю в основності між водою та аміаком.
Дивлячись на значення pK a для відповідних кон'югатних кислот, ми знаємо, що аміак є більш основним, ніж вода. Кисень, як більш електронегативний елемент, міцніше тримається до своєї самотній парі, ніж азот. Отже, одинока пара азоту з більшою ймовірністю відірветься і утворює новий зв'язок з протоном - він, іншими словами, більш базовий. Знову ж таки, більш реактивна (сильніша) кон'югатна основа означає менш реактивну (слабшу) кон'югатну кислоту.
При переміщенні по вертикалі в межах заданого стовпця таблиці Менделєєва ми знову спостерігаємо чітку періодичну тенденцію кислотності. Найкраще це ілюструється галогенідами: основність, як електронегативність, збільшується, коли ми рухаємося вгору по колонці.
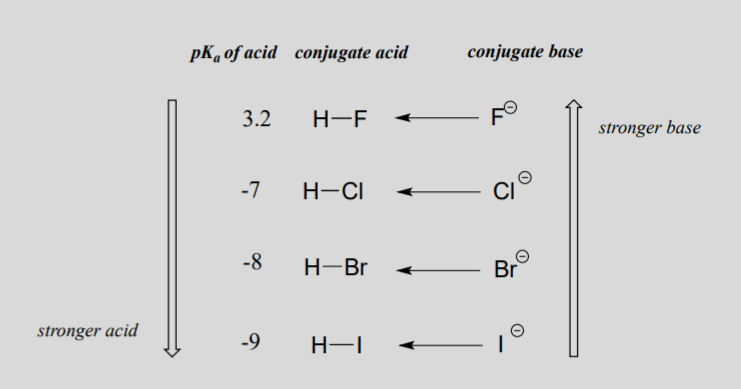
І навпаки, кислотність в галокислотах збільшується, коли ми рухаємося вниз по колоні.
Для того щоб зрозуміти цю тенденцію, ми ще раз розглянемо стійкість сполучених основ. Оскільки фтор є найбільш електронегативним галогенним елементом, ми можемо очікувати, що фтор також буде найменш основним іоном галогену. Але насправді вона найменш стабільна, і найголовніша! Виходить, що при переміщенні по вертикалі в таблиці Менделєєва розмір атома перевершує його електронегативність щодо основності. Атомний радіус йоду приблизно в два рази більше, ніж у фтору, тому в іоні йоду негативний заряд розкидається на значно більший обсяг:
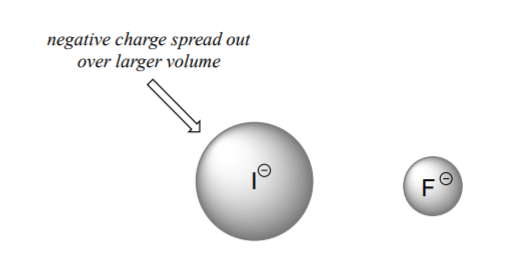
Це ілюструє фундаментальну концепцію в органічній хімії, яка досить важлива, щоб покласти червоним кольором:
Електростатичні заряди, будь то позитивні чи негативні, є більш стабільними, коли вони «розподілені», ніж коли вони обмежені одним атомом.
Ми побачимо цю ідею, висловлену знову і знову протягом нашого вивчення органічної реактивності, у багатьох різних контекстах. Наразі поняття застосовується лише до впливу атомного радіуса на аніонну стійкість. Оскільки фтор є найменш стабільним (найбільш основним) з галогенідних кон'югатних основ, HF є найменш кислим з галокислот, лише трохи сильніше оцтової кислоти. HI, з pK a близько -9, є однією з найсильніших кислот, відомих.
Що ще важливіше для вивчення біологічної органічної хімії, ця тенденція говорить нам про те, що тіоли більш кислі, ніж спирти. Наприклад, рК а тіольної групи на бічному ланцюзі цистеїну становить приблизно 8,3, тоді як pK a для гідроксилу на серин-бічному ланцюзі - близько 17.
Повторюємо: сила кислоти збільшується, коли ми рухаємося вправо вздовж ряду Менделєєва таблиця, і в міру того, як ми рухаємося вниз стовпчиком.
Приклад\(\PageIndex{1}\):
Намалюйте структуру сполученої основи, яка утворилася б, якби сполука нижче реагувала з 1 молярним еквівалентом гідроксиду натрію:
Рішення
Чи можливо резонанс локалізувати заряд?
У попередньому розділі ми зосередили свою увагу на періодичних тенденціях - відмінностях кислотності та основності між групами, де обмінний протон був пов'язаний з різними елементами. Тепер настав час подумати про те, як структура різних органічних груп сприяє їх відносній кислотності або основності, навіть коли мова йде про один і той же елемент, який діє як донор/акцептор протонів. Оцінюючи сполучені основи на наявність дописувачів резонансу, пам'ятайте про пошук рухомих електронів, як описано в розділі 1.10 цієї глави. Делокалізація електронів над двома або більше атомами знижує електронну щільність.
Перша модельна пара, яку ми розглянемо, - етанол і оцтова кислота, але висновки, які ми дійдемо, будуть однаково справедливі для всіх груп спирту і карбонових кислот. Незважаючи на те, що вони обидві кисневі кислоти, значення pK a етанолу і оцтової кислоти сильно відрізняються. Що робить карбонову кислоту набагато більш кислою, ніж спирт? Як і раніше, почнемо з розгляду сполучених основ.
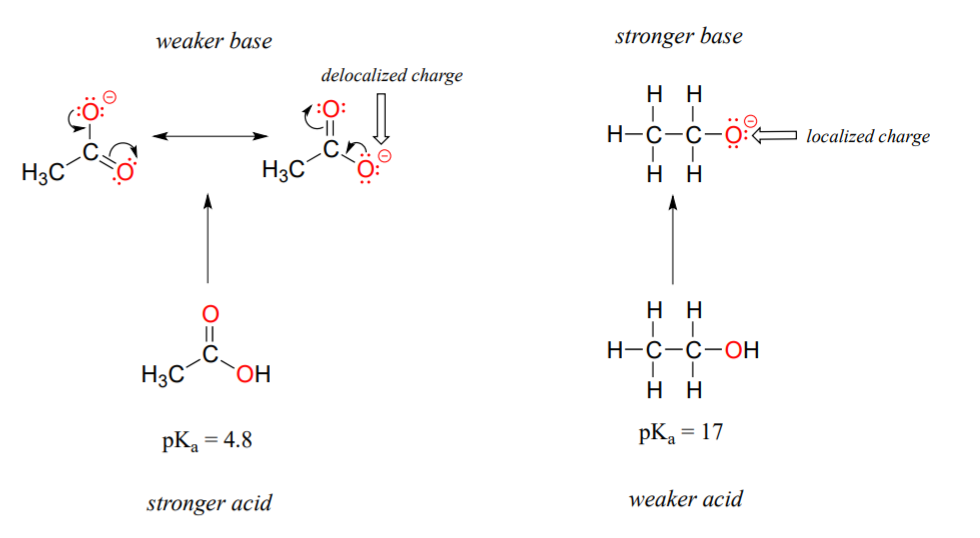
У обох видів негативний заряд на сполученій основі утримується киснем, тому періодичні тенденції не можуть бути викликані. Для оцтової кислоти, однак, є ключова відмінність: може бути намальований резонансний внесок, в якому негативний заряд локалізується на другому кисні групи. Дві резонансні форми для сполученої основи рівні за енергією, згідно з нашими «правилами резонансу» (розділ 2.2C). Що це означає, ви можете згадати, це те, що негативний заряд на ацетатному іоні розташований не на одному чи іншому кисні: скоріше він розділений між ними. Хіміки використовують термін «делокалізація заряду» для опису цієї ситуації. У етоксид-іоні, навпаки, негативний заряд «заблокований» на одному кисні — йому більше нікуди діватися.
Тепер настав час подумати про те твердження з попереднього розділу, яке було настільки важливим, що воно було надруковано жирним шрифтом у власному абзаці - насправді, це настільки важливо, що ми просто скажемо це ще раз: «Електростатичні заряди, будь то позитивні чи негативні, є більш стабільними, коли вони «розповсюджені», ніж коли вони обмежені одним атомом». Тепер ми бачимо цю концепцію в іншому контексті, де заряд «поширюється» (іншими словами, делокалізований) резонансом, а не просто розміром задіяного атома.
Делокалізація заряду резонансом має дуже потужний вплив на реакційну здатність органічних молекул, достатню для обліку різниці понад 12 pK одиниць між етанолом і оцтовою кислотою (і пам'ятайте, pK а - це логічний вираз, тому мова йде про різницю понад 10 12 між константами кислотності для двох молекул). Ацетатний іон набагато стабільніший, ніж етоксид-іон, все завдяки наслідкам резонансної делокалізації.
Резонансний ефект також добре пояснює, чому атом азоту є основним, коли він знаходиться в аміні, але не основним, коли він є частиною амідної групи. Нагадаємо, що в аміді існує значний характер подвійного зв'язку зв'язку вуглець-азот, завдяки другому внеску резонансу, в якому одинична пара азоту є частиною зв'язку р.
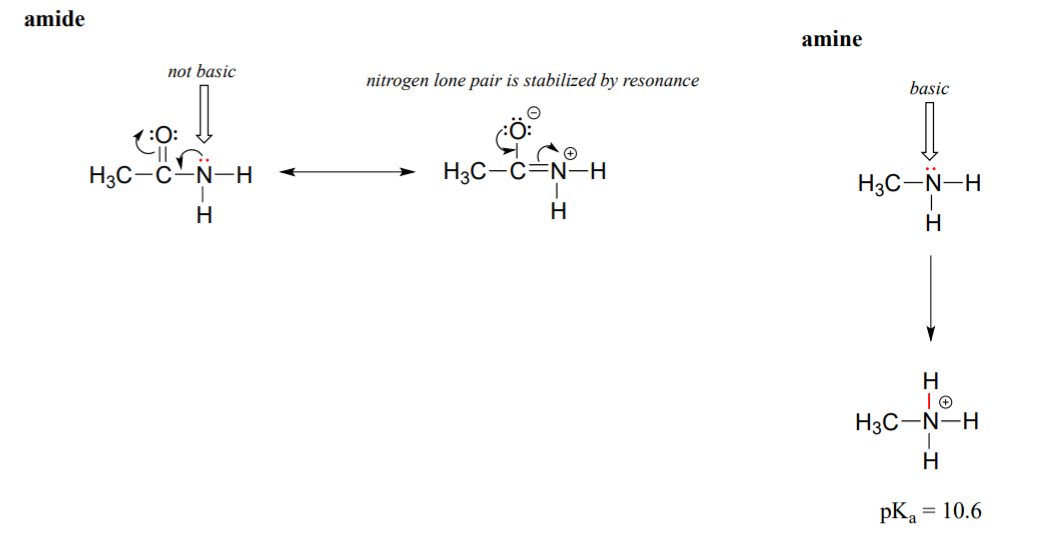
У той час як електронна одинока пара амінного азоту «застрягла» в одному місці, одинока пара на амідному азоті делокалізована резонансом. Зверніть увагу, що в цьому випадку ми розширюємо наше центральне твердження, щоб сказати, що електронна щільність - у вигляді одинокої пари - стабілізується резонансною делокалізацією, хоча негативний заряд не бере участі. Ось ще один спосіб подумати про це: одинока пара на амідному азоті недоступна для зв'язку з протоном - ці два електрони занадто «зручні», будучи частиною делокалізованої системи пі-зв'язування. Самотня пара на амінному азоті, навпаки, не є частиною делокалізованої системи р і дуже готова сформувати зв'язок з будь-яким кислим протоном, який може бути поруч.
Часто це вимагає певної ретельної думки, щоб передбачити найбільш кислий протон на молекулі. Аскорбінова кислота, також відома як вітамін С, має pK a 4.1.
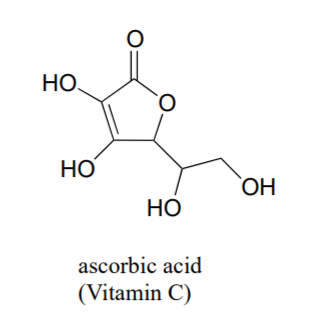
На цій молекулі є чотири гідроксильні групи - яка з них найбільш кисла? Якщо розглядати всі чотири можливі сполучені основи, то виявимо, що існує лише одна, для якої ми можемо делокалізувати негативний заряд над двома атомами кисню.
Приклад\(\PageIndex{1}\):
Оцініть сполуки нижче від більшості кислих до найменш кислих і поясніть свої міркування.
(CC-NC-SA; Тімоті Содерберг через Мун Морріс Цифрова свердловина)
Індуктивні ефекти
Індуктивний ефект - це експериментально спостерігається ефект передачі заряду по ланцюжку атомів в молекулі, в результаті чого в зв'язку утворюється постійний диполь. Індуктивні ефекти швидко зменшуються з відстанню. Індуктивним ефектом може бути донорство електронів, що допомагає стабілізувати позитивний заряд. Алкільні групи (вуглеводні) є індуктивними донорами електронів. Індуктивним ефектом також може бути відведення електронів. Електронегативність вказує на силу індукції виведення електронів. Галогени - це групи індуктивного виведення електронів.
Вплив індукції на відносну кислотність також можна побачити при порівнянні оцтової кислоти з трифтороцтової кислотою. Різниця в кислотності не пов'язана з резонансною делокалізацією, оскільки ніякі додаткові резонансні структури не можуть бути намальовані для фторованої молекули. Атоми фтору індуктивно відтягують частину електронної щільності від іона карбоксилату, щоб ще більше делокалізувати негативний заряд кон'югатної основи.
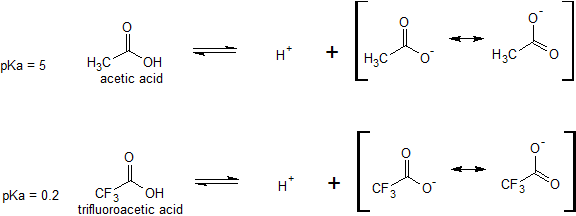
Порівняйте значення pK a оцтової кислоти та її моно-, ді- та трихлорованих похідних:
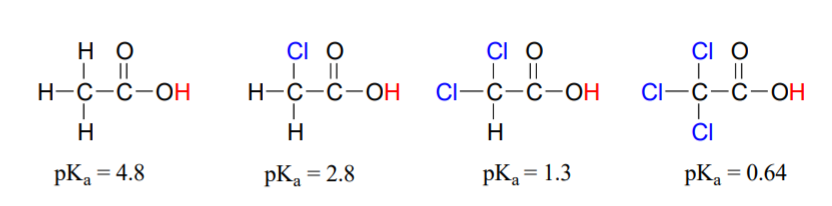
(CC-NC-SA; Тімоті Содерберг через Мун Морріс Цифрова свердловина)
Наявність хлорів явно підвищує кислотність групи карбонових кислот. Атом хлору є більш електронегативним, ніж водень, і, таким чином, здатний «індукувати» або «тягнути» електронну щільність до себе, подалі від карбоксилатної групи. Допомагаючи подальшому поширенню електронна щільність сполученого підстави, яка, як ми знаємо, надає стабілізуючу дію. У цьому контексті замісник хлору називають групою відведення електронів. Зверніть увагу, що pK -знижуючий ефект кожного атома хлору, хоча і значний, не настільки драматичний, як делокалізуючий резонансний ефект, ілюстрований різницею в значеннях pK a між спиртом і карбоновою кислотою. В цілому резонансні ефекти більш потужні, ніж індуктивні. Індуктивний ефект відведення електронів хлору відбувається через ковалентні зв'язки, і його вплив помітно зменшується з відстанню - таким чином хлор два вуглеці від групи карбонових кислот має знижений ефект порівняно з хлором лише один вуглець.
| Вправа |
|---|
|
Оцініть сполуки нижче від більшості кислих до найменш кислих і поясніть свої міркування.
|
Орбітальна гібридизація
Гібридизація орбіти впливає на її електронегативність. Усередині оболонки s орбіталі займають область ближче до ядра, ніж p орбіталі. Тому сферичні орбіталі s більш електронегативні, ніж лопатеві p орбіталі. Відносна електронегативність гібридизованих орбіталів становить sp > sp 2 > sp 3. Ця тенденція вказує на те, що гібридизовані орбіталі sp більш стабільні з -1 зарядом, ніж sp 3 гібридизовані орбіталі. У таблиці нижче показано, як орбітальна гібридизація порівнюється з ідентичністю атома при прогнозуванні відносної кислотності.
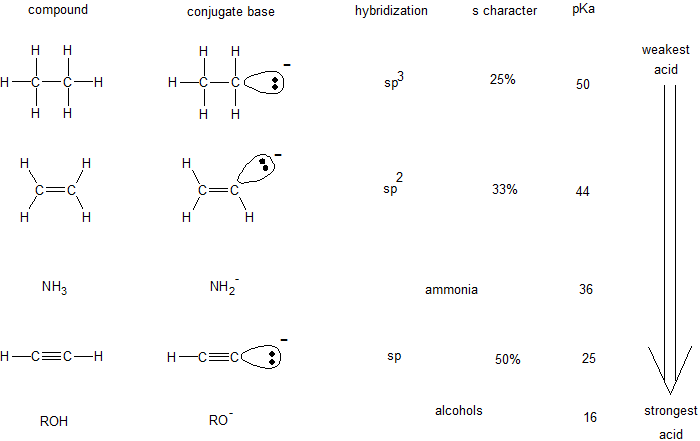
Керована практика
Попрактикуємося, порівнявши відносну кислотність фенолу з оцтовою кислотою.
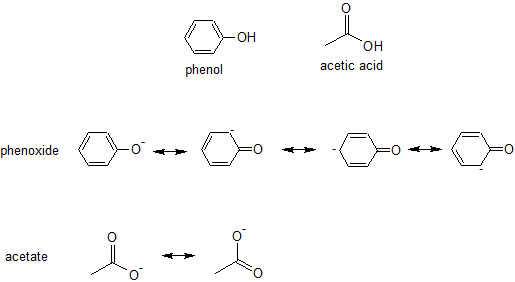
Яке з'єднання є сильнішою кислотою - фенолом або оцтовою кислотою?
Щоб відповісти на це питання, ми малюємо всі відповідні резонансні дописувачі для кожної сполученої основи, феноксиду та ацетату відповідно.
Феноксид має чотири резонансні вкладники, але три з учасників мають негативний заряд на атомі вуглецю, тоді як обидва резонансні вкладники для ацетату мають негативний заряд на більш електронегативний елемент кисню. У цьому прикладі немає індуктивних ефектів або відмінностей орбітальної гібридизації, тому ми б прогнозували, що оцтова кислота буде сильнішою кислотою. Ацетатний іон є більш стабільним, ніж іон феноксиду, тому ми очікуємо, що оцтова кислота буде сильнішою кислотою.
Таблиця PkA нижче підтримує наш прогноз. Оцтова кислота має рКа 4,7, тоді як фенол має рКа 9,9.
Слово застереження: при використанні таблиці pK будьте абсолютно впевнені, що ви розглядаєте правильну сполучену пару кислота/основа. Якщо вас попросять сказати щось про основність аміаку (NH 3) порівняно з іоном етоксиду (CH 3 CH 2 O -), наприклад, відповідні значення pK a, які слід враховувати, становлять 9,2 (рК а іона амонію) та 16 (pK a з етанол). З цих чисел ви знаєте, що етоксид є більш міцною основою. Не робіть помилки, використовуючи pK значення 38: це pK a аміаку, що діє як кислота, і розповідає, наскільки основним є NH 2 - іон (дуже основний!)




Автори та атрибуція
- Органічна хімія з біологічним акцентом Тім Содерберг (Університет Міннесоти, Морріс)
- Лейн Морш (Університет штату Іллінойс Спрінгфілд)