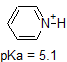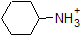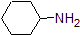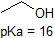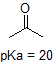1.13: Розрізнення між рН та рК
- Page ID
- 22855
Мета навчання
- Визначте відносні сили кислот і підстав з їх значень pK a
- Визначте форму кислоти або основи при заданому рН (з огляду на pK а)
Рівняння Гендерсона-Хассельбаха - кількісний погляд
Ми будемо використовувати загальну реакцію на слабку кислоту, щоб написати вираз Ка.
\[HA_{(aq)} + H_2O_{(l)} \rightleftharpoons H_3O^+_{(aq)} + A^-_{(aq)}\]
\[K_a = \dfrac{[H_3O^+][A^-]}{[HA]}\]
ПКа = -журнал Ка
де кожен термін в дужках представляє концентрацію цієї речовини в розчині.
Чим сильніше кислота, тим більша іонізація, тим нижче рКа, і тим нижче рН сполука буде виробляти в розчині.
Важливо усвідомлювати, що pK а - це зовсім не те ж саме, що рН: перше - властивість сполуки або функціональної групи, тоді як останній - міра концентрації іонів гідронію в тому чи іншому водному розчині:
рН = -лог [Н 3 О +]
Додаткові реагенти можуть бути додані в реакційний розчин для зміни рН умов реакції поза впливом окремої сполуки.
Відносна кислотність і значення pKA
Застосування рівняння Гендерсона-Хассельбаха полягає в здатності визначати відносну кислотність сполук шляхом порівняння їх значень pKA. Чим сильніше кислота, тим більша іонізація, тим нижче рКа, і тим нижче рН сполука буде виробляти в розчині. Деякі вибрані значення pKA для сполук у дослідженні органічної хімії наведено нижче. Оскільки органічні реакції можуть проводитися в неводних середовищах, рН може перевищувати 14, а органічні сполуки можуть мати значення pKA вище 16. Це варіація на цій лінії від Чарівника країни Оз: «Ми більше не живемо у воді».

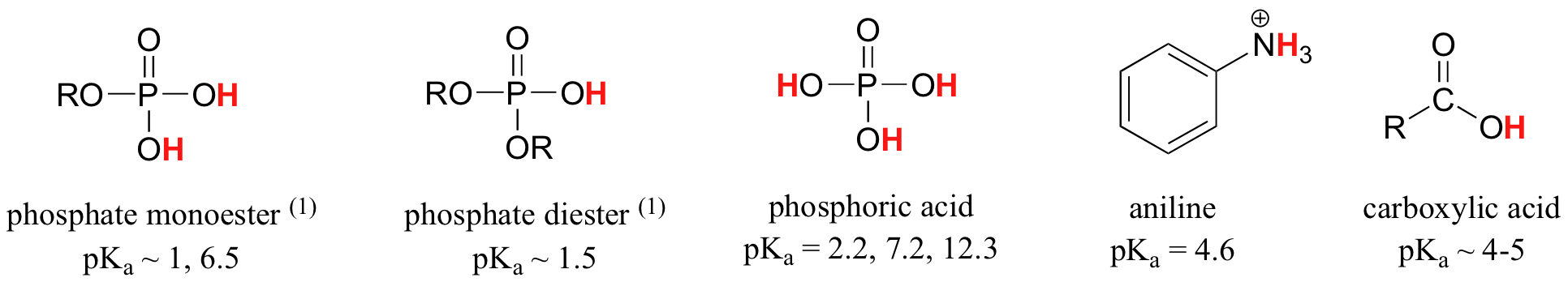



Це дуже гарна ідея, щоб вкласти в пам'ять приблизні pK діапазони сполук вище. Слово застереження: при використанні таблиці pK будьте абсолютно впевнені, що ви розглядаєте правильну сполучену пару кислота/основа. Якщо вас попросять сказати щось про основність аміаку (NH 3) порівняно з іоном етоксиду (CH 3 CH 2 O -), наприклад, відповідні значення pK a, які слід враховувати, становлять 9,2 (рК а іона амонію) та 16 (pK a з етанол). З цих чисел ви знаєте, що етоксид є більш міцною основою. Не робіть помилки, використовуючи pK значення 38: це pK a аміаку, що діє як кислота, і розповідає, наскільки основним є NH 2 - іон (дуже основний!)
* Примітка про pKa води: РКа води дорівнює 14. Біохімія та органічна хімія тексти часто перераховують значення як 15,7. Ці тексти неправильно врахували молярне значення концентрації води в константу рівноваги. Правильне виведення постійної рівноваги передбачає активність води, яка має значення 1.
Приклад
Хоча цей курс починається з окремих функціональних груп, ми врешті-решт працюватимемо з цікавими сполуками, що містять кілька функціональних груп. Визнання того, які водні можуть бути іонізовані як кислі протони, а які - НІ, - корисний навик. Зауважте в цьому прикладі, що нам потрібно оцінити потенційну кислотність в чотирьох різних місцях молекули.
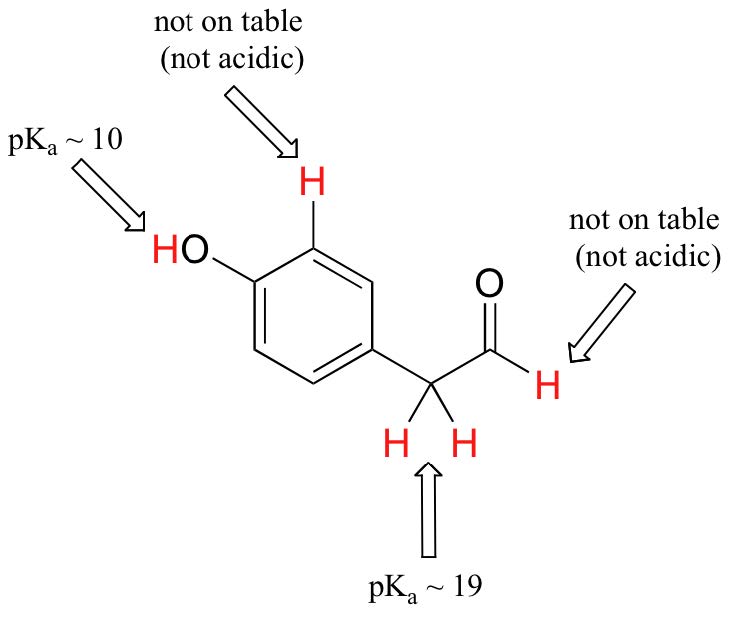
Альдегід і ароматичні протони зовсім не кислі (значення pK а вище 40 - не на нашій таблиці). Два протони на вуглеці поруч з карбонілом є слабокислими, зі значеннями pK близько 19-20 згідно з таблицею. Найбільш кислий протон знаходиться на фенольній групі, тому, якби з'єднання піддавалося єдиному молярному еквіваленту сильної основи, це протон, який був би подарований.
Кислі та основні середовища - все відносне в реактивності
Оскільки наша мета - розуміння динамічної хімічної реакційної здатності, нам НЕ потрібно знати конкретну кількість протонованих та непротонованих форм сполуки. Нам просто потрібно знати, яка форма переважає. Коли рН навколишнього середовища менше рКа з'єднання, середовище вважається кислою і з'єднання буде існувати переважно в протонованому вигляді. Коли рН навколишнього середовища більше, ніж рКа сполуки, середовище вважається основним, і з'єднання буде існувати переважно в його депротонованому вигляді.
Наприклад, рКа оцтової кислоти становить близько 5. При рН 1 середовище вважається кислою, а оцтова кислота існує переважно в протонованому вигляді. При рН 8 середовище вважається основним, а оцтова кислота депротонується з утворенням ацетату (СН 3 СО 2 -). І навпаки, рКа фенолу дорівнює 10. При рН 8 середовище вважається кислою для фенолу і вона залишається в першу чергу протонованою.
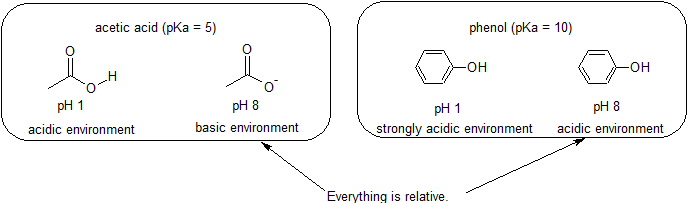
Важливо також пам'ятати, що органічна хімія НЕ повинна відбуватися у воді, тому значення pKA можуть досягати 50.
Вправа
1. Заповніть таблицю нижче, щоб вказати, чи існує кожна сполука переважно у своїй протонованій (кисле середовище) або депротонованої (основне середовище) формі.
| з'єднання (pKA) | рН 1 навколишнього середовища | рН 8 навколишнього середовища | рН 13 навколишнього середовища |
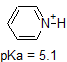 |
|||
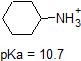 |
|||
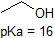 |
|||
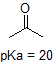 |
- Відповідь
- 1.
-
з'єднання (pKA) рН 1 навколишнього середовища рН 8 навколишнього середовища рН 13 навколишнього середовища