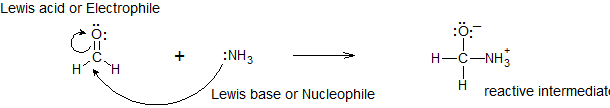1.12: Кислоти та основи Льюїса
- Page ID
- 22820
Мета навчання
- Використовуйте визначення кислот і основ Льюїса для розпізнавання руху електронів в реакціях
Кислоти і основи є важливою складовою хімії. Однією з найбільш застосовних теорій є мотив кислоти/основи Льюїса, який розширює визначення кислоти та основи за межі H + та OH - іонів, як описано кислотами та основами Бронстеда-Лоурі.
Вступ
Кислотно-лужна теорія Brø nsted використовувалася протягом усієї історії хімії кислоти та основи. Однак ця теорія є дуже обмежувальною і зосереджується насамперед на кислотах та підставах, що діють як донори та акцептори протонів. Іноді виникають умови, коли теорія не обов'язково підходить, наприклад, у твердих тілах та газах. У 1923 році Г.Н. Льюїс з UC Berkeley запропонував альтернативну теорію для опису кислот і підстав. Його теорія дала узагальнене пояснення кислот і підстав на основі структури і зв'язку. Завдяки використанню визначення Льюїса кислот і основ, хіміки тепер здатні прогнозувати більш широке розмаїття кислотно-лужних реакцій. Теорія Льюїса використовувала електрони замість передачі протонів і спеціально заявила, що кислота - це вид, який приймає електронну пару, тоді як основа дарує електронну пару.
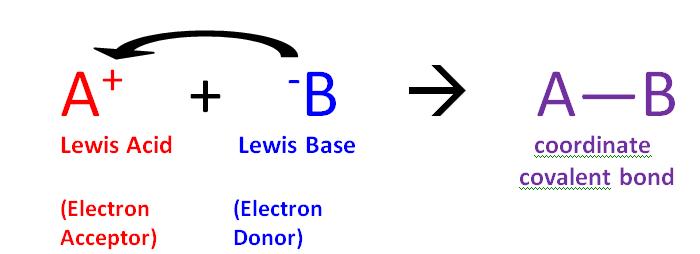
Реакція кислоти Льюїса та основи Льюїса створить координатний ковалентний зв'язок, як показано на малюнку\(\PageIndex{1}\) вище. Координатний ковалентний зв'язок - це лише тип ковалентного зв'язку, в якому один реагент надає йому електронну пару іншому реагенту. У цьому випадку основа Льюїса дарує свої електрони кислоті Льюїса. Коли вони реагують таким чином, отриманий продукт називається додатковою сполукою, або частіше аддуктом.
- Кислота Льюїса: вид, який приймає електронну пару (тобто електрофіл) і матиме вакантні орбіталі
- База Льюїса: вид, який дарує електронну пару (тобто нуклеофіла) і матиме електрони однієї пари
кислоти Льюїса
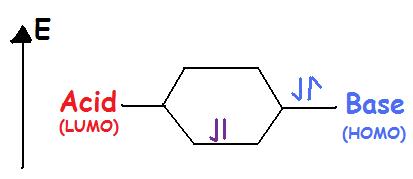
Кислоти Льюїса приймають електронну пару. Кислоти Льюїса є електрофільними означає, що вони привертають електрони. При зв'язуванні з основою кислота використовує найнижчу незайняту молекулярну орбіталь або LUMO (рис. 2).
- В якості кислот Льюїса можуть виступати різні види. Всі катіони - кислоти Льюїса, оскільки вони здатні приймати електрони. (наприклад, Cu 2 +, Fe 2 +, Fe 3 +)
- Атом, іон або молекула з неповним октетом електронів можуть виступати як кислота Льюїса (наприклад, BF 3, AlF 3).
- Молекули, де центральний атом може мати більше 8 електронів валентної оболонки, можуть бути електронними акцепторами, і, таким чином, класифікуються як кислоти Льюїса (наприклад, SiBr 4, SiF 4).
- Молекули, які мають множинні зв'язки між двома атомами різної електронегативності (наприклад, CO 2, SO 2)
Основи Льюїса
Основи Льюїса дарують електронну пару. Основи Льюїса - це нуклеофільні означає, що вони «атакують» позитивний заряд своєю самотньою парою. Вони використовують найвищу зайняту молекулярну орбіту або HOMO (рис. 2). Таким чином, атом, іон або молекула з однією парою електронів можуть бути основою Льюїса. Кожен з наступних аніонів може «віддати» свої електрони кислоті, наприклад,\(OH^-\)\(CN^-\),\(CH_3COO^-\),\(:NH_3\),\(H_2O:\),\(CO:\). HOMO бази Льюїса (найвища зайнята молекулярна орбіталь) взаємодіє з LUMO кислоти Льюїса (найнижча незайнята молекулярна орбіталь) для створення зв'язаних молекулярних орбіталів. Як кислоти Льюїса, так і основи містять HOMO та LumO, але лише HOMO вважається основами, і лише LUMO вважається для кислот (рис.\(\PageIndex{2}\)).
Комплексні іон/координаційні сполуки
Комплексні іони - це багатоатомні іони, які утворюються з центрального іона металу, який має інші менші іони, з'єднані навколо нього. Хоча теорія Бронстеда не може пояснити цю реакцію Льюїс кислотно-лужна теорія може допомогти. Основа Льюїса часто є лігандом координаційної сполуки з металом, що діє як кислота Льюїса (див. Стани окислення перехідних металів).
\[Al^{3+} + 6 H_2O \rightleftharpoons [Al(H_2O)_6]^{3+} \label{1}\]
Іон алюмінію є металом і є катіоном з незаповненою валентною оболонкою, і це кислота Льюїса. Вода має однопарні електрони і є аніоном, таким чином, це база Льюїса.
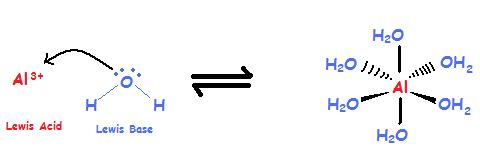
Кислота Льюїса приймає електрони з бази Льюїса, яка дарує електрони. Інший випадок, коли кислотно-лужна теорія Льюїса може пояснити отриману сполуку, - це реакція аміаку з Zn 2 +.
\[ Zn^{2+} + 4NH_3 \rightarrow [Zn(NH_3)_4]^{4+} \label{2}\]
Аналогічно кислота Льюїса - це іон цинку, а база Льюїса - NH 3. Зверніть увагу, як теорія кислот і основ Бронстеда не зможе пояснити, як відбувається ця реакція, оскільки в ній немає\(H^+\) або\(OH^-\) іонів. Таким чином, теорія кислоти та основи Льюїса дозволяє пояснити утворення інших видів та складних іонів, які зазвичай не містять іонів гідронію або гідроксиду. Можна розширити визначення кислоти та основи за допомогою теорії кислоти та основи Льюїса. Відсутність\(OH^-\) іонів\(H^+\) або іонів у багатьох складних іонів може ускладнити визначення того, який вид є кислотою, а який є основою. Тому, визначаючи вид, який дарує електронну пару, і вид, який приймає електронну пару, визначення кислоти та основи розширюється.
Амфотеризм
На даний момент ви повинні знати, що кислоти та основи розрізняються як дві окремі речі, однак деякі речовини можуть бути як кислотою, так і основою. Можливо, ви помітили це з водою, яка може виступати як кислотою, так і основою. Ця здатність води робити це робить її амфотерною молекулою. Вода може діяти як кислота, здаючи свій протон основі і, таким чином, стаючи її кон'югатною кислотою, ОН-. Однак вода також може виступати в якості основи, приймаючи протон з кислоти, щоб стати її кон'югатною основою, H 3 O +.
- Вода, що діє як кислота:
\[H_2O + NH_3 \rightarrow NH_4^+ + OH^- \label{3}\]
- Вода, яка виступає в якості основи:
\[H_2O + HCl \rightarrow Cl^- + H_3O^+ \label{4}\]
Можливо, ви помітили, що ступінь дії молекули залежить від середовища, в якому молекула була поміщена. Вода не діє як кислота в кислому середовищі і не виступає в якості основи в основному середовищі. Таким чином, середовище, в яке поміщена молекула, впливає на властивості цієї молекули. Інші молекули також можуть виступати як кислота, так і основа. Наприклад,
\[Al(OH)_3 + 3H^+ \rightarrow Al^{3+} + 3H_2O \label{5}\]
- де Al (OH) 3 виступає в якості бази Льюїса.
\[Al(OH)_3 + OH^- \rightarrow Al(OH)_4^- \label{6}\]
- де Al (OH) 3 діє як кислота Льюїса.
Зверніть увагу, як амфотерні властивості Al (OH) 3 залежать від того, в якому типі середовища була поміщена ця молекула.
Основи та кислоти Льюїса як нуклеофіли та електрофіли
Акцент на потоці електронів у теорії кислот та основ Льюїса є важливою основою для вивчення та прогнозування механізмів реакції. Багату електронами базу Льюїса можна охарактеризувати як нуклеофіла. Нуклеофіли притягуються і можуть реагувати зі сполуками або іонами, які мають повний або частковий позитивний заряд (як ядро). Бідні електронами кислоти Льюїса можна охарактеризувати як електрофіли. Електрофіли притягують нуклеофіли до тих пір, поки між ними не відбудеться перекриття орбіти, що запускає реакцію. У цей момент курсу ми можемо вказати потік електронів за допомогою вигнутих стрілок, коли дані як реагент (и), так і продукт (и).
Приклад
Вправи
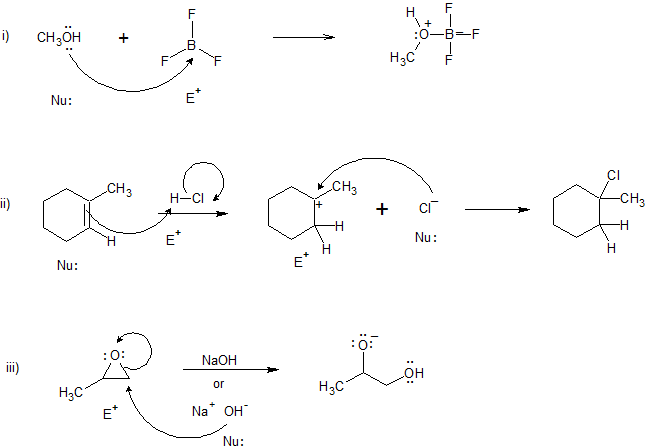
Для наступних реакцій
а) додати вигнуті стрілки для позначення потоку електронів
б) позначити кожен реагент як Nu (нуклеофіл) або E + (електрофіл).
Рішення
Зовнішні посилання
- Дуже детальний огляд кислот та основ Льюїса, що охоплює всі теми цього типу хімії
- Дуже складна та детальна «Матриця взаємодії кислоти та основи Льюїса»
- Youtube Відео про кислоти/основи Льюїса
Посилання
- Циклододавання на Ge (100) кислоти Льюїса AlCl3. Незабаром Юнг Юнг, Янг-Санг Юн,, Хангіл Лі,, Кі-Чон Кім,, Бонг Су Кім, і, Сехун Кім,. Журнал Американського хімічного товариства 2008 130 (11), 3288-3289
- Флуоресцентні максимуми 10-метилакридону? Металеві іонні сольові комплекси: зручний та кількісний показник кислотності Льюїса солей іонів металів. Шунічі Фукузумі і, Кей Окубо. Журнал Американського хімічного товариства 2002 124 (35), 10270-10271.
- Харвуд, Вільям С., Ф.Г. Оселедець, Джеффрі Д. Мадура та Ральф Петруччі. Загальні принципи хімії та сучасні програми. 9-е видання. Нью-Джерсі: Прентіс Холл, 2007. 695-96.
Дописувачі та атрибуція
- Адам Абудра (UCD), Тайндер Бадіаль (UCD)